سرطان: چکیده
امسال انتظار می رود بیش از 1 میلیون آمریکایی و بیش از 10 میلیون نفر در سراسر جهان به سرطان مبتلا شوند، بیماری که معمولاً قابل پیشگیری است. تنها 5 درصد از کل موارد سرطان را می توان به نقایص ژنتیکی نسبت داد، در حالی که 10 درصد بقیه ریشه در محیط و سبک زندگی دارند. عوامل سبک زندگی عبارتند از: سیگار کشیدن، رژیم غذایی (غذاهای سرخ شده، گوشت قرمز)، الکل، قرار گرفتن در معرض نور خورشید، آلاینده های محیطی، عفونت ها، استرس، چاقی و کم تحرکی. شواهد نشان میدهد که از تمام مرگهای مرتبط با سرطان، تقریباً 90 تا 95 درصد به دلیل دخانیات، 25 تا 30 درصد به رژیم غذایی، حدود 30 تا 35 درصد به دلیل عفونت و درصد باقی مانده به دلیل عوامل دیگری مانند تشعشع، استرس، فعالیت بدنی، آلاینده های محیطی و غیره. بنابراین، پیشگیری از سرطان مستلزم ترک سیگار، افزایش مصرف میوه و سبزیجات، مصرف متوسط الکل، محدودیت کالری، ورزش، اجتناب از قرار گرفتن در معرض مستقیم نور خورشید، مصرف حداقل گوشت، استفاده از غلات کامل، استفاده از واکسیناسیون و معاینات منظم. در این بررسی، ما شواهدی را ارائه میکنیم که نشان میدهد التهاب ارتباط بین عوامل/عواملی که باعث سرطان میشوند و عواملی که از آن جلوگیری میکنند است. علاوه بر این، ما شواهدی ارائه می دهیم که سرطان یک بیماری قابل پیشگیری است که به تغییرات عمده در شیوه زندگی نیاز دارد.
کلمات کلیدی: سرطان؛ عوامل خطر زیست محیطی؛ عوامل خطر ژنتیکی؛ جلوگیری.
معرفی
کریگ ونتر، محقق پیشگام ژنومی، پس از تعیین توالی ژنوم خود، در یکی از رهبران کنفرانس قرن بیست و یکم اظهار داشت: "زیست شناسی انسان در واقع بسیار پیچیده تر از آن چیزی است که ما تصور می کنیم." همه در مورد ژن هایی که از مادر و پدر خود برای این یا آن ویژگی دریافت کرده اند صحبت می کنند. اما در واقعیت، این ژن ها تأثیر بسیار کمی بر نتایج زندگی دارند. زیست شناسی ما برای آن بسیار پیچیده است و با صدها هزار عامل مستقل سروکار دارد. ژن ها مطلقاً سرنوشت ما نیستند. آنها می توانند اطلاعات مفیدی در مورد افزایش خطر ابتلا به یک بیماری به ما بدهند، اما در بیشتر موارد علت واقعی بیماری یا میزان واقعی ابتلا به آن را تعیین نمی کنند. بیشتر زیستشناسی از تعامل پیچیده همه پروتئینها و سلولهایی که با عوامل محیطی کار میکنند به دست میآیند، نه اینکه مستقیماً توسط کد ژنتیکی هدایت شوند.indiatoday.digitalto day.in/index.php?option=com_content&task=view&isseid= 48&id=6022§ionid=30&Itemid=1).
این بیانیه بسیار مهم است زیرا نگاه به ژنوم انسان برای راهحلهایی برای اکثر بیماریهای مزمن، از جمله تشخیص، پیشگیری و درمان سرطان، در دنیای امروز بیش از حد مورد تاکید است. با این حال، مطالعات مشاهدهای نشان دادهاند که با مهاجرت از یک کشور به کشور دیگر، شانس ما برای تشخیص بیشتر بیماریهای مزمن نه توسط کشوری که از آن آمدهایم، بلکه توسط کشوری که به آن مهاجرت میکنیم تعیین میشود (1:4). علاوه بر این، مطالعات با دوقلوهای همسان نشان داده است که ژن ها منشا اکثر بیماری های مزمن نیستند. به عنوان مثال، همخوانی بین دوقلوهای همسان برای سرطان سینه تنها 20٪ بود (5). به جای ژنهای ما، سبک زندگی و محیط 90 تا 95 درصد از مزمنترین بیماریهای ما را تشکیل میدهند.
علیرغم تعداد زیادی تحقیق و تحولات سریع در طی دهه گذشته، سرطان همچنان یک قاتل جهانی است. طبق آمار اخیر، سرطان در حدود 23٪ از کل مرگ و میر در ایالات متحده آمریکا است و دومین علت مرگ و میر ناشی از بیماری قلبی (6) است. با این حال، مرگ و میر ناشی از بیماری قلبی در ایالات متحده آمریکا از 1975 تا 2002 به شدت کاهش یافته است. در مقابل، در ایالات متحده (6) تفاوت های قابل توجهی در میزان مرگ و میر در سرطان وجود ندارد.
پیش بینی می شود تا سال 2020، جمعیت جهان به 7.5 میلیارد نفر افزایش یابد. از این تعداد، تقریباً 15 میلیون مورد جدید سرطان تشخیص داده می شود و 12 میلیون بیمار سرطانی خواهند مرد (7). این روندهای بروز سرطان و نرخ مرگ و میر دوباره ما را به یاد قضاوت دکتر جان بیلر در ماه مه 1985 در مورد برنامه ملی سرطان ایالات متحده به عنوان «شکست واجد شرایط» می اندازد، قضاوتی که 14 سال پس از اعلام رسمی «جنگ» رئیس جمهور نیکسون انجام شد. در مورد سرطان. حتی پس از یک ربع قرن بیشتر از تحقیقات گسترده، محققان همچنان در تلاشند تا تعیین کنند که آیا سرطان قابل پیشگیری است یا خیر و می پرسند: "اگر قابل پیشگیری است، چرا جنگ با سرطان را باختیم؟" در این بررسی، ما تلاش می کنیم تا با تجزیه و تحلیل عوامل خطر بالقوه سرطان به این سوال پاسخ دهید و گزینه های ما برای تعدیل این عوامل خطر را بررسی کنید.
سرطان ناشی از عوامل داخلی (مانند جهش های ارثی، هورمون ها و شرایط ایمنی) و عوامل محیطی / به دست آمده (مانند توتون، رژیم غذایی، اشعه و موجودات عفونی)، شکل 1 است. پیوند بین رژیم غذایی و سرطان با تنوع زیاد در نرخ سرطان های خاص در کشورهای مختلف و با تغییرات مشاهده شده در بروز سرطان در مهاجرت آشکار می شود. برای مثال، نشان داده شده است که آسیاییها ۲۵ برابر کمتر از ساکنان کشورهای غربی به سرطان پروستات و ده برابر کمتر سرطان سینه مبتلا میشوند، و نرخ این سرطانها پس از مهاجرت آسیاییها به غرب بهطور قابلتوجهی افزایش مییابد.www.dietandcancerreportorg/?p=ER).
اهمیت عوامل سبک زندگی در ایجاد سرطان نیز در مطالعات دوقلوهای تک تخمکی نشان داده شد (8). تنها 5 تا 10 درصد از همه سرطان ها به دلیل نقص ژنی ارثی است. سرطان های مختلفی که با نقایص ژنتیکی مرتبط شده اند در شکل 2 نشان داده شده اند. اگرچه همه سرطان ها نتیجه جهش های متعدد هستند (9، 10)، اما این جهش ها به دلیل تعامل با محیط هستند (11، 12).
این مشاهدات نشان می دهد که اکثر سرطان ها منشا ارثی نیستند و عوامل شیوه زندگی، مانند عادات غذایی، سیگار کشیدن، مصرف الکل و عفونت ها، تأثیر زیادی بر روی رشد آنها دارند (13). اگرچه عوامل ارثی قابل تغییر نیست، سبک زندگی و عوامل محیطی به طور بالقوه قابل تغییر است. تأثیر ارثی کمتری از سرطان و ماهیت قابل تغییر عوامل محیطی، به پیشگیری از سرطان اشاره دارد. عوامل مهم زندگی سبک زندگی که بر شیوع و مرگ و میر سرطان تاثیر می گذارند عبارتند از تنباکو، الکل، رژیم غذایی، چاقی، عوامل عفونی، آلاینده های محیطی و اشعه.
عوامل خطر سرطان: توتون و تنباکو
سیگار کشیدن در سال 1964 به عنوان عامل اصلی سرطان ریه در گزارش کمیسیون مشورتی جراحان عمومی ایالات متحده شناسایی شد.profiles.nlm.nih.gov/NN/Views/Alpha Chron/date/10006/05/01/2008)، و از آن زمان تاکنون، تلاش ها برای کاهش مصرف دخانیات ادامه دارد. مصرف تنباکو خطر ابتلا به حداقل 14 نوع سرطان را افزایش می دهد (شکل 3). علاوه بر این، حدود 25 تا 30 درصد از کل مرگهای ناشی از سرطان و 87 درصد از مرگهای ناشی از سرطان ریه را شامل میشود. در مقایسه با افراد غیرسیگاری، مردان سیگاری 23 برابر و زنان سیگاری 17 برابر بیشتر در معرض ابتلا به سرطان ریه هستند. (WWW. سرطان.org/docroot/STT/content/STT_1x_Cancer_Facts_and_ Figures_2008.asp در تاریخ 05/01/2008 مشاهده شد)
اثرات سرطان زا سیگار فعال به خوبی مستند شده است. به عنوان مثال، آژانس حفاظت از محیط زیست ایالات متحده، در سال 1993 دود تنباکوی محیطی (ناشی از سیگار کشیدن غیرفعال) را به عنوان سرطانزای ریه انسان (گروه A) طبقهبندی کرد.cfpub2.epa.gov/ncea/cfm/recordisplay.cfm?deid=2835 مشاهده شده در 05/01/2008). تنباکو حاوی حداقل 50 ماده سرطان زا است. به عنوان مثال، یکی از متابولیت های تنباکو، بنزوپیرندیول اپوکسید، ارتباط مستقیمی با سرطان ریه دارد (14). در میان همه کشورهای توسعه یافته که در مجموع در نظر گرفته شده است، شیوع سیگار به آرامی در حال کاهش است. با این حال، در کشورهای در حال توسعه که 85 درصد از جمعیت جهان در آن ساکن هستند، شیوع سیگار در حال افزایش است. بر اساس مطالعات روند اخیر مصرف دخانیات، کشورهای در حال توسعه تا سال 71 2010 درصد از دخانیات جهان را مصرف خواهند کرد و 80 درصد افزایش مصرف برای شرق آسیا پیش بینی شده است.www.fao.org/DOCREP/006/Y4956E/Y4956E00. HTM در 01/11/08 قابل دسترسی است). استفاده از برنامههای کنترل سریع دخانیات، با تاکید بر مناطقی که استفاده در آنها در حال افزایش است، تنها راه کاهش میزان مرگ و میر ناشی از سرطان ناشی از دخانیات خواهد بود.
اینکه سیگار چگونه به سرطان کمک می کند به طور کامل درک نشده است. ما می دانیم که سیگار کشیدن می تواند تعداد زیادی از مسیرهای پیام رسانی سلولی را تغییر دهد. نتایج مطالعات در گروه ما ارتباط بین دود سیگار و التهاب را نشان داده است. به طور خاص، ما نشان دادیم که دود تنباکو می تواند باعث فعال شدن NF-?B، یک نشانگر التهابی شود (15,16،XNUMX). بنابراین، عوامل ضد التهابی که می توانند فعال سازی NF-?B را سرکوب کنند، ممکن است کاربردهای بالقوه ای در برابر دود سیگار داشته باشند.
ما همچنین نشان دادیم که کورکومین، مشتق شده از ادویه غذایی زردچوبه، می تواند NF-?B ناشی از دود سیگار را مسدود کند (15). علاوه بر کورکومین، ما کشف کردیم که چندین ماده شیمیایی گیاهی طبیعی نیز NF-?B ناشی از سرطانزاهای مختلف را مهار میکنند (17). بنابراین به نظر می رسد که اثرات سرطان زایی تنباکو توسط این عوامل رژیمی کاهش می یابد. بحث مفصلتر در مورد عوامل رژیمی که میتوانند التهاب را مسدود کرده و در نتیجه اثرات شیمیپیشگیرانه را ارائه دهند، در بخش زیر ارائه شده است.
الکل
اولین گزارش ارتباط بین الکل و افزایش خطر سرطان مری در سال 1910 منتشر شد (18). از آن زمان، تعدادی از مطالعات نشان داده اند که مصرف مزمن الکل یک عامل خطر برای سرطان های دستگاه گوارش فوقانی، از جمله سرطان های حفره دهان، حلق، هیپوفارنکس، حنجره و مری (18 تا 21) و همچنین سرطان های دستگاه گوارش فوقانی است. سرطان های کبد، پانکراس، دهان و سینه (شکل 3). به عنوان مثال، ویلیامز و هورن (22)، افزایش خطر ابتلا به سرطان سینه را به دلیل الکل گزارش کردند. علاوه بر این، یک گروه مشترک که عوامل هورمونی سرطان سینه را مطالعه کردند، یافتههای خود را از تجزیه و تحلیل مجدد بیش از 80 درصد از مطالعات اپیدمیولوژیک فردی که در سراسر جهان در مورد ارتباط بین الکل و خطر ابتلا به سرطان سینه در زنان انجام شده بود، منتشر کردند. تجزیه و تحلیل آنها نشان داد که خطر نسبی سرطان سینه به ازای هر 7.1 گرم مصرف الکل در روز 10 درصد افزایش می یابد (23). در مطالعه دیگری، Longnecker و همکاران (24) نشان دادند که 4 درصد از تمام موارد تازه تشخیص داده شده سرطان سینه در ایالات متحده به دلیل مصرف الکل است. مصرف زیاد الکل (بیش از 50/70 گرم در روز) علاوه بر اینکه یک عامل خطر برای سرطان سینه است، یک عامل خطر ثابت برای سرطان های کبد (25) و کولورکتال (26,27،XNUMX) است.
همچنین شواهدی از اثر سینرژیک بین مصرف الکل سنگین و ویروس هپاتیت C یا ویروس هپاتیت B (HBV) وجود دارد که احتمالا باعث افزایش خطر ابتلا به سرطان سلول های حاد خون (HCC) می شود. به عنوان مثال، Donato و همکاران. (28) گزارش شده است که در میان مصرف کنندگان الکل، خطر HCC به طور خطی با مصرف روزانه بیش از 60 g افزایش می یابد. با این وجود، با وجود حضور همزمان عفونت HCV، خطر ابتلا به HCC دو برابر بیشتر از مواردی است که تنها با مصرف الکل دیده می شود (به عنوان مثال اثر سینژستیک مثبت). رابطه بین الکل و التهاب نیز به خوبی مشخص شده است، به ویژه از نظر التهاب التهاب کبد.
اینکه الکل چگونه به سرطان زایی کمک می کند به طور کامل شناخته نشده است، اما اتانول ممکن است نقشی داشته باشد. یافته های مطالعه نشان می دهد که اتانول یک سرطان زا نیست بلکه یک کوسرسینوژن است (29). به طور خاص، هنگامی که اتانول متابولیزه می شود، استالدئید و رادیکال های آزاد تولید می شوند. اعتقاد بر این است که رادیکالهای آزاد عمدتاً مسئول سرطانزایی مرتبط با الکل از طریق اتصال به DNA و پروتئین هستند، که فولات را از بین میبرد و منجر به تکثیر ثانویه میشود. مکانیسمهای دیگری که الکل توسط آنها سرطانزایی را تحریک میکند عبارتند از القای سیتوکروم P-4502E1، که با افزایش تولید رادیکالهای آزاد و افزایش فعالسازی پروسرسینوژنهای مختلف موجود در نوشیدنیهای الکلی مرتبط است. تغییر در متابولیسم و توزیع مواد سرطان زا در ارتباط با دود تنباکو و رژیم غذایی. تغییرات در رفتار چرخه سلولی مانند مدت زمان چرخه سلولی که منجر به تکثیر بیش از حد می شود. کمبودهای تغذیه ای، به عنوان مثال، متیل، ویتامین E، فولات، پیریدوکسال فسفات، روی و سلنیوم. و تغییرات سیستم ایمنی آسیب بافتی، مانند آسیب ناشی از سیروز کبدی، پیش نیاز اصلی HCC است. علاوه بر این، الکل می تواند مسیر پیش التهابی NF-?B را فعال کند (30)، که همچنین می تواند به تومورزایی کمک کند (31). علاوه بر این، نشان داده شده است که بنزوپیرن، یک ماده سرطانزای دود سیگار، وقتی با اتانول ترکیب شود، میتواند به مری نفوذ کند (32). بنابراین عوامل ضد التهابی ممکن است برای درمان مسمومیت ناشی از الکل موثر باشند.
در دستگاه گوارش فوقانی، 25 تا 68 درصد از سرطان ها به الکل نسبت داده می شود و تا 80 درصد از این تومورها با پرهیز از الکل و سیگار قابل پیشگیری هستند (33). در سطح جهانی، بخش قابل انتساب مرگ و میر ناشی از سرطان ناشی از نوشیدن الکل 3.5٪ گزارش شده است (34). تعداد مرگ و میر ناشی از سرطان های شناخته شده مرتبط با مصرف الکل در ایالات متحده می تواند به 6٪ (مانند یوتا) یا 28٪ (مانند پورتوریکو) کم باشد. این اعداد از کشوری به کشور دیگر متفاوت است و در فرانسه در مردان به 20 درصد رسیده است (18).
رژیم غذایی
در سال 1981، دال و پتو (21) تخمین زدند که تقریباً 30 تا 35 درصد از مرگ و میرهای ناشی از سرطان در ایالات متحده با رژیم غذایی مرتبط است (شکل 4). میزان تأثیر رژیم غذایی در مرگ و میر ناشی از سرطان، بسته به نوع سرطان بسیار متفاوت است (35). به عنوان مثال، رژیم غذایی با مرگ و میر ناشی از سرطان در 70 درصد موارد سرطان روده بزرگ مرتبط است. اینکه چگونه رژیم غذایی به سرطان کمک می کند به طور کامل درک نشده است. بیشتر مواد سرطان زا که بلعیده می شوند، مانند نیترات ها، نیتروزامین ها، آفت کش ها و دیوکسین ها از مواد غذایی یا افزودنی های غذایی یا از پخت و پز حاصل می شوند.
مصرف زیاد گوشت قرمز یک عامل خطر برای چندین سرطان به خصوص برای سرطانهای دستگاه گوارش است، همچنین برای سرطانهای روده بزرگ (36 تا 38)، پروستات (39)، مثانه (40)، سینه (41)، معده (42) سرطان پانکراس و دهان (43). اگرچه مطالعه ای توسط Dosil-Diaz و همکاران (44) نشان داد که مصرف گوشت خطر ابتلا به سرطان ریه را کاهش می دهد، اما به دلایل زیر معمولاً چنین مصرفی به عنوان خطر ابتلا به سرطان در نظر گرفته می شود. آمین های هتروسیکلیک تولید شده در حین پختن گوشت، سرطان زا هستند. پختن گوشت با ذغال و/یا دود کردن، ترکیبات کربنی مضری مانند پیرولیزات و اسیدهای آمینه تولید می کند که اثر سرطانی قوی دارند. به عنوان مثال، PhIP (2-آمینو-1- متیل-6-فنیل-ایمیدازو[4,5-b] پیریدین) فراوان ترین جهش زا به لحاظ جرمی در گوشت گاو پخته شده است و مسئول 20٪ از کل جهش زایی موجود در گوشت گاو است. گوشت گاو سرخ شده مصرف روزانه PhIP در میان آمریکایی ها 280 نانوگرم 460 نانوگرم در روز برای هر نفر تخمین زده می شود (45).
نیتریت ها و نیترات ها در گوشت استفاده می شوند، زیرا آنها به میوگلوبین متصل می شوند و مانع تولید اگزوتوکسین بوتولینوم می شوند؛ با این حال، آنها سرطان زا هستند (46). در معرض قرار گرفتن در معرض مواد غذایی حاوی مواد نگهدارنده نیتریت و رنگ های آزوئی در طولانی مدت با القاء سرطان زایی (47) همراه است. علاوه بر این، بسفنول از ظروف غذای پلاستیکی می تواند به غذا مهاجرت کند و خطر ابتلا به سرطان سینه (48) و پروستات (49) را افزایش دهد. مصرف آرسنیک خطر ابتلا به سرطان مثانه، کلیه، کبد و ریه را افزایش می دهد (50). اسیدهای چرب اشباع شده، اسیدهای چرب ترانس و قندهای تصفیه شده و آرد موجود در اکثر غذاها نیز با سرطان های مختلف همراه بوده اند. نشان داده شده است که چندین ماده سرطان زا فعال هستند تا مسیرهای التهابی را فعال کنند.
پیشگیری و درمان چاقی
بر اساس تحقیقات انجمن سرطان آمریکا (51)، چاقی با افزایش مرگ و میر ناشی از سرطان های روده بزرگ، پستان (در زنان یائسه)، اندومتریوم، کلیه ها (سلول های کلیوی)، مری (آدنوکارسینوما)، کیست های معده، پانکراس، پروستات ، کیسه صفرا، و کبد (شکل 5). یافته های این مطالعه نشان می دهد که تمام مرگ و میر ناشی از سرطان در ایالات متحده، 14٪ در مردان و 20٪ در زنان مربوط به اضافه وزن یا چاقی است. افزایش مدرنیزه شدن و رژیم غذایی و سبک زندگی غربی، با افزایش شیوع افراد دارای اضافه وزن در بسیاری از کشورهای در حال توسعه (52) همراه است.
مطالعات نشان داده اند که علامت دهنده های مشترک بین چاقی و سرطان شامل عصب های شیمیایی هستند؛ هورمون هایی مانند انسولین مانند عامل رشد 1 (IGF-1)، انسولین، لپتین؛ استروئیدهای جنسی؛ چاقی مقاومت به انسولین؛ و التهاب (53).
درگیر شدن مسیرهای سیگنالینگ مانند مسیر سیگنالینگ IGF/انسولین/Akt، مسیر لپتین/JAK/STAT و سایر آبشارهای التهابی نیز با چاقی و سرطان مرتبط است (53). به عنوان مثال، نشان داده شده است که هایپرگلیسمی NF-?B را فعال می کند (54)، که می تواند چاقی را با سرطان مرتبط کند. همچنین برای فعال کردن NF-?B، چندین سایتوکین تولید شده توسط سلول های چربی، مانند لپتین، فاکتور نکروز تومور (TNF) و اینترلوکین-1 (IL-1) شناخته شده اند (55). تعادل انرژی و سرطان زایی ارتباط نزدیکی با هم دارند (53). با این حال، اینکه آیا مهارکننده های این آبشارهای سیگنالینگ می توانند خطر سرطان مرتبط با چاقی را کاهش دهند، بی پاسخ باقی مانده است. به دلیل دخالت مسیرهای سیگنال دهی متعدد، احتمالاً به یک عامل بالقوه چند هدف برای کاهش خطر سرطان مرتبط با چاقی نیاز است.
عوامل عفونی
در سراسر جهان، حدود 17.8 درصد از نئوپلاسم ها با عفونت مرتبط هستند. این درصد از کمتر از 10 درصد در کشورهای با درآمد بالا تا 25 درصد در کشورهای آفریقایی متغیر است (56، 57). ویروس ها بیشتر سرطان های ناشی از عفونت را تشکیل می دهند (شکل 6). ویروس پاپیلومای انسانی، ویروس اپشتین بار، ویروس هرپس مرتبط با سارکوم کاپوزی، ویروس T-لنفوتروپیک انسانی 1، HIV، HBV، و HCV با خطراتی برای سرطان دهانه رحم، سرطان آنوژنیتال، سرطان پوست، سرطان نازوفارنکس، بورکیت مرتبط هستند. لنفوم s، لنفوم هوچکین، سارکوم کاپوزی، لوسمی سلول T بزرگسالان، لنفوم سلول B و سرطان کبد.
در کشورهای توسعه یافته غربی، ویروس پاپیلومای انسانی و HBV شایع ترین ویروس های DNA انکوژنیک هستند. ویروس پاپیلومای انسانی به طور مستقیم با القای ژن های ویروسی E6 و E7 جهش زا است (58)، در حالی که اعتقاد بر این است که HBV به طور غیرمستقیم با تولید گونه های اکسیژن فعال از طریق التهاب مزمن جهش زا است (59-61). ویروس T-لنفوتروپیک انسانی به طور مستقیم جهش زا است، در حالی که اعتقاد بر این است که HCV (مانند HBV) استرس اکسیداتیو در سلول های آلوده ایجاد می کند و بنابراین به طور غیر مستقیم از طریق التهاب مزمن عمل می کند (62، 63). با این حال، سایر میکروارگانیسمها، از جمله انگلهای منتخب مانند Opisthorchis viverrini یا Schistosoma haematobium و باکتریهایی مانند هلیکوباکتر پیلوری نیز ممکن است درگیر باشند که به عنوان کوفاکتور و/یا سرطانزا عمل میکنند (64).
مکانیسم هایی که از طریق آن عوامل عفونی باعث ترویج سرطان می شوند به طور فزاینده ای آشکار می شوند. التهاب مرتبط با عفونت عامل خطر اصلی سرطان است و تقریباً تمام ویروسهای مرتبط با سرطان نشانگر التهابی NF-?B را فعال میکنند (65). به طور مشابه، اجزای هلیکوباکتر پیلوری نشان داده شده است که NF-?B را فعال می کند (66). بنابراین، عواملی که می توانند التهاب مزمن را مسدود کنند باید در درمان این شرایط موثر باشند.
آلودگی محیطی
آلودگی محیط زیست به سرطان های مختلف مرتبط است (شکل 7). این شامل آلودگی هوا در فضای باز توسط ذرات کربنی همراه با هیدروکربن های آروماتیک چند حلقه ای (PAH ها) می باشد. آلودگی هوا در محیط داخلی با استفاده از دود سیگار محیطی، فرمالدئید و ترکیبات آلی فرار مانند بنزن و 1,3-بوتادین (که ممکن است به ویژه در کودکان تاثیرگذار باشد)؛ آلودگی غذا به وسیله افزودنی های مواد غذایی و آلاینده های سرطان زایی نظیر نیترات، آفت کش ها، دیوکسین ها و سایر مواد آلی فلزات سرطان زا و فلزوئید؛ داروهای دارویی؛ و لوازم آرایشی (64).
بسیاری از آلودگیهای هوا در فضای باز مانند PAH ها خطر ابتلا به سرطان، به ویژه سرطان ریه را افزایش می دهند. PAH ها می توانند ذرات کربن ریز در اتمسفر را حفظ کنند و بدین ترتیب بدن ما را از طریق تنفس نفوذ کنند. در معرض قرار گرفتن در معرض هوا در هوا در معرض هوا در شهرهای آلوده، خطر ابتلا به سرطان ریه افزایش می یابد. به غیر از PAHs و دیگر ذرات کربن خوب، یکی دیگر از آلاینده های محیط زیست، اکسید نیتریک، افزایش خطر ابتلا به سرطان ریه در یک جمعیت اروپایی غیر سیگاری است. مطالعات دیگر نشان داده اند که اکسید نیتریک میتواند سرطان ریه را تحریک کند و متاستاز را تقویت کند. افزایش خطر ابتلا به سرطان خون در ارتباط با اگزوز موتور خودرو نیز گزارش شده است (64).
آلایندههای هوای داخل خانه مانند ترکیبات آلی فرار و آفتکشها خطر ابتلا به سرطان خون و لنفوم دوران کودکی را افزایش میدهند و کودکان و همچنین بزرگسالانی که در معرض آفتکشها قرار دارند، خطر ابتلا به تومورهای مغزی، تومورهای ویلم، سارکوم یوینگ و تومورهای سلول زاینده را افزایش میدهند. قرار گرفتن درون رحمی با آلایندههای آلی محیطی خطر ابتلا به سرطان بیضه را افزایش میدهد. علاوه بر این، دیوکسان، یک آلاینده محیطی از زباله سوزها، خطر ابتلا به سارکوم و لنفوم را افزایش می دهد.
قرار گرفتن در معرض آب آشامیدنی کلر شده در طولانی مدت با افزایش خطر ابتلا به سرطان همراه است. نیترات در آب آشامیدنی می تواند به ترکیبات N-nitroso موتاژنیک تبدیل شود که خطر ابتلا به لنفوم، لوسمی، سرطان کولورکتال و سرطان مثانه را افزایش می دهد (64).
تابش
تا 10٪ از کل موارد سرطان ممکن است توسط اشعه (64)، هر دو یونیزه و غیر یونیزه، به طور معمول از مواد رادیواکتیو و ماورای بنفش (UV)، میدان مغناطیسی الکترو مغناطیسی القا شده است. سرطانهای ناشی از اشعه شامل برخی از انواع لوسمی، لنفوم، سرطان تیروئید، سرطان پوست، سارکوم، سرطان ریه و پستان است. یکی از بهترین نمونه هایی از افزایش خطر ابتلا به سرطان پس از قرار گرفتن در معرض تابش، افزایش شیوع بدخیمی های کامل در سوئد پس از قرار گرفتن در معرض آلودگی رادیواکتیو از نیروگاه هسته ای چرنوبیل است. محصولات رادون و رادون فروپاشی در خانه و / یا در محل کار (مانند معادن) شایع ترین منابع قرار گرفتن در معرض تابش یونیزه هستند. وجود هسته های رادیواکتیو از رادون، رادیوم و اورانیوم افزایش خطر ابتلا به سرطان معده در موش صحرایی را نشان می دهد. منبع دیگر تابش اشعه، اشعه ایکس است که در تنظیمات پزشکی برای اهداف تشخیصی یا درمانی استفاده می شود. در حقیقت، خطر ابتلا به سرطان پستان از اشعه ایکس بیشتر از دختران است که در معرض تابش خورشید در بلوغ، زمان رشد شدید سینه هستند. سایر عوامل مرتبط با سرطان های ناشی از تابش در انسان عبارتند از: سن بیمار و وضعیت فیزیولوژیکی، تعاملات هم افزایی بین تابش و سرطانزا و حساسیت ژنتیکی نسبت به تابش.
تابش nonionizing که عمدتا از نور خورشید حاصل می شود شامل اشعه های UV است که به انسان سرطان زایی دارند. قرار گرفتن در معرض اشعه ماوراء بنفش یک خطر عمده برای انواع مختلف سرطان پوست از جمله کارسینوم سلول بازال، کارسینوم سلول سنگفرشی و ملانوم است. همراه با اشعه ماوراء بنفش از طریق نور خورشید، اشعه ماوراء بنفش از لامپ های روشن برای برنزه کردن لوازم آرایشی ممکن است باعث افزایش شیوع ملانوم شود. از بین بردن لایه اوزون در استراتوسفر می تواند شدت دوزهای UVB و UVC را افزایش دهد که می تواند بروز سرطان پوست را افزایش دهد.
میدان های الکترومغناطیسی با فرکانس پایین موجب آسیب DNA به محیط زیست می شود. منابع میدان های الکترومغناطیسی عبارتند از خطوط ولتاژ بالا، ترانسفورماتور، موتورهای قطار الکتریکی و به طور کلی هر نوع تجهیزات الکتریکی. افزایش خطر ابتلا به سرطان مانند لوسمی در دوران کودکی، تومورهای مغزی و سرطان سینه به علت قرار گرفتن در معرض میدان الکترومغناطیسی است. به عنوان مثال، کودکان زیر خط 200 از خطوط ولتاژ بالا دارای خطر نسبی لوسمی٪ 69 هستند، در حالی که افرادی که بین 200 و 600 m از این خطوط برق زندگی می کنند خطر نسبی 23٪ دارند. علاوه بر این، یک متاآنالیز اخیر از تمام داده های اپیدمیولوژیک موجود نشان داد که استفاده روزانه از تلفن های همراه برای سال های 10 یا بیشتر، الگوی مناسبی از افزایش خطر تومورهای مغزی (64) را نشان می دهد.
پیشگیری از سرطان
این واقعیت که تنها 5 درصد از کل موارد سرطان به دلیل نقص ژنتیکی و 10 درصد باقی مانده به دلیل محیط و سبک زندگی است، فرصت های عمده ای را برای پیشگیری از سرطان ایجاد می کند. زیرا تنباکو، رژیم غذایی، عفونت، چاقی و سایر عوامل به ترتیب تقریباً 90/95 درصد، 25/30 درصد، 30/35 درصد، 15/20 درصد و 10/20 درصد در بروز همه مرگهای ناشی از سرطان نقش دارند. ایالات متحده، روشن است که چگونه می توانیم از سرطان جلوگیری کنیم. تقریبا 10 درصد از بیمارانی که سرطان ریه تشخیص داده می شود سیگاری هستند. و سیگار کشیدن همراه با مصرف الکل می تواند به طور هم افزایی به تومورزایی کمک کند. به طور مشابه، تنباکوی بدون دود مسئول 15 مورد (90 درصد از کل سرطان ها) سرطان دهان در سراسر جهان است. بنابراین اجتناب از محصولات تنباکو و به حداقل رساندن مصرف الکل احتمالاً تأثیر عمده ای بر بروز سرطان خواهد داشت.
عفونت باکتری ها و ویروس های مختلف (شکل 6) یکی دیگر از علل بسیار برجسته سرطان های مختلف است. واکسن های سرطان دهانه رحم و HCC باید به جلوگیری از برخی از این سرطان ها کمک کند و محیط زیست پاک و رفتار اصلاح شده شیوه زندگی حتی در مورد پیشگیری از سرطان های عفونی مفید خواهد بود.
اولین داروی پیشگیری کننده شیمیایی مورد تایید FDA تاموکسیفن بود که خطر ابتلا به سرطان سینه را کاهش می داد. مشخص شد که این عامل بروز سرطان سینه را تا 50 درصد در زنان در معرض خطر کاهش می دهد. با تاموکسیفن، خطر عوارض جانبی جدی مانند سرطان رحم، لخته شدن خون، اختلالات چشمی، هیپرکلسمی و سکته مغزی افزایش مییابد.www.fda.gov/ cder/foi/appletter/1998/17970s40.pdf). اخیراً نشان داده شده است که داروی پوکی استخوان رالوکسیفن به اندازه تاموکسیفن در پیشگیری از سرطان سینه مهاجم مثبت گیرنده استروژن مؤثر است اما عوارض جانبی کمتری نسبت به تاموکسیفن دارد. اگرچه از نظر عوارض جانبی بهتر از تاموکسیفن است، اما می تواند باعث لخته شدن خون و سکته شود. سایر عوارض جانبی احتمالی رالوکسیفن شامل گرگرفتگی، گرفتگی عضلات پا، تورم پاها و پاها، علائم شبیه آنفولانزا، درد مفاصل و تعریق است.www.fda.gov/bbs/topics/NEWS/2007/NEW01698.html).
دومین عامل شیمی درمانی که به کلینیک رسید فیناستراید برای سرطان پروستات بود که مشخص شد در مردان در معرض خطر 25 درصد بروز را کاهش می دهد. عوارض جانبی شناخته شده این دارو شامل اختلال نعوظ، کاهش میل جنسی، ناتوانی جنسی و ژنیکوماستی است.WWW. سرطان.org/docroot/cri/content/cri_2_4_2x_can_prostate_can cer_be_prevented_36.asp). سلکوکسیب، یک مهارکننده COX-2، یکی دیگر از داروهای تایید شده برای پیشگیری از پولیپوز آدنوماتوز خانوادگی (FAP) است. با این حال، مزایای شیمیایی سلکوکسیب به قیمت آسیب جدی قلبی عروقی آن است.www.fda.gov/cder/drug/infopage/cox2/NSAIDdecision یادداشت.pdf).
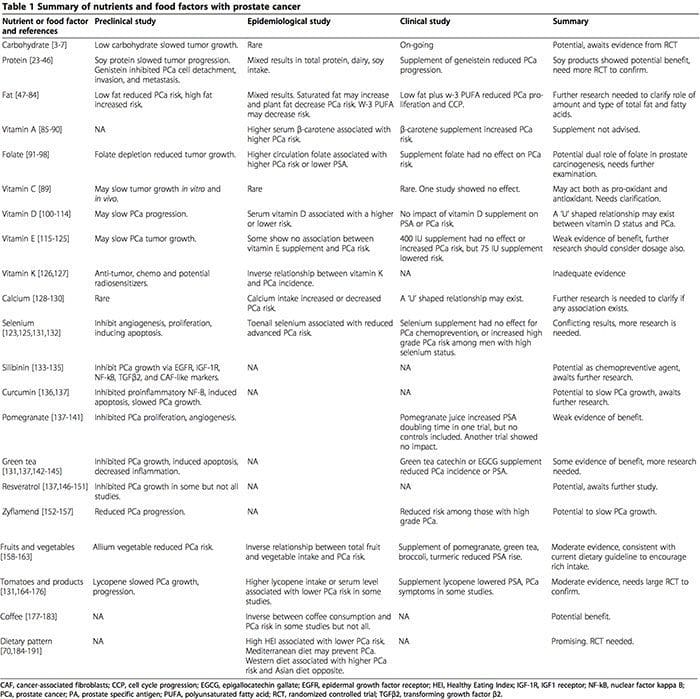
عوارض جانبی جدی داروهای پیشگیری کننده شیمی درمانی تایید شده توسط FDA، زمانی که مصرف طولانی مدت یک دارو برای افراد سالمی که ممکن است به سرطان مبتلا شوند یا نشوند، مورد توجه قرار گیرد. این به وضوح نیاز به عواملی را نشان می دهد که در پیشگیری از سرطان ایمن و مؤثر هستند. محصولات طبیعی مشتق از رژیم غذایی کاندیدای بالقوه برای این منظور خواهند بود. رژیم غذایی، چاقی و سندرم متابولیک بسیار با سرطان های مختلف مرتبط هستند و ممکن است 30 تا 35 درصد از مرگ و میر ناشی از سرطان را تشکیل دهند، که نشان می دهد با اصلاح رژیم غذایی می توان از بخش قابل قبولی از مرگ و میر ناشی از سرطان جلوگیری کرد. تحقیقات گسترده نشان داده است که رژیم غذایی متشکل از میوهها، سبزیجات، ادویهها و غلات پتانسیل پیشگیری از سرطان را دارد (شکل 8). مواد خاص موجود در این غذاهای رژیمی که مسئول پیشگیری از سرطان هستند و مکانیسم هایی که توسط آنها به این امر دست می یابد نیز به طور گسترده مورد بررسی قرار گرفته است. فیتوکمیکالهای مختلفی در میوهها، سبزیجات، ادویهها و غلات شناسایی شدهاند که پتانسیل پیشگیری از شیمیایی را نشان میدهند (شکل 9)، و مطالعات متعدد نشان دادهاند که یک رژیم غذایی مناسب میتواند به محافظت در برابر سرطان کمک کند (46، 67-69). در زیر شرحی از عوامل رژیمی منتخب و فیتوکمیکال های مشتق شده از رژیم غذایی ارائه شده است که به طور گسترده برای تعیین نقش آنها در پیشگیری از سرطان مورد مطالعه قرار گرفته است.
میوه و سبزیجات
نقش محافظتی میوهها و سبزیجات در برابر سرطانهایی که در مکانهای آناتومیکی مختلف رخ میدهند، اکنون به خوبی پشتیبانی میشود (46,69،1966). در سال 70، واتنبرگ (21) برای اولین بار پیشنهاد کرد که مصرف منظم برخی از ترکیبات موجود در میوه ها و سبزیجات ممکن است از سرطان محافظت کند. دال و پتو (75) نشان دادند که 80 تا 1981 درصد از موارد سرطان تشخیص داده شده در ایالات متحده در سال 1997 ممکن است با تغییر سبک زندگی پیشگیری شود. بر اساس برآوردی که در سال 30 انجام شد، تقریباً 40 تا XNUMX درصد موارد سرطان در سراسر جهان با روش های غذایی قابل پیشگیری قابل پیشگیری بودند.www.dietandcancerreportorg/?p=ER). مطالعات متعددی به اثرات شیمیایی پیشگیری کننده سرطان از اجزای فعال مشتق شده از میوه ها و سبزیجات پرداخته اند.
بیش از 25,000 مختلف phytochemicals شناخته شده است که ممکن است بالقوه در برابر انواع مختلف سرطان. این فیتوکمیکال ها دارای مزایایی هستند زیرا آنها ایمن هستند و معمولا مسیرهای چندگانه سیگنالینگ (71) را هدف قرار می دهند. عمده ترکیبات شیمیایی شناسایی شده از میوه ها و سبزیجات شامل کاروتنوئیدها، ویتامین ها، رزوراترول، کورستین، سیلیمارین، سولفورافان و اندول-3-کاربنول می باشد.
کاروتنوئیدها
گزارش شده است که کاروتنوئید های طبیعی موجود در میوه ها و سبزیجات فعالیت ضد التهابی و ضد انسانی دارند. لیکوپن یکی از کاروتنوئیدهای اصلی در رژیم غذایی مدیترانه ای مدیترانه ای است و می تواند 50٪ از کاروتنوئید ها در سرم انسان را تشکیل دهد. لیکوپن در میوه ها شامل هندوانه، زردآلو، صورتی گواوا، گریپ فروت، گل رز و گوجه فرنگی است. طیف گسترده ای از محصولات مبتنی بر گوجه فرنگی پردازش، بیش از 85٪ از لیکوپن رژیم غذایی را تشکیل می دهند. فعالیت ضد سرطانی لیکوپن در هر دو مدل in vitro و in vivo تومور و همچنین در انسان نشان داده شده است. مکانیسم های پیشنهادی برای اثرات ضد سرطانی لیکوپن عبارتند از ریزنشت ROS، تنظیم مقابله با سیستم های سم زدایی، تداخل با تکثیر سلولی، القاء ارتباطات شکاف-موقعیتی، مهار پیشرفت چرخه سلولی و مدولاسیون مسیرهای انتقال سیگنال. دیگر کاروتنوئید ها گزارش می دهند که فعالیت ضد سرطانی شامل بتا کاروتن، آلفا کاروتن، لووتیئن، زاکسنتین، بتا کریپتوکسانتین، فوکوکسانین، آساتکسانتین، کپتانتین، سکتین و فیتوئن (72) است.
رسوراترول موجود
استیلبن رسوراترول در میوه هایی مانند انگور، بادام زمینی و انواع توت ها یافت شده است. رسوراترول در برابر طیف وسیعی از تومورها، از جمله سرطان های لنفوئیدی و میلوئیدی، مولتیپل میلوما، و سرطان های سینه، پروستات، معده، روده بزرگ و پانکراس، خواص ضد سرطانی را نشان می دهد. اثرات بازدارنده رشد رسوراترول از طریق توقف چرخه سلولی انجام می شود. القای آپوپتوز از طریق Fas/CD95، p53، فعال سازی سرامید، پلیمریزاسیون توبولین، مسیرهای میتوکندری و آدنیلیل سیکلاز. افزایش تنظیم p21 p53 و Bax. تنظیم پایین Survivin، cyclin D1، cyclin E، Bcl-2، Bcl-xL، و بازدارنده سلولی پروتئین های آپوپتوز. فعال سازی کاسپازها؛ سرکوب نیتریک اکسید سنتاز؛ سرکوب فاکتورهای رونویسی مانند NF-?B، AP-1، و پاسخ رشد اولیه-1. مهار cyclooxyge-nase-2 (COX-2) و لیپوکسیژناز. سرکوب مولکول های چسبندگی؛ و مهار رگ زایی، تهاجم و متاستاز. داده های محدود در انسان نشان داده است که رسوراترول از نظر دارویی بی خطر است. رسوراترول به عنوان یک داروی غذایی در ایالات متحده و اروپا به صورت تجاری در دوزهای 50 میکروگرم تا 60 میلی گرم موجود است. در حال حاضر، آنالوگ های ساختاری رسوراترول با فراهمی زیستی بهبود یافته به عنوان عوامل بالقوه شیمی درمانی و پیشگیری کننده برای سرطان در حال پیگیری هستند (73).
کورستین
فلاون کوئرستین (3,3،4?،5,7?،25،30-پنتاهیدروکسی فلاون)، یکی از فلاونوئیدهای رژیمی اصلی، در طیف وسیعی از میوهها، سبزیجات، و نوشیدنیهایی مانند چای و شراب یافت میشود. کشورهای غربی 1×74 میلی گرم. اثرات آنتی اکسیدانی، ضد التهابی، ضد تکثیری و آپوپتوز مولکول تا حد زیادی در مدل های کشت سلولی مورد تجزیه و تحلیل قرار گرفته است و شناخته شده است که فعال سازی NF-?B را مسدود می کند. در مدل های حیوانی، کورستین نشان داده است که التهاب را مهار می کند و از سرطان روده بزرگ و ریه جلوگیری می کند. یک کارآزمایی بالینی فاز XNUMX نشان داد که مولکول را می توان به طور ایمن تجویز کرد و سطح پلاسمایی آن برای مهار فعالیت تیروزین کیناز لنفوسیت کافی است. مصرف کورستین در پیاز و سیب با خطر ابتلا به سرطان ریه در هاوایی ارتباط معکوس دارد. اثر پیاز به ویژه در برابر کارسینوم سلول سنگفرشی قوی بود. در مطالعه دیگری، افزایش سطح کورستین پلاسما پس از خوردن پیاز با افزایش مقاومت در برابر شکستن رشته در DNA لنفوسیتی و کاهش سطوح برخی از متابولیت های اکسیداتیو در ادرار همراه بود (XNUMX).
سیلیمارین
فلاونوئید سیلیمارین (سیلیبین، ایزوسیلیبین، سیلی کریستین، سیلیدیانین و تاکسیفولین) معمولاً در میوه خشک گیاه خار مریم Silybum marianum یافت می شود. اگرچه نقش سیلیمارین به عنوان یک عامل آنتی اکسیدانی و محافظ کبد به خوبی شناخته شده است، نقش آن به عنوان یک عامل ضد سرطان به تازگی در حال ظهور است. اثرات ضد التهابی سیلیمارین از طریق سرکوب محصولات ژنی تنظیم شده با NF-?B، از جمله COX-2، لیپوکسیژناز (LOX)، NO سنتاز القایی، TNF و IL-1 انجام می شود. مطالعات متعدد نشان داده اند که سیلیمارین یک عامل شیمیایی پیشگیری کننده در داخل بدن در برابر عوامل سرطان زا/موتورهای سرطان زا مختلف از جمله اشعه ماوراء بنفش، 7,12،12-dime-thylbenz(a)anthracene (DMBA)، فوربول 13-میریستات 75-استات، و غیره است. همچنین نشان داده شده است که سیلیمارین تومورها را از طریق تنظیم پایین پروتئین MDR و مکانیسم های دیگر نسبت به عوامل شیمی درمانی حساس می کند. به هر دو گیرنده استروژن و آندروژن متصل می شود و آنتی ژن اختصاصی پروستات را کاهش می دهد. سیلیمارین علاوه بر اثرات شیمیایی-پیشگیرانه، فعالیتی در برابر تومورها (مثلاً پروستات و تخمدان) در جوندگان نشان می دهد. آزمایشات بالینی مختلف نشان داده اند که سیلیمارین در دسترس زیستی و از نظر دارویی بی خطر است. اکنون مطالعاتی برای نشان دادن اثربخشی بالینی سیلیمارین در برابر سرطان های مختلف در حال انجام است (XNUMX).
Indole-3-Carbinol
فلاونوئید ایندول-3-کاربینول (I3C) در سبزیجاتی مانند کلم، کلم بروکلی، کلم بروکسل، گل کلم و کنگر دایکون وجود دارد. محصول هیدرولیز I3C به محصولات مختلفی متابولیزه می شود، از جمله دایمر 3,3،3β-دی ایندولیل متان. هر دو I3,3C و 3،3?-دی ایندولیل متان انواع مختلفی از اثرات بیولوژیکی و بیوشیمیایی را اعمال می کنند، که به نظر می رسد بیشتر آنها به این دلیل رخ می دهند که I1C چندین فاکتور رونویسی هسته ای را تعدیل می کند. I2C آنزیم های فاز 3 و 76 را القا می کند که مواد سرطان زا از جمله استروژن ها را متابولیزه می کنند. همچنین مشخص شده است که IXNUMXC در درمان برخی موارد پاپیلوماتوز تنفسی مکرر مؤثر است و ممکن است کاربردهای بالینی دیگری نیز داشته باشد (XNUMX).
سولفورفان
سولفورافان (SFN) یک ایزوتیوتیوسیانات است که در سبزیجات چلیپایی مانند بروکلی یافت می شود. اثرات شیمیای پیشگیری کننده آن در هر دو مطالعه in vitro و in vivo ثابت شده است. مکانیسم های اثر SFN شامل مهار آنزیم های فاز 1، القای آنزیم های فاز 2 برای سم زدایی مواد سرطان زا، توقف چرخه سلولی، القای آپوپتوز، مهار هیستون داستیلاز، مدولاسیون مسیر MAPK، مهار NF-?B است. و تولید ROS. مطالعات پیش بالینی و بالینی این ترکیب اثرات شیمیایی پیشگیرانه آن را در چندین مرحله سرطان زایی پیشنهاد کرده است. در یک کارآزمایی بالینی، SFN به هشت زن سالم یک ساعت قبل از انجام ماموپلاستی کاهشی انتخابی داده شد. القای NAD(P)H/quinone oxidoreductase و heme oxygenase-1 در بافت پستان همه بیماران مشاهده شد که نشان دهنده اثر ضد سرطانی SFN است (77).
چای و ادویه
ادویه جات ترشی جات در سراسر جهان برای افزودن طعم، طعم و ارزش غذایی برای غذا استفاده می شود. تحقیقات فزاینده ای نشان داده است که داروی گیاهی مانند کایتچین ها (چای سبز)، کورکومین (زردچوبه)، دی آلدیل سولفید (سیر)، تیمو کینون (سس سفید)، کپسایسین (قرمز چیلی)، گینگرول (زنجبیل)، آنتول (شیرین بیان)، دیوسژنین fenugreek) و eugenol (گل میخ، دارچین) دارای پتانسیل های درمانی و پیشگیرانه در برابر سرطان های مختلف آناتومیک هستند. دیگر فیتو شیمیایی با این پتانسیل شامل اسید ellagic (گل میخک)، اسید فورولیک (رازیانه، خردل، کنجد)، apigenin (گشنیز، جعفری)، اسید بوتولینیک (رزماری)، کومپفرول (گل میخک، پیاز)، سزامین (کنجد)، piperine (فلفل )، ليمونن (گل رز ماري) و اسيد گامبژيک (کوکوم). در زیر شرح برخی از فیتوکمیکال های مهم مرتبط با سرطان است.
کاتچین
بیشتر مطالعات 3,000 نشان داده اند که کاتچین هایی که از چای سبز و سیاه گرفته شده اند، در معرض ابتلا به سرطان های مختلف هستند. مقدار محدودی از داده ها نیز در آزمایشات شیمیایی پلی فنول چای سبز موجود است. آزمایشات فاز 1 از داوطلبان سالم، الگوهای پایه بیولوژیکی توزیع، پارامترهای فارماکوکینتیک و پرونده های ایمنی اولیه را برای استفاده کوتاه مدت از خوراکی های مختلف چای سبز تعریف کرده است. مصرف چای سبز نسبتا امن است. مشتقات چای سبز در میان بیماران مبتلا به شرایط پیش از مواجهه، اثربخشی بالقوه در برابر سرطان دهانه رحم، پروستات و سرطان های کبدی را بدون ایجاد اثرات سمی مهمی نشان داده اند. یک مطالعه جدید نشان می دهد که حتی افراد با تومورهای جامد می توانند به راحتی به 1 گرم جامد چای سبز، معادل تقریبا 900 میلی لیتر چای سبز، سه بار در روز مصرف کنند. این مشاهدات از استفاده از چای سبز برای پیشگیری و درمان سرطان (78) حمایت می کند.
کورکومین
کورکومین یکی از گسترده ترین ترکیبات مورد مطالعه است که از منابع غذایی برای مهار التهاب و پیشگیری از سرطان سرطان جدا شده است، همانطور که تقریباً 3000 مطالعه منتشر شده نشان می دهد. مطالعات آزمایشگاهی ما نشان داد که کورکومین بیان ژن تنظیمشده NF-?B و NF-?B را در ردههای سلولی مختلف سرطانی مهار میکند. مطالعات in vitro و in vivo نشان داد که این فیتوشیمیایی التهاب و سرطانزایی را در مدلهای حیوانی از جمله مدلهای سرطان سینه، مری، معده و روده بزرگ مهار میکند. مطالعات دیگر نشان داد که کورکومین از پروکتیت اولسراتیو و بیماری کرون جلوگیری می کند و یکی نشان می دهد که کورکومین باعث مهار کولیت اولسراتیو در انسان می شود. مطالعه دیگری تأثیر ترکیب کورکومین و پیپرین را در بیماران مبتلا به پانکراتیت استوایی ارزیابی کرد. یک مطالعه انجام شده در بیماران مبتلا به پولیپ آدنوماتوز خانوادگی نشان داد که کورکومین نقش بالقوه ای در مهار این وضعیت دارد. در آن مطالعه، هر پنج بیمار بهمدت میانگین 6 ماه تحت درمان با کورکومین و کورستین قرار گرفتند و تعداد پولیپها (60.4 درصد) و اندازه (50.9 درصد) از ابتدا کاهش یافته بود و کمترین عوارض جانبی داشتند و هیچ ناهنجاری تعیینشده آزمایشگاهی نداشتند.
اثرات فارماکودینامیک و فارماکوکینتیک عصاره کورکوما خوراکی در بیماران مبتلا به سرطان کولورکتال نیز مورد بررسی قرار گرفته است. در مطالعه بیماران مبتلا به سرطان پیشرفته کولورکتال مقاوم در برابر شیمی درمانی استاندارد، بیماران 15 عصاره کورکوما را تا روزانه تا 4 ماه دریافت کردند. نتایج نشان داد که عصاره کورکومای خوراکی به خوبی تحمل می شود و اثرات سمی محدود کننده دوز مشاهده نشد. مطالعه دیگری نشان داد که در بیماران مبتلا به سرطان پیشرفته کولورکتال، دوز روزانه 3.6 g کورکومین موجب کاهش 62٪ در تولید پروستاگلاندین E2 القا شده در روز 1 و کاهش 57 در روز 29 در نمونه های خون 1 h بعد از تزریق دوز بود.
یک آزمایش بالینی اولیه با بیماران مبتلا به سرطان 62 با ضایعات سرطانی خارجی در مکان های مختلف (سینه، 37؛ ولو، 4، دهان، 7، پوست، 7 و دیگران، 11) کاهش بویایی (90٪ از بیماران) ، خارش (تقریبا همه بیماران)، اندازه ضایعه و درد (10٪ از بیماران) و اگزودا (70٪ از بیماران) پس از اعمال موضعی پماد حاوی کورکومین. در یک کارآزمایی بالینی 1، دوز روزانه 8,000 میلیگرم کورکومین که برای دهم ماه 3 به صورت داخل دهان گرفته شد، منجر به بهبود بافتی ضایعات پیش سرطانی در بیماران مبتلا به نئوپلاسم داخل صفاق رحم رحم (یکی از چهار بیمار)، متاپلازی روده (یکی از شش بیمار) ، سرطان مثانه (یکی از دو بیمار) و لکوپلاکیا دهانی (دو نفر از هفت بیمار).
نتایج مطالعه دیگری که توسط گروه ما انجام شد نشان داد که کورکومین از 2 بیمار مولتیپل میلوما که در این مطالعه ثبتنام کرده بودند، از فعالسازی سازنده NF-?B، COX-3 و STAT29 در سلولهای تک هستهای خون محیطی جلوگیری کرد. کورکومین در دوزهای 2، 4، 8 یا 12 گرم در روز خوراکی داده شد. درمان با کورکومین به خوبی بدون عوارض جانبی تحمل شد. از 29 بیمار، 12 نفر به مدت 12 هفته تحت درمان قرار گرفتند و 5 نفر یک سال درمان را با بیماری پایدار تکمیل کردند. مطالعات دیگر از گروه ما نشان داد که کورکومین سرطان پانکراس را مهار می کند. کورکومین بیان NF-?B، COX-1، و STAT2 فسفریله شده را در سلولهای تک هستهای خون محیطی از بیماران (که اکثر آنها سطح پایه به طور قابلتوجهی بالاتر از داوطلبان سالم داشتند) کاهش داد. این مطالعات نشان داد که کورکومین یک عامل ضد التهابی و پیشگیری کننده شیمیایی قوی است. شرح مفصل کورکومین و خواص ضد سرطانی آن را می توان در یکی از بررسی های اخیر ما یافت (3).
diallyldisulfide
دی آلیل دی سولفید، جدا شده از سیر، از رشد و تکثیر تعدادی از رده های سلولی سرطانی از جمله رده های سلولی کولون، پستان، گلیوبلاستوما، ملانوم و نوروبلاستوما جلوگیری می کند. مطالعات اخیر نشان داد که این ترکیب با مهار COX-320، NF-?B، و ERK-2 باعث القای آپوپتوز در سلول های سرطانی روده بزرگ انسان Colo 2 DM می شود. نشان داده شده است که این دارو تعدادی از سرطان ها از جمله سرطان روده بزرگ ناشی از دی متیل هیدرازین، نئوپلازی ناشی از بنزو[a]پیرن، و فعالیت گلوتاتیون S-ترانسفراز را در موش مهار می کند. سرطان زایی پوست ناشی از بنزو[a] پیرن در موش. سرطان مری ناشی از N-nitrosomethylbenzylamine در موش صحرایی. نئوپلازی پیشرومعد ناشی از N-nitrosodiethylamine در موش ماده A/J. سرطان معده ناشی از اسید آریستولوکیک در موش صحرایی. کانون های مثبت گلوتاتیون S-ترانسفراز ناشی از دی اتیل نیتروزامین در کبد موش صحرایی. 2-amino-3-methylimidazo[4,5،3-f]-quinoline ناشی از سرطان کبد در موش صحرایی. و کانون های کبدی و آدنوم های کبدی ناشی از دی اتیل نیتروزامین در موش های C1H. همچنین نشان داده شده است که دی آلیل دی سولفید جهش زایی یا تومورزایی ناشی از وینیل کاربامات و N-nitrosodimethylamine را مهار می کند. کانون های پرنئوپلاستیک کبد ناشی از آفلاتوکسین B2 و N-nitrosodiethylamine در موش صحرایی. فعالیت آریلامین N-استیل ترانسفراز و ترکیبات افزایشی XNUMX-آمینو فلورن-DNA در سلول های لوسمی پرومیلوسیتیک انسانی. تومورهای پوست موش ناشی از DMBA؛ جهش ناشی از N-nitrosomethylbenzylamine در مری موش صحرایی. و مواد افزودنی DNA ناشی از دی اتیل استیلبسترول در سینه موشهای ماده ACI.
اعتقاد بر این است که Diallyldisulfide با اثر تعدادی از مکانیسم ها مانند انقباض رادیکال ها اثر یک اثر ضد انسانی را ایجاد می کند؛ افزایش سطح گلویتون؛ افزایش فعالیت آنزیم هایی مانند گلوتاتیون S-ترانسفراز و کاتالاز؛ مهار سیتوکروم p4502E1 و مکانیسم های تعمیر DNA؛ و جلوگیری از آسیب کروموزومی (80).
تيموكينون
عوامل شیمی درمانی و محافظ شیمیایی زیره سیاه عبارتند از تیموکینون (TQ)، دیتیموکینون (DTQ) و تیموهیدروکینون که در روغن این دانه وجود دارد. TQ دارای فعالیت ضد نئوپلاستیک در برابر سلول های تومور مختلف است. DTQ همچنین به اثرات شیمی درمانی سیاهدانه کمک می کند. نتایج مطالعه آزمایشگاهی نشان داد که DTQ و TQ برای چندین رده سلولی والدین و ردههای سلولی تومور انسانی مقاوم به چند داروی متناظر با آنها سیتوتوکسیک هستند. TQ آپوپتوز را از طریق مسیرهای وابسته به p53 و مستقل از p53 در رده های سلولی سرطانی القا می کند. همچنین باعث توقف چرخه سلولی می شود و سطح واسطه های التهابی را تعدیل می کند. تا به امروز، پتانسیل شیمی درمانی TQ آزمایش نشده است، اما مطالعات متعدد اثرات ضد سرطانی امیدوارکننده آن را در مدل های حیوانی نشان داده اند. TQ تشکیل تومورهای پوستی و شکمی ناشی از سرطان را در موش سرکوب می کند و به عنوان یک عامل پیشگیری کننده شیمیایی در مراحل اولیه تومور زایی پوست عمل می کند. علاوه بر این، نشان داده شده است که ترکیب TQ و داروهای ضدسرطان مورد استفاده بالینی، شاخص درمانی دارو را بهبود میبخشد، از آسیبهای ناشی از شیمیدرمانی به بافتهای غیرتوموری جلوگیری میکند و فعالیت ضد توموری داروهایی مانند سیس پلاتین و ایفوسفامید را افزایش میدهد. یک گزارش بسیار جدید از گروه خودمان نشان داد که TQ با سرکوب محصولات ژنی تنظیمشده NF-?B و NF-?B بر مسیر سیگنالینگ NF-?B تأثیر میگذارد (81).
کپسایسین
ترکیب فنلی کپسایسین (t8-methyl-N-vanillyl-6-nonenamide)، جزء فلفل قرمز، به طور گسترده مورد مطالعه قرار گرفته است. اگرچه کپسایسین مشکوک به سرطان زا بودن آن بوده است، شواهد زیادی حاکی از آن است که این ماده دارای اثرات شیمیایی پیشگیری کننده است. خواص آنتی اکسیدانی، ضد التهابی و ضد توموری کپسایسین در هر دو سیستم in vitro و in vivo ثابت شده است. به عنوان مثال، نشان داد که کپسایسین می تواند فعال سازی NF-?B و AP-1 تحریک شده با TPA را در سلول های HL-60 کشت شده سرکوب کند. علاوه بر این، کپسایسین از فعال سازی سازنده NF-?B در سلول های ملانوم بدخیم جلوگیری کرد. علاوه بر این، کپسایسین به شدت فعالسازی NF-?B تحریکشده با TPA و فعالسازی اپیدرمی AP-1 را در موشها سرکوب کرد. مکانیسم پیشنهادی دیگر اثر کپسایسین برهمکنش آن با آنزیمهای متابولیزه کننده بیگانهبیوتیک است که در فعالسازی و سمزدایی سرطانزاها و جهشزاهای شیمیایی مختلف نقش دارد. متابولیسم کپسایسین توسط آنزیم های کبدی، واسطه های رادیکال فنوکسی واکنشی را تولید می کند که قادر به اتصال به مکان های فعال آنزیم ها و ماکرومولکول های بافتی هستند.
کپسایسین میتواند تجمع پلاکتها را مهار کند و پاسخهای پیشالتهابی تحریکشده با کلسیم-یونوفور، مانند تولید آنیون سوپراکسید، فعالیت فسفولیپاز A2 و پراکسیداسیون لیپید غشایی در ماکروفاژها را سرکوب کند. به عنوان یک آنتی اکسیدان در اندام های مختلف حیوانات آزمایشگاهی عمل می کند. خواص ضد التهابی کپسایسین در برابر التهاب ناشی از سرطان در موشها و موشها نیز گزارش شده است. کپسایسین اثرات محافظتی در برابر آسیب مخاط معده ناشی از اتانول، فرسایش هموراژیک، پراکسیداسیون لیپیدی و فعالیت میلوپراکسیداز در موشهای صحرایی که با سرکوب COX-2 مرتبط بود، اعمال میکند. در حالی که فاقد فعالیت تقویت کننده تومور ذاتی بود، کپسایسین TPAe-promoous را مهار کرد. پاپیلوموژنز پوست (82).
گینگرول
جینجرول، یک ماده فنولی که عمدتاً در ادویه زنجبیل (Zingiber officinale Roscoe) وجود دارد، دارای اثرات دارویی متنوعی از جمله اثرات آنتی اکسیدانی، ضد آپوپتوز و ضد التهابی است. نشان داده شده است که جینجرول دارای خواص ضد سرطانی و شیمیپیشگیری است و مکانیسمهای اثر پیشنهادی شامل مهار بیان COX-2 با مسدود کردن مسیر سیگنالینگ MAPK-NF-?B p38 است. گزارش مفصلی در مورد توانایی پیشگیری از سرطان جینجرول در بررسی اخیر توسط Shukla و Singh (83) ارائه شده است.
آنتول
آنتوول، مولکول اصلی آفتابگردان، فعالیت ضد سرطانی را نشان داده است. در 1995، الحربی و همکاران. (84) فعالیت ضد تومور آنتوول در برابر کارسینوم Ehrlich ascites ناشی از یک مدل تومور در موش ها مورد مطالعه قرار گرفت. این مطالعه نشان داد که آنتول افزایش زمان بقا، کاهش وزن تومور و کاهش حجم و وزن موش های EAT را تحمل می کند. همچنین اثر سیتوتوکسیک قابل توجهی را در سلولهای EAT در پا ایجاد کرد، سطوح اسید نوکلئیک و MDA و افزایش غلظت NP-SH را کاهش داد.
تغییرات هیستوپاتولوژیک مشاهده شده پس از درمان با آنتول با تغییرات پس از درمان با داروی سیتوتوکسیک استاندارد سیکلوفسفامید قابل مقایسه بود. فراوانی وقوع ریزهستهها و نسبت گلبولهای قرمز پلیکروماتیک به گلبولهای قرمز نوروکروماتیک نشان داد که آنتول در سلولهای فمورال موشها میتودپرسیو و غیرکلاستوژنیک است. در سال 1996، Sen et al., (85) فعالیت مهاری NF-?B یک مشتق از آنتول و آنتولدیتیولتیون را مطالعه کردند. نتایج مطالعه آنها نشان داد که آنتول H2O2، فوربول میریستات استات یا TNF آلفا فعال سازی NF-?B را در سلول های T jurkat انسانی مهار می کند (86) فعالیت ضد سرطانی آنتول تریتیون را در برابر DMBA القاء شده در مدل سرطان پستان موش مورد مطالعه قرار دادند. نتایج مطالعه نشان داد که این فیتوشیمیایی رشد تومور پستان را به صورت وابسته به دوز مهار می کند.
ناکاگاوا و سوزوکی (87) متابولیسم و مکانیسم عمل ترانس آنتول (آنتول) و فعالیت استروژنیک این ترکیب و متابولیت های آن را در سلول های سرطانی پستان انسانی MCF-7 کشت کرده اند. نتایج نشان داد که تبدیل بیوتکنولوژی آنتوول باعث افزایش اثر غلظت سیتوتوکسیک در غلظت های بالاتر در hepatocytes موش و اثرات استروژن در غلظت های پایین تر در سلول های MCF-7 بر اساس غلظت هیدروکلیک میانی 4OHPB می شود. نتایج مطالعات پیشین نشان داده است که ترکیب آنتوکل دیسیولیتین موجود در اتانول سولفور میتواند عامل مؤثر شیمی در برابر سرطان ریه باشد. لام و همکاران (88) یک آزمایش فاز 2b را انجام دادند که در آن افراد سیگاری با دیسپلازی برونش انجام شد. نتایج این کارآزمایی بالینی نشان می دهد که آنتیل دیتیولیتین یک عامل شیمی درمانی موثر بر سرطان ریه است.
دیوسگنین
نشان داده شده است که دیوسژنین، یک ساپونین استروئیدی موجود در شنبلیله، التهاب را سرکوب می کند، تکثیر را مهار می کند و باعث القای آپوپتوز در سلول های مختلف تومور می شود. تحقیقات در دهه گذشته نشان داده است که دیوسژنین تکثیر را سرکوب می کند و باعث القای آپوپتوز در طیف گسترده ای از رده های سلولی سرطانی می شود. اثرات ضد تکثیری دیوسژنین از طریق توقف چرخه سلولی، اختلال در هموستاز Ca2+، فعال شدن p53، آزادسازی فاکتور القا کننده آپوپتوز و تعدیل فعالیت کاسپاز-3 انجام می شود. دیوسژنین همچنین کانون های نابجای کریپت کولون ناشی از آزوکسی متان را مهار می کند، نشان داده شده است که التهاب روده را مهار می کند و فعالیت LOX و COX-2 را تعدیل می کند. همچنین نشان داده شده است که دیوسژنین به گیرنده کموکاین CXCR3 که واسطه پاسخ های التهابی است، متصل می شود. نتایج آزمایشگاه خودمان نشان داده است که دیوسژنین از طریق تنظیم پایین Akt، فعال سازی I?B کیناز و بیان ژن تنظیم شده NF-?B، استئوکلاستوژنز، تهاجم سلولی و تکثیر سلولی را مهار می کند (89).
یوژنوول
Eugenol یکی از اجزای فعال گل میخ است. مطالعات انجام شده توسط Ghosh و همکاران (90) نشان داد که پروتئین سلول های ملانوم اگنول سرکوب شده است. در یک مطالعه Xenograft B16، درمان Eugenol موجب تاخیر رشد تومور شد، کاهش تقریبا 40٪ در اندازه تومور و افزایش درصد 19 در زمان متوسط تا نقطه پایان. از اهمیت بیشتری، 50٪ از حیوانات در گروه کنترل در اثر رشد متاستاتیک فوت کرد، در حالیکه هیچکدام در گروه درمان اژه نول هیچ نشانه ای از حمله سلولی یا متاستاز نداشتند. در 1994، Sukumaran و همکاران (91) نشان داد که DMEE eugenol باعث ایجاد تومورهای پوستی در موش می شود. همان مطالعه نشان داد که اگنول باعث تشکیل سوپراکسید و پراکسیداسیون لیپید و فعالیت پالایش دهنده رادیکال می شود که ممکن است مسئول اقدام شیمی درمانی آن باشد. مطالعات انجام شده توسط Imaida و همکاران. (92) نشان داد که اگنول باعث افزایش تولید هیپرپلازی ناشی از 1,2- دی متیل هیدرازین و پاپیلوم ها در جنگل می شود، اما بروز ناباروری های کلیوی ناشی از 1-methyl-1-nitro-sourea در موش های صحرایی نر F344 کاهش می یابد.
مطالعه دیگری که توسط پیسانو و همکاران انجام شد. (93) نشان دادند که اوژنول و بی فنیل (S)-6,6،2003?-دیبروم دهیدرودیوژنول مرتبط، فعالیت ضد تکثیری خاصی را بر روی سلولهای تومور نورواکتودرمی ایجاد میکنند و تا حدی باعث آپوپتوز میشوند. در سال 94، کیم و همکاران. (2) نشان داد که اوژنول بیان COX-29 mRNA (یکی از ژن های اصلی دخیل در فرآیندهای التهاب و سرطان زایی) را در سلول های HT-264.7 و سلول های RAW95 ماکروفاژ موش تحریک شده با لیپوپلی ساکارید سرکوب می کند. مطالعه دیگری توسط Deigner و همکاران. (1) نشان داد که 5β-هیدروکسیوژنول مهارکننده خوبی برای اکسیداسیون لیپوپروتئین با چگالی کم 2-لیپوکسیژناز و Cu(96+) است. مطالعات رومپلبرگ و همکاران. (XNUMX) نشان داد که درمان in vivo موش با اوژنول باعث کاهش جهش زایی بنزوپیرن در سنجش جهش زایی سالمونلا تیفی موریوم شد، در حالی که تیمار آزمایشگاهی سلول های کشت شده با اوژنول باعث افزایش سمیت ژنی بنزوپیرن شد.
غذاهای Wholegrain
غذاهای کل سبوس گندم عبارتند از گندم، برنج و ذرت؛ اجزای کوچک آنها جو، سورگوم، ارزن، چاودار و جو. دانه ها اکثرا در مقیاس رژیم غذایی قرار دارند، اما اکثر آنها به عنوان محصولات دانه سازی تصفیه شده در کشورهای غربی (97) خورده می شوند. دانه های کامل شامل آنتی اکسیدان های شیمیایی مانند ویتامین E، تکتوریول، اسید فنولیک، لیگناها و اسید فیت است. محتوای آنتی اکسیدانی دانه های جامد کمتر از برخی انواع توت هاست اما بیشتر از میوه ها یا سبزی های معمولی است (98). فرایند پالایش، کاربو هیدرات را متمرکز می کند و مقدار دیگر مغذی ها، ویتامین ها و مواد معدنی را کاهش می دهد، زیرا لایه های بیرونی حذف می شوند. در واقع، تمام مواد مغذی با اقدامات پیشگیرانه بالقوه علیه سرطان کاهش می یابد. به عنوان مثال، ویتامین E به میزان 92٪ (99) کاهش می یابد.
مصرف غلات سبوس دار خطر ابتلا به چندین سرطان از جمله سرطان های حفره دهان، حلق، مری، کیسه صفرا، حنجره، روده، کولورکتوم، دستگاه گوارش فوقانی، سینه ها، کبد، آندومتر، تخمدان ها، غده پروستات، مثانه، کلیه ها و غده تیروئید، و همچنین لنفوم ها، لوسمی ها و میلوما (100,101،30). مصرف غذاهای سبوس دار در این مطالعات خطر ابتلا به سرطان را تا 70 تا 102 درصد کاهش داد (XNUMX).
غلات کامل چگونه خطر ابتلا به سرطان را کاهش می دهند؟ چندین مکانیسم بالقوه شرح داده شده است. به عنوان مثال، فیبرهای نامحلول، یکی از اجزای اصلی غلات کامل، می توانند خطر ابتلا به سرطان روده را کاهش دهند (103). علاوه بر این، فیبر نامحلول تحت تخمیر قرار میگیرد و در نتیجه اسیدهای چرب با زنجیره کوتاه مانند بوتیرات تولید میکند که یک سرکوبکننده مهم تشکیل تومور است (104). غلات کامل همچنین پاسخ گلوکز مطلوب را انجام می دهند که در برابر سرطان سینه و روده بزرگ محافظت می کند (105). همچنین، چندین فیتوکمیکال از غلات و حبوبات گزارش شده است که عملکرد شیمیایی پیشگیرانه در برابر انواع وسیعی از سرطان ها دارند. به عنوان مثال، ایزوفلاون ها (شامل دایدزین، جنیستئین و اکوول) ترکیبات دی فنلی غیراستروئیدی هستند که در گیاهان حبوبات یافت می شوند و دارای فعالیت ضد تکثیر هستند. یافتههای چندین مطالعه، اما نه همه، همبستگی قابل توجهی را بین رژیم غذایی مبتنی بر سویا غنی از ایزوفلاون و کاهش بروز سرطان یا مرگ و میر ناشی از سرطان در انسان نشان دادهاند. آزمایشگاه ما نشان داده است که توکوترینولها، اما نه توکوفرولها، میتوانند فعالسازی NF-?B ناشی از اکثر مواد سرطانزا را سرکوب کنند، بنابراین منجر به سرکوب ژنهای مختلف مرتبط با تکثیر، بقا، تهاجم و رگزایی تومورها میشوند (106).
مطالعات مشاهده شده نشان داده است که یک رژیم غذایی حاوی ایزوفلاون سویا (مانند رژیم غذایی معمولی آسیا) یکی از مهمترین عوامل موثر در کاهش بروز و مرگ و میر سرطان پروستات در آسیا است. بر اساس یافته های مربوط به رژیم غذایی و میزان دفع ادراری مرتبط با دایدزین، ژن هایستین و equol در افراد ژاپنی در مقایسه با یافته های افراد آمریکایی یا اروپایی، ایزوفلاونویدها در محصولات سویا پیشنهاد شده اند که مسئول کاهش خطر ابتلا به سرطان هستند. علاوه بر اثرات آن بر سرطان پستان، ژنیسین و ایزوفلاوون های مرتبط نیز باعث جلوگیری از رشد سلول و یا توسعه سرطان های ناشی از شیمی در معده، مثانه، ریه، پروستات و خون (107) می شوند.
ویتامین ها
گرچه بحث برانگیز است، نقش ویتامین ها در پیشگیری شیمی درمانی سرطان به طور فزاینده ای مورد ارزیابی قرار می گیرد. میوه ها و سبزیجات منبع اصلی رژیم غذایی ویتامین D به جز ویتامین D هستند. ویتامین ها، به خصوص ویتامین های C، D و E، گزارش شده اند که فعالیت شیمیدرمانی سرطان بدون سمیت ظاهری دارند.
یافته های تحقیقات اپیدمیولوژیک نشان می دهد که اثرات ضد سرطانی / شیمی درمانی ویتامین C در برابر انواع مختلف سرطان ها با فعالیت های آنتیاکسیدانی آن و با مهار التهاب و ارتباط بین سلولی اتصال شکاف ارتباط دارد. یافته های یک مطالعه اپیدمیولوژیک اخیر نشان می دهد که غلظت ویتامین C بالا در پلاسما رابطه معکوس با مرگ و میر مرتبط با سرطان دارد. در 1997، هیئت های تخصصی در صندوق تحقیقات سرطان جهانی و موسسه تحقیقات سرطان آمریکا بر این باورند که ویتامین C می تواند خطر ابتلا به سرطان های معده، دهان، رحم، مری، ریه، پانکراس و رحم (108) را کاهش دهد.
اثرات محافظتی ویتامین D در اثر نقش آن به عنوان یک عامل رونویسی هسته ای است که سلول های رشد، تمایز، آپوپتوز و طیف وسیعی از مکانیزم های سلولی را که در توسعه سرطان (109) نقش دارند، تنظیم می کند.
ورزش / فعالیت فیزیکی
شواهد گسترده ای وجود دارد که نشان می دهد ورزش منظم ممکن است بروز سرطان های مختلف را کاهش دهد. سبک زندگی بی تحرک با اکثر بیماری های مزمن مرتبط است. عدم تحرک بدنی با افزایش خطر سرطان سینه، روده بزرگ، پروستات و پانکراس و ملانوم مرتبط است (110). افزایش خطر ابتلا به سرطان سینه در زنان کم تحرک که نشان داده شده است به دلیل ورزش نکردن است، با غلظت بالاتر استرادیول سرم، غلظت پایین تر گلوبولین پیوند دهنده هورمون، توده های چربی بزرگتر و سطح انسولین سرم بالاتر مرتبط است. عدم تحرک بدنی همچنین می تواند خطر ابتلا به سرطان روده بزرگ را افزایش دهد (به احتمال زیاد به دلیل افزایش زمان انتقال دستگاه گوارش، در نتیجه افزایش مدت زمان تماس با مواد سرطان زا بالقوه)، افزایش سطح گردش خون انسولین (تکثیر سلول های اپیتلیال کولون)، سطح پروستاگلاندین را تغییر می دهد، عملکرد سیستم ایمنی را کاهش می دهد و متابولیسم اسید صفراوی را اصلاح می کند. علاوه بر این، مردان با سطح فعالیت بدنی پایین و زنان با شاخص توده بدنی بیشتر، بیشتر در معرض جهش Ki-ras در تومورهای خود بودند، که در 30 تا 50 درصد از سرطان های روده بزرگ رخ می دهد. کاهش تقریباً 50 درصدی در بروز سرطان روده بزرگ در میان افرادی که بالاترین سطح فعالیت بدنی را داشتند مشاهده شد (111). به طور مشابه، سطوح بالاتر تستوسترون خون و IGF-1 و سیستم ایمنی سرکوب شده به دلیل عدم ورزش ممکن است بروز سرطان پروستات را افزایش دهد. یک مطالعه نشان داد که مردان کم تحرک 56 درصد و زنان 72 درصد بیشتر از مردانی که 5 تا 7 روز در هفته ورزش می کردند، به ملانوم مبتلا بودند (112).
محدودیت های کالری
روزه نوعی از محدودیت کالری (CR) است که در اکثر فرهنگ ها تجویز می شود. شاید یکی از اولین گزارش هایی که CR در بروز سرطان تاثیر می گذارد در 1940 در شکل گیری تومورهای پوست و هپاتوم در موش (113، 114) منتشر شد. از آن به بعد، چندین گزارش از این موضوع منتشر شده است (115، 116). محدودیت های غذایی، به ویژه CR، یک اصلاح کننده عمده در سرطان زایی آزمایشی است و شناخته شده است که به طور قابل توجهی کاهش بروز نئوپلاسم. Gross و Dreyfuss گزارش دادند که محدودیت 36 در مصرف کالری به طور چشمگیری باعث کاهش تومورهای جامد و / یا لوسمی ناشی از اشعه (117، 118) شد. یوشیدا و همکاران (119) نیز نشان داد که CR کاهش بروز لوسمی میلوئیدی ناشی از یک درمان تک با اشعه کامل بدن در موش ها را کاهش می دهد.
چگونه CR کاهش بروز سرطان به طور کامل درک نمی شود. CR در جوندگان، سطوح گلوکز پلاسما و IGF-1 را کاهش می دهد و سرطان و التهاب بدون عوارض جانبی غیر قابل برگشت (120) را به تعویق می اندازد. بیشتر مطالعات انجام شده در مورد اثر CR در جوندگان طولانی مدت است؛ با این حال، این در افراد امکان پذیر نیست، که به طور معمول براساس گذر زمان CR انجام می شود. تأثیر گذار CR بر سرطان در انسان مشخص نیست.
نتیجه گیری
بر اساس مطالعاتی که در بالا شرح داده شد، ما یک فرضیه متحد ارائه می دهیم که تمام عوامل شیوه زندگی که باعث ایجاد سرطان (عامل سرطانزا) و تمام عواملی که از سرطان جلوگیری می کنند (از طریق داروهای شیمی درمانی) از طریق التهاب مزمن مرتبط هستند (شکل 10). واقعیت این است که التهاب مزمن به روش مسیر تومور ژنیک نزدیک است و از شواهد متعدد است.
اول، نشانگرهای التهابی مانند سیتوکین ها (مانند TNF، IL-1، IL-6، و کموکاین ها)، آنزیم ها (مانند COX-2، 5-LOX، و ماتریکس متالوپروتئیناز-9 [MMP-9])، و چسبندگی مولکول ها (مانند مولکول چسبندگی بین سلولی 1، مولکول چسبنده لکوسیت اندوتلیوم 1، و مولکول چسبندگی سلول عروقی 1) با تومورزایی ارتباط نزدیکی دارند. دوم، نشان داده شده است که تمام این محصولات ژن التهابی توسط فاکتور رونویسی هسته ای NF-?B تنظیم می شوند. سوم، نشان داده شده است که NF-?B بیان سایر محصولات ژنی مرتبط با تومورزایی مانند بقای سلول های تومور یا آنتی آپوپتوز را کنترل می کند (Bcl-2، Bcl-xL، IAP-1، IAP-2، XIAP، survivin، cFLIP، و TRAF-1)، تکثیر (مانند c-myc و cyclin D1)، تهاجم (MMP-9)، و رگزایی (فاکتور رشد اندوتلیال عروقی). چهارم، در بیشتر سرطان ها، التهاب مزمن مقدم بر تومورزایی است.
پنجم، اکثر مواد سرطان زا و سایر عوامل خطر سرطان، از جمله دود سیگار، چاقی، الکل، هایپرگلیسمی، عوامل عفونی، نور خورشید، استرس، مواد سرطان زا مواد غذایی و آلاینده های محیطی، نشان داده شده است که NF-?B را فعال می کنند. ششم، فعال سازی سازنده NF-?B در اکثر انواع سرطان ها مشاهده شده است. هفتم، بیشتر عوامل شیمی درمانی و پرتوهای بتا که برای درمان سرطان ها استفاده می شود، منجر به فعال شدن NF-?B می شود. هشتم، فعال شدن NF-?B با مقاومت شیمیایی و مقاومت رادیویی مرتبط است. نهم، سرکوب NF-?B از تکثیر تومورها جلوگیری می کند، منجر به آپوپتوز می شود، تهاجم را مهار می کند و رگزایی را سرکوب می کند. دهم، پلیمورفیسمهای ژنهای TNF، IL-1، IL-6 و cyclin D1 که در سرطانهای مختلف مشاهده میشوند، همگی توسط NF-?B تنظیم میشوند. همچنین، جهش در ژنهای کدکننده مهارکنندههای NF-?B در برخی سرطانها یافت شده است. یازدهم، تقریباً تمام عوامل شیمیایی پیشگیرانه که در بالا توضیح داده شد نشان داده شده است که فعال سازی NF-?B را سرکوب می کنند. به طور خلاصه، این بررسی قابلیت پیشگیری از سرطان را بر اساس عوامل خطر اصلی سرطان نشان می دهد. درصد مرگ و میرهای مرتبط با سرطان که به رژیم غذایی و تنباکو نسبت داده می شود به 60 تا 70 درصد در سراسر جهان می رسد.
تصدیق
این تحقیق توسط بنیاد کلایتون برای تحقیق (به BBA) پشتیبانی شد.