بدن کتون توسط کبد ایجاد می شود و هنگامی که گلوکز به راحتی در بدن انسان در دسترس نیست ، به عنوان منبع انرژی مورد استفاده قرار می گیرد. دو جسم اصلی کتون عبارتند از استو استات (AcAc) و 3-بتا-هیدروکسی بوتیرات (3HB) ، در حالی که استون سومین و کمترین جسم کتون است. کتونها همیشه در خون وجود دارند و در طی روزه داری و ورزش طولانی مدت سطح آنها افزایش می یابدKetogenesis فرآیند بیوشیمیایی است که توسط آن ارگانیزم بدن کتون را از طریق تجزیه اسید های چرب و اسیدهای آمینه کتوژن تولید می کند.
بدن کتون در اکثر موارد تولید می شود میتوکندری سلول های کبدی. کتوژنز زمانی اتفاق می افتد که سطح گلوکز پایین در خون وجود داشته باشد، به ویژه پس از اینکه دیگر فروشگاه های کربوهیدرات سلولی مانند گلیکوژن خسته شده اند. این مکانیسم همچنین می تواند زمانی رخ دهد که مقدار کافی انسولین وجود نداشته باشد. در نهایت تولید کتونهای بدن برای ایجاد انرژی در دسترس است که در بدن انسان به عنوان اسید چرب ذخیره می شود. کتوژنز در میتوکندری رخ می دهد که در آن به طور مستقل تنظیم می شود.
فهرست
چکیده
متابولیسم بدن کتونی یک گره مرکزی در خانه شناسی فیزیولوژیک است. در این بررسی، ما بحث می کنیم که چگونه کتون ها نقش متابولیک ریز تنظیم کننده ای را ایفا می کنند که عملکرد ارگان و ارگانیزم را در انواع باقی مانده های مواد مغذی بهینه می کند و از التهاب و آسیب در سیستم های چندگانه محافظت می کند. به طور سنتی به عنوان زیر ساختارهای متابولیک تنها در محدودیت کربوهیدرات مورد توجه قرار گرفته است، مشاهدات اخیر، اهمیت بدن کتون را به عنوان متصديان متابوليسم و سيگنالينگ مهم در هنگام کربوهيدرات فراوان است. با تکمیل مجموعه ای از گزینه های درمان شناخته شده برای بیماری های سیستم عصبی، نقش های آینده ای برای بدن کتون در سرطان ایجاد شده است، به عنوان نقش محافظتی جذاب در قلب و کبد، باز کردن گزینه های درمانی در بیماری های مرتبط با چاقی و قلب و عروق. اختلاف نظر در متابولیسم کوانتوم و سیگنالینگ به منظور مقابله با داستانی کلاسیک با مشاهدات معاصر مورد بحث قرار گرفته است.
معرفی
اجسام کتون یک منبع سوخت متابولیکی جایگزین حیاتی برای تمام حوزه های زندگی ، یوکاریا ، باکتری ها و باستان است (Aneja et al.، 2002؛ Cahill GF Jr، 2006؛ Krishnakumar et al.، 2008). متابولیسم بدن کتون در انسان برای سوخت رسانی به مغز در دوره های اپیزودیک محرومیت از مواد مغذی استفاده شده است. اجسام کتون با مسیرهای متابولیکی حیاتی پستانداران مانند بتاکسیداسیون (FAO) ، چرخه اسید تریکاربوکسیلیک (TCA) ، گلوکونئوژنز ، لیپوژنز نو (DNL) و بیوسنتز استرول ها در هم تنیده شده اند. در پستانداران ، اجسام کتون عمدتا از استیل-CoA مشتق شده از فاو در کبد تولید می شوند و آنها برای اکسیداسیون ترمینال به بافتهای خارج کبدی منتقل می شوند. این فیزیولوژی سوخت جایگزینی را تأمین می کند که با دوره های نسبتاً کوتاه ناشتایی تقویت می شود ، که در دسترس بودن اسیدهای چرب را افزایش می دهد و میزان کربوهیدرات را کاهش می دهد (Cahill GF Jr، 2006؛ McGarry and Foster، 1980؛ Robinson and Williamson، 1980). اکسیداسیون بدن کتون به میزان قابل توجهی در متابولیسم انرژی پستانداران در بافتهای خارج کبدی در هزاران حالت فیزیولوژیکی از جمله روزه داری ، گرسنگی ، دوره نوزادی ، بعد از ورزش ، بارداری و پیروی از رژیم های کم کربوهیدرات نقش دارد. غلظت کل بدن کتون در گردش در انسان های بالغ سالم به طور معمول بین تقریباً 100 250 M دارای نوسانات شبانه روزی است ، پس از ورزش طولانی مدت یا 1 ساعت ناشتا به 24 میلی متر افزایش می یابد و می تواند در حالت های پاتولوژیک مانند کتواسیدوز دیابتی تا 20 میلی متر تجمع یابد ( Cahill GF Jr، 2006؛ Johnson et al.، 1969b؛ Koeslag et al.، 1980؛ Robinson and Williamson، 1980؛ Wildenhoff et al.، 1974). کبد انسان روزانه حداکثر 300 گرم بدن کتون تولید می کند (بالاس و فری ، 1989) ، که 5 تا 20٪ از کل انرژی مصرفی در حالت های تغذیه ، روزه و گرسنگی را به خود اختصاص می دهد (بالاس و همکاران ، 1978 ؛ کوکس و al. ، 2016).
در حال حاضر مطالعات اخیر، نقش مهمی برای بدن کتون در متابولیسم سلول های پستانداران، هوموتازیست و سیگنالینگ تحت انواع مختلف بیماری های فیزیولوژیکی و پاتولوژیک را برجسته می کند. به جز استفاده از سوخت های انرژی برای بافت های خارج از بافت مثل مغز، قلب و عضلات اسکلتی، بدن کتون نقش اساسی را به عنوان واسطه های سیگنالینگ، رانندگان تغییرات پس از ترجمه پروتئین (PTM) و مدولاتورهای التهاب و استرس اکسیداتیو ایفا می کند. در این بررسی، ما هر دو دیدگاه های کلاسیک و مدرن از نقش های پلئوتروپیک بدن های کتون و متابولیسم آنها را ارائه می دهیم.
بررسی کلی متابولیسم بدن کتون
میزان کتوژنز کبدی توسط یک سری تنظیم شده از تغییرات فیزیولوژیکی و بیوشیمیایی چربی کنترل می شود. تنظیم کننده های اولیه شامل لیپولیز اسیدهای چرب از تریآسیل گلیسرول ها ، انتقال به داخل و غشا plas پلاسمای سلولهای کبدی ، انتقال به میتوکندری از طریق کارنیتین پالمیتوئیل ترانسفراز 1 (CPT1) ، مارپیچ اکسیداسیون؟ ، فعالیت چرخه TCA و غلظت های میانی ، پتانسیل اکسایش و تنظیم کننده های هورمونی است. از این فرآیندها ، عمدتا گلوکاگون و انسولین [بررسی شده در (Arias و همکاران ، 1995 ؛ Ayte و همکاران ، 1993 ؛ Ehara و همکاران ، 2015 ؛ Ferre و همکاران ، 1983 ؛ Kahn و همکاران ، 2005 ؛ McGarry و Foster ، 1980 ؛ ویلیامسون و دیگران ، 1969)]. به طور کلاسیک کتوژنز به عنوان یک مسیر سرریز مشاهده می شود ، که در آن استیل- CoA حاصل از اکسیداسیون بیش از فعالیت سنتاز سیترات و / یا در دسترس بودن اکسالواستات برای میعان تشکیل سیترات است. واسطه های سه کربنی فعالیت ضد کتوژنیک از خود نشان می دهند ، احتمالاً به دلیل توانایی آنها در گسترش استخر اگزالو استات برای مصرف استیل-CoA ، اما غلظت استیل-CoA کبدی به تنهایی میزان کتوژنیک را تعیین نمی کند (فاستر ، 1967 ؛ راوات و مناهان ، 1975 ؛ ویلیامسون و همکاران ، 1969). تنظیم کتوژنز توسط حوادث هورمونی ، رونویسی و پس از ترجمه با هم این عقیده را پشتیبانی می کند که مکانیسم های مولکولی سرعت کتوژنیک دقیق را کاملاً درک نشده باقی می مانند (به مقررات HMGCS2 و SCOT / OXCT1 مراجعه کنید).
کتوژنز در درجه اول در ماتریس میتوکندری کبدی با نرخ متناسب با اکسیداسیون کل چربی رخ می دهد. پس از انتقال زنجیره های آسیل از طریق غشاهای میتوکندری و اکسیداسیون β ، ایزوفرم میتوکندری 3-هیدروکسی متیل گلوتاریل-کوآ سنتاز (HMGCS2) سرنوشت متعهد شدن متراکم استواستیل CoA (AcAc-CoA) و استیل CoM CoA را تولید می کند (شکل 1 الف) HMG-CoA لیاز (HMGCL) باعث تجزیه HMG-CoA برای آزادسازی استیل-CoA و استواستات (AcAc) می شود و دومی توسط d-؟ OHB دهیدروژناز وابسته به فسفاتیدیل کولین به d -؟ - هیدروکسی بوتیرات (d-؟ OHB) کاهش می یابد. BDH1) در یک واکنش نزدیک به تعادل NAD + / NADH بهم پیوسته (Bock and Fleischer، 1975؛ LEHNINGER et al.، 1960). ثابت بودن تعادل BDH1 به تولید d-؟ OHB علاقه مند است ، اما نسبت اجسام کتون AcAc / d-؟ OHB مستقیماً با نسبت NAD + / NADH میتوکندری متناسب است و بنابراین فعالیت اکسیدوروکتاز BDH1 پتانسیل اکسایش میتوکندری را تعدیل می کند (Krebs و همکاران ، 1969 ؛ ویلیامسون و دیگران ، 1967). AcAc همچنین می تواند به طور خودبه خود از استون (پدرسن ، 1929) ، منبع بوی شیرین در انسانهایی که دچار کتواسیدوز هستند ، دکربوکسیله شود (به عنوان مثال ، اجسام کتون سرم کلی> 7 میلی متر ~ میلی متر ؛ AcAc pKa 3.6 ،؟ OHB pKa 4.7). مکانیسم هایی که از طریق آنها اجسام کتون از طریق غشای داخلی میتوکندری منتقل می شود شناخته شده نیست ، اما AcAc / d-؟ OHB از طریق حمل کننده های مونوکربوکسیلات از سلول ها آزاد می شود (در پستانداران ، MCT 1 و 2 ، همچنین به عنوان حامل املاح 16A اعضای خانواده 1 و 7 شناخته می شود) 2011) و برای گردش در بافتهای خارج کبدی برای اکسیداسیون ترمینال منتقل می شود (Cotter et al.، 2012؛ Halestrap and Wilson، 2012؛ Halestrap، 2012؛ Hugo et al.، 1940). غلظت اجسام کتون در گردش بیشتر از آن است که در بافتهای خارج کبدی وجود دارد (هریسون و لانگ ، 1) که نشان می دهد اجسام کتون به یک شیب غلظت منتقل می شوند. جهش های از دست دادن عملکرد در MCTXNUMX با دوره های خود به خودی کتواسیدوز همراه است ، که نقش مهمی در واردات بدن کتون دارد.
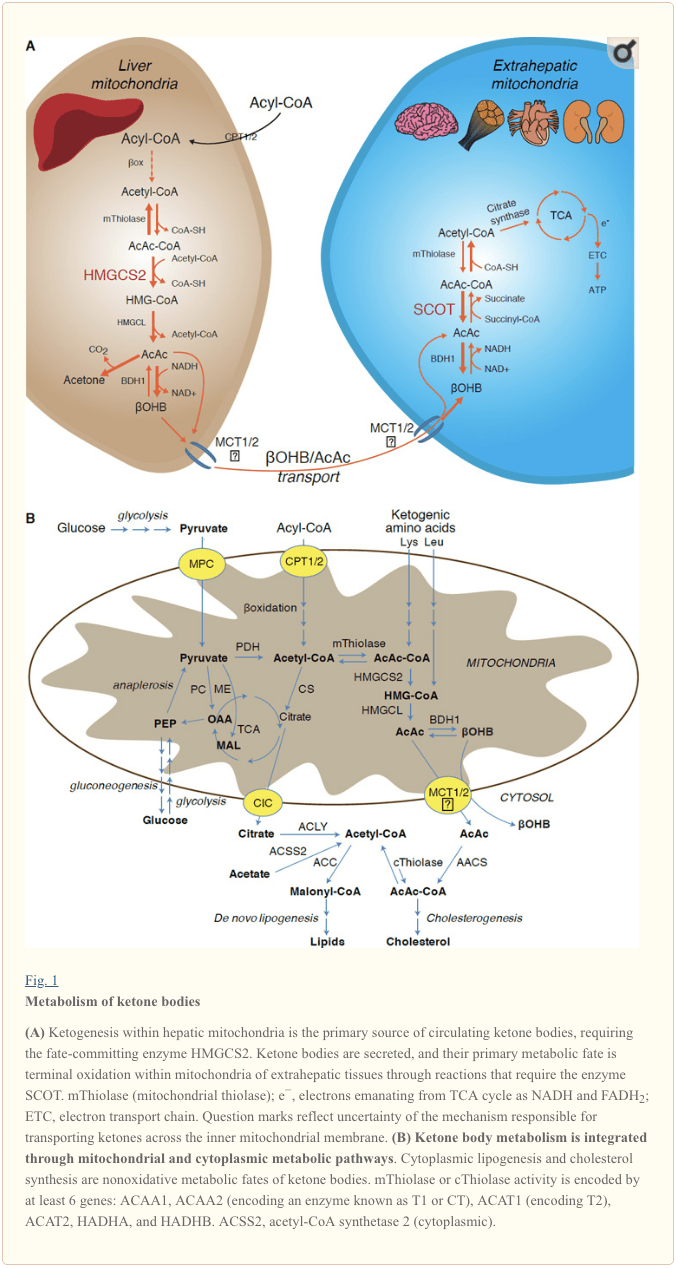
به استثنای انحراف بالقوه اجسام کتون به سرنوشتهای غیر اکسیداتیو (به سرنوشت متابولیکی غیر اکسیداتیو بدن کتون نگاه کنید) ، سلولهای کبدی توانایی متابولیسم اجسام کتونی تولیدی را ندارند. اجسام کتونی سنتز شده توسط کبد از طریق کبد (i) در میتوکندری بافتهای خارج کبدی به استیل-CoA کاتابولیزه می شوند ، که برای اکسیداسیون ترمینال در دسترس چرخه TCA است (شکل 1 A) ، (ii) به مسیرهای لیپوژنز یا سنتز استرول هدایت می شوند ( شکل 1B) ، یا (III) از طریق ادرار دفع می شود. به عنوان یک سوخت جایگزین انرژی ، اجسام کتون در قلب ، عضله اسکلتی و مغز اکسید می شوند (بالاسه و فری ، 1989 ؛ بنتورکیا و دیگران ، 2009 ؛ اوون و همکاران ، 1967 ؛ ریچارد و همکاران ، 1974 ؛ سلطان ، 1988 ) میتوکندری خارج کبدی BDH1 اولین واکنش اکسیداسیون؟ OHB را کاتالیز می کند و آن را به AcAc تبدیل می کند (LEHNINGER et al.، 1960؛ Sandermann et al.، 1986). یک d-؟ OHB- دهیدروژناز سیتوپلاسمی (BDH2) فقط با توالی 20٪ BDH1 دارای کیلومتر زیاد برای اجسام کتون است و همچنین در هموستاز آهن نقش دارد (داولوری و همکاران ، 2016 ؛ گوو و همکاران ، 2006) . در ماتریس میتوکندری خارج کبدی ، AcAc از طریق تبادل یک بخش CoA از سوکسینیل-CoA در یک واکنش کاتالیز شده توسط یک ترانسفراز CoA پستانداران منحصر به فرد ، سوکسینیل-CoA: ترانسفراز 3-اکسواسید-CoA (SCOT ، CoA ترانسفراز) به AcAc-CoA فعال می شود. رمزگذاری شده توسط OXCT1) ، از طریق یک واکنش تعادل نزدیک. انرژی آزاد آزاد شده توسط هیدرولیز AcAc-CoA بیشتر از سوکسینیل CoA است ، به نفع تشکیل AcAc است. بنابراین شار اکسیداتیو بدن کتون به دلیل عمل جرم اتفاق می افتد: یک منبع فراوان AcAc و مصرف سریع استیل-CoA از طریق سیترات سنتاز باعث ایجاد AcAc-CoA (+ سوکسینات) توسط SCOT می شود. قابل ذکر است ، بر خلاف گلوکز (هگزوکیناز) و اسیدهای چرب (آسیل-CoA سنتاز) ، فعال شدن اجسام کتون (SCOT) به شکل اکسید شونده نیازی به سرمایه گذاری ATP ندارد. یک واکنش تیولاز AcAc-CoA برگشت پذیر [توسط هر یک از چهار تیولاز میتوکندری کدگذاری شده توسط ACAA2 (رمزگذاری آنزیمی معروف به T1 یا CT) ، ACAT1 (رمزگذار T2) ، HADHA یا HADHB] کاتالیز می شود دو مولکول استیل-CoA تولید می کند ، که وارد چرخه TCA می شوند (Hersh and Jencks، 1967؛ Stern et al.، 1956؛ Williamson et al.، 1971). در طی حالت های کتوسی (یعنی کل کتونهای سرم> 500 میلی متر) ، بدن کتونها به میزان قابل توجهی در مصرف انرژی نقش دارند و در بافتها به سرعت مورد استفاده قرار می گیرند تا زمان جذب یا اشباع اکسیداسیون (Balasse et al.، 1978؛ Balasse and Fery، 1989) ؛ ادموند و همکاران ، 1987). کسر بسیار کمی از اجسام کتون مشتق از کبد را می توان به راحتی در ادرار اندازه گیری کرد ، و میزان استفاده و جذب مجدد توسط کلیه متناسب با غلظت گردش خون است (گلدشتاین ، 1987 ؛ رابینسون و ویلیامسون ، 1980). در طی حالتهای بسیار کتوتیک (> 1 میلی مولار در پلاسما) ، کتونوریا به عنوان گزارشگر کمی کمی کتوز عمل می کند ، اگرچه بیشتر آزمایشات بالینی بدن کتون ادرار AcAc را تشخیص می دهند اما نه OHB (Klocker و همکاران ، 2013)
بسترهای کتوژنیک و تأثیر آنها بر متابولیسم هپاتوستیک
بسترهای کتوژنیک شامل اسیدهای چرب و اسیدهای آمینه هستند (شکل 1B). کاتابولیسم اسیدهای آمینه، به خصوص لوسین، در حدود 4٪ از اجسام کتون در حالت پس از جذب (Thomas et al.، 1982) تولید می شود. به همین دلیل، استاتیک CoA برای ساخت کتون ها به طور عمده از اسیدهای چرب ساخته می شود، زیرا در حالت های کاهش کربوهیدرات، پیوروت به چرخه TCA کبدی وارد می شود، به ویژه از طریق آناپلروز، یعنی کربوکسیلسیون وابسته به ATP به اگزالاکتیت (OAA) یا مالات (MAL)، و نه decarboxylation اکسیداتیو به acetyl-CoA (Jeoung و همکاران، 2012؛ Magnusson و همکاران، 1991؛ Merritt و همکاران، 2011). در کبد، گلوکز و پیوواست نقش مهمی در کتوژنز دارند، حتی وقتی که decarboxylation پیروات به استیل کولا بیشترین مقدار را دارد (Jeoung و همکاران، 2012).
استیل کوا چندین نقش متمایز کننده متابولیسم واسطه های کبدی را فراتر از تولید ATP از طریق اکسیداسیون ترمینال شامل می کند (همچنین ادغام متابولیسم بدن کتون، اصلاح بعد از ترجمه و فیزیولوژی سلولی). Acetyl-CoA آلوستریک (I) پیروات کربوکسیلاز (PC) را فعال می کند، در نتیجه مکانیسم کنترل متابولیک را فعال می کند که ورود آناپلیروئید متابولیت ها را به چرخه TCA افزایش می دهد (Owen و همکاران، 2002، Scrutton و Utter، 1967) و (ii) پیرووات دهیدروژناز کیناز، که فسفوریلات و پریوروآدروژناز (PDH) را مهار می کند (کوپر و همکاران، 1975)، در نتیجه موجب افزایش جریان پیروات در چرخه TCA از طریق آناپلروز می شود. علاوه بر این، استیل کلاسی سیتوپلاسمی که استحکام آن توسط مکانیسم هایی که استیل کولیت میتوکندری را به متابولیت های قابل حمل تبدیل می کند، اکسیداسیون اسید های چرب را مهار می کند: کراتوکولاز استیل کروم (ACC) کاتالیز کننده تبدیل استیل CoA به ملونیل-CoA، سوبسترا لیپوژنیک و مهار کننده آلوستریک CPT1 میتوکندری [در بررسی (Kahn و همکاران، 2005، McGarry و Foster، 1980)] بررسی شده است. بنابراین، استحکام میتوکندری استیل CoA هر دو تنظیم شده و توسط مسیر عبور از کتوژنز تنظیم شده است، که ارکان اصلی جنبه های متابولیسم واسطه های کبدی است.
غیر متخلخل متابولیک بدن کتون
سرنوشت غالب کتونهای مشتق شده از کبد، وابسته به SCOT اکسیداسیون فوق العاده ای است. با این حال، AcAc می تواند از میتوکندری صادر شود و از طریق تبدیل به AcAc-CoA با استفاده از واکنش وابسته به ATP کاتالیز شده توسط سیتوپلاسمی acetoacetyl-CoA synthetase (AACS، شکل 1B) در مسیرهای آنابولیک مورد استفاده قرار می گیرد. این مسیر در حین رشد مغز و شیردهی شیردهی (Morris، 2005، Robinson و Williamson، 1978، Ohgami و همکاران، 2003) فعال است. AACS نیز به شدت در بافت چربی و استئوکلاست فعال شده است (Aguilo و همکاران، 2010، Yamasaki و همکاران، 2016). AcAc-CoA سیتوپلاسمی می تواند به واسطه سیتوزول HMGCS1 به سمت بیوسنتز استرول یا توسط هر دو تيولاز سيتوپلاسمی به استيل CoA (ACAA1 و ACAT2)، کربوکسیل شده به مالونيل-CoA، و به سنتز اسيدهاي چرب (Bergstrom et al.، 1984؛ ادموند، 1974؛ Endemann و همکاران، 1982؛ ژلن و همکاران، 1983؛ وببر و ادموند، 1977).
در حالی که اهمیت فیزیولوژیکی هنوز مشخص نشده است ، کتونها حتی در کبد می توانند به عنوان بسترهای آنابولیک عمل کنند. در زمینه های آزمایشگاهی مصنوعی ، AcAc می تواند به اندازه نیمی از لیپید تازه سنتز شده و تا 75٪ کلسترول جدید سنتز شده کمک کند (Endemann et al.، 1982؛ Geelen et al.، 1983؛ Freed et al.، 1988). از آنجا که AcAc از اکسیداسیون ناقص چربی کبدی گرفته شده است ، توانایی AcAc برای کمک به لیپوژنز در داخل بدن به معنای دوچرخه سواری بیهوده کبدی است ، جایی که می توان از کتونهای مشتق شده از چربی برای تولید چربی استفاده کرد ، مفهومی که اهمیت فیزیولوژیکی آن نیاز به اعتبار آزمایشی دارد ، اما می تواند مفید باشد نقش های سازگار یا ناسازگار (Solinas و همکاران ، 2015). AcAc مشتاقانه کلستروژنز را تهیه می کند ، با AACS Km-AcAc کم (50 MM) که حتی در حالت تغذیه فعال AcAc را ترجیح می دهد (Bergstrom و همکاران ، 1984). نقش پویای متابولیسم کتون سیتوپلاسمی در سلولهای عصبی جنینی موش اولیه و سلولهای چربی مشتق شده از 3T3-L1 پیشنهاد شده است ، زیرا AACS باعث کاهش اختلال در تمایز هر نوع سلول می شود (Hasegawa et al.، 2012a؛ Hasegawa et al.، 2012b). از بین بردن AACS در موش های داخل بدن باعث کاهش کلسترول سرم می شود (Hasegawa و همکاران ، 2012c). SREBP-2 ، تنظیم کننده اصلی رونویسی بیوسنتز کلسترول ، و گیرنده فعال کننده تکثیر پروکسی زوم (PPAR) -؟ فعال کننده های رونویسی AACS هستند و رونویسی آن را در طی رشد نوریت و در کبد تنظیم می کنند (Aguilo et al.، 2010؛ Hasegawa et al.، 2012c). در مجموع ، متابولیسم بدن کتون سیتوپلاسمی ممکن است در شرایط خاص یا تاریخ طبیعی بیماری مهم باشد ، اما برای دفع اجسام کتون مشتق شده از کبد کافی نیست ، زیرا هیپرکتونمی عظیم در تنظیم اختلال انتخابی سرنوشت اکسیداتیو اولیه از طریق از دست دادن جهش های عملکردی رخ می دهد به SCOT (بری و همکاران ، 2001 ؛ کوتر و همکاران ، 2011).
مقررات HMGCS2 و SCOT / OXCT1
واکنش یک میتوکندریایی از ژن کدگذاری HMGCS سیتوزول در اوایل تکامل مهره ها به علت نیاز به حمایت از کتوژنز کبدی در گونه های با نسبت مغز نسبت به وزن بدن (Boukaftane و همکاران، 1994، Cunnane و Crawford، 2003) رخ داده است. جهش های HMGCS2 از دست دادن طبیعت در انسان منجر به بروز هیپوگلیسمی هیپوکتوئیک می شوند (Pitt et al.، 2015؛ Thompson et al.، 1997). بیان قوی HMGCS2 به هپاتوسیت ها و اپیتلیوم کولون محدود می شود و بیان و فعالیت آنزیمی از طریق مکانیزم های مختلف (Mascaro و همکاران، 1995، مک گرری و فاستر، 1980، رابینسون و ویلیامسون، 1980) هماهنگ می شوند. در حالی که محدوده کامل حالت های فیزیولوژیکی که HMGCS2 را تحت تاثیر قرار می دهند، نیاز به توضیح بیشتری دارد، بیان و / یا فعالیت آن در طی دوره اولیه پس از تولد، پیری، دیابت، گرسنگی یا مصرف رژیم کتوژنیک (Balasse and Fery، 1989، Cahill GF Jr، 2006 ؛ Girard و همکاران، 1992؛ هگارد، 1999؛ ساتاپتی و همکاران، 2012؛ Sengupta و همکاران، 2010). در جنین ، متیلاسیون منطقه 5 طرفین ژن Hmgcs2 با رونویسی آن رابطه معکوس دارد و پس از تولد تا حدی معکوس می شود (آریاس و همکاران ، 1995 ؛ آیته و دیگران ، 1993 ؛ Ehara و همکاران ، 2015 ؛ Ferre و همکاران . ، 1983). به طور مشابه، Bdh1 کبدی دارای الگوی بیان تکاملی است که از زمان تولد تا از بین بردن آن افزایش می یابد و همچنین توسط رژیم کتوژنیک در یک فاکتور رشد فیبروبلاست (FGF) -21 بوجود می آید (Badman et al.، 2007، Zhang et al.، 1989 ) کتوژنز در پستانداران به شدت به انسولین و گلوکاگون واکنش نشان می دهد که به ترتیب سرکوب و تحریک می شوند (McGarry and Foster، 1977). انسولین لیپولیز بافت چربی را مهار می کند، بنابراین کتوژنز بستر خود را محروم می کند، در حالی که گلوکاگون باعث افزایش قدرت کتوژنیک از طریق اثر مستقیم بر کبد می شود (هگارد، 1999). Hmgcs2 رونویسی است forkhead FOXA2 عامل رونویسی، که از طریق انسولین فسفاتیدیل-3 کیناز / AKT مهار تحریک می شوند، و توسط گلوکاگون اردوگاه-p300 ناشی از زنگ (آریاس و همکاران، 1995؛ Hegardt، 1999؛ م و همکاران ، 1990؛ Thumelin و همکاران، 1993؛ فون Meyen و همکاران، 2013؛ Wolfrum و همکاران، 2004؛ Wolfrum و همکاران، 2003). PPAR؟ (رودریگز و همکاران ، 1994) همراه با هدف خود ، FGF21 (بادمن و همکاران ، 2007) همچنین باعث تحریک رونویسی Hmgcs2 در کبد در هنگام گرسنگی یا تجویز رژیم کتوژنیک می شود (بادمن و دیگران ، 2007 ؛ ایناگاکی و همکاران ، 2007 ) القای PPAR؟ ممکن است قبل از انتقال از فیزیولوژی جنین به نوزاد اتفاق بیفتد ، در حالی که فعال سازی FGF21 ممکن است در اوایل دوره نوزادی از طریق مهار OHB واسطه دیاستیلاز هیستون (HDAC) -3 (Rando و همکاران ، 2016) مورد علاقه قرار گیرد. مهار وابسته به PPAR mTORC1 (هدف پستانداران کمپلکس رپامایسین 1)؟ فعالیت رونویسی نیز تنظیم کننده کلیدی بیان ژن Hmgcs2 است (Sengupta و همکاران ، 2010) ، و کبد PER2 ، یک نوسان دهنده اصلی شبانه روزی ، به طور غیر مستقیم بیان Hmgcs2 را تنظیم می کند (Chavan و همکاران ، 2016). مشاهدات اخیر نشان می دهد که اینترلوکین -6 ناشی از تومور خارج کبدی باعث اختلال در کتوژنز از طریق PPAR می شود؟ سرکوب (Flint و همکاران ، 2016).
فعالیت آنزیم HMGCS2 از طریق چندین PTM تنظیم می شود. فسفوریلاسیون سریین HMGCS2 فعالیت خود را در شرایط آزمایشگاهی افزایش داد (Grimsrud et al.، 2012). . Hegardt، 2؛ لاو و تابز، 1995؛ م و همکاران، 1999؛ Rardin و همکاران، 1985؛ فعالیت HMGCS1990 است allosterically توسط سوکسینیل کوآ و لیزین succinylation باقی مانده (آریاس و همکاران، 2013 مهار رید و همکاران،. 1975؛ Thumelin و همکاران، 1993). سوسینیلینگ باقی مانده های لیزین HMGCS2، HMGCL و BDH1 در میتوکندری های کبدی، اهداف وابسته به DAD + وابسته به دیازیلاز سورونتین 5 (SIRT5) (Rardin و همکاران، 2013) است. فعالیت HMGCS2 نیز توسط de-acetylation لیزین SIRT3 افزایش یافته است و ممکن است که تداخل بین استیلیت و سوکسینسیون تنظیم فعالیت HMGCS2 (Rardin و همکاران، 2013، Shimazu و همکاران، 2013). علیرغم توانایی این PTM ها برای تنظیم HMGCS2 Km و Vmax، نوسانات این PTM ها هنوز با دقت نقشه بندی نشده اند و به عنوان رانندگان مکانیکی کتوژنز in vivo تایید نشده اند.
SCOT در تمام سلول های پستاندارانی که دارای میتوکندری هستند به جز hepatocytes ها بیان می شود. اهمیت فعالیت SCOT و کتولیز در موش های SCOT-KO نشان داده شد که به دلیل هیپوگلیسمی هیپکتونمی در طی 48h بعد از تولد (Coot et al.، 2011) نشان داده شد. از بین رفتن بافت SCOT در نورون ها یا میوسیت های اسکلتی باعث ایجاد اختلالات متابولیکی در هنگام گرسنگی می شود، اما کشنده نیست (Cotter et al.، 2013b). در انسان، کمبود SCOT در اوایل زندگی با کتوآکیدوز شدید ایجاد می کند، باعث بی نظمی، استفراغ و کما می شود (Berry و همکاران، 2001؛ Fukao و همکاران، 2000؛ Kassovska-Bratinova و همکاران، 1996؛ Niezen-Koning و همکاران. ، 1997؛ Saudubray و همکاران، 1987؛ Snyderman و همکاران، 1998؛ Tildon و Cornblath، 1972). نسبت سطح کمی در سطح سلولی در مورد ژن SCOT و تنظیم کننده های بیان پروتئین شناخته شده است. Expression of mRNA Oxct1 و پروتئین و فعالیت SCOT در حالت های کوتیوتیکی، احتمالا از طریق مکانیسم های وابسته به PPAR (Fenselau و Wallis، 1974، Fenselau و Wallis، 1976، Grinblat و همکاران، 1986، Okuda و همکاران، 1991، Turko et al .، 2001؛ Wentz و همکاران، 2010). در کتوآکیدوز دیابتی، عدم همبستگی بین کتوژنز کبدی و اکسیداسیون بیش از حد کبدی با اختلال فعالیت SCOT تشدید می شود. غلظت انسولین مستقل گلوکز (GLUT1 / SLC2A1) در كاردیومیوسیت ها همچنین بیان ژن Oxct1 را مهار می كند و اكسیداسیون تركیبی كاتون ها را در حالت غیر كتوتیكی (Yan et al.، 2009) پایین می آورد. در کبد، فراوانی mRNA Oxct1 توسط microRNA-122 و متیلاسیون هیستون H3K27me3 سرکوب می شود که در طی گذار از جنین به دوره نوزادی دیده می شود (Thorrez et al.، 2011). با این حال، سرکوب بیان Oxct1 کبدی در دوره پس از تولد در درجه اول به تخلیه پیش سازهای خونگرم بیان کننده Oxct1 از کبد، به جای از دست دادن بیان Expression Oxct1 که قبلا در hepatocytes differentiated پایدار وجود دارد. در واقع، بیان پروتئین Oxct1 mRNA و SCOT در hepatocytes های متمایز بسیار کم است (Orii et al.، 2008).
SCOT توسط PTM ها نیز تنظیم می شود. آنزیم در مغز موش های SIRT3 KO بیش از حد استیل شده است ، که همچنین تولید استیل-CoA وابسته به AcAc را نشان می دهد (Dittenhafer-Reed و همکاران ، 2015). نیتراتاسیون غیر آنزیمی باقیمانده تیروزین SCOT نیز فعالیت آن را کاهش می دهد ، که در قلب مدل های مختلف موش دیابتی گزارش شده است (مارکوندز و همکاران ، 2001 ، تورکو و دیگران ، 2001 ؛ وانگ و همکاران ، 2010a). در مقابل ، نیتراتاسیون باقیمانده تریپتوفان فعالیت SCOT را افزایش می دهد (Br g re et al.، 2010؛ Rebrin et al.، 2007). مکانیزم های مولکولی نیتراتاسیون یا نیتراتاسیون خاص باقیمانده که برای تعدیل فعالیت SCOT طراحی شده اند ممکن است وجود داشته باشد و نیاز به توضیح داشته باشد.
اختلافات در کتوز زخم ناخوشایند
در پستانداران اندام کتوژنیک اولیه کبد است و فقط سلولهای کبدی و سلولهای اپیتلیال روده ایزوفرم میتوکندری HMGCS2 را به طور فراوان بیان می کنند (Cotter et al.، 2013a؛ Cotter et al.، 2014؛ McGarry and Foster، 1980؛ Robinson and Williamson، 1980) . تخمیر باکتریایی بی هوازی از پلی ساکاریدهای پیچیده ، بوتیرات تولید می کند که برای اکسیداسیون یا کتوژنز توسط پستانداران توسط کولونوسیت ها جذب می شود (چربوی و همکاران ، 1995) ، که ممکن است در تمایز کولونوسیت ها نقش داشته باشد (وانگ و همکاران ، 2016). به استثنای سلولهای اپیتلیال روده و سلولهای کبدی ، HMGCS2 تقریباً در سایر سلولهای پستانداران وجود ندارد ، اما احتمال کتوژنز خارج کبدی در سلولهای تومور ، آستروسیتهای سیستم عصبی مرکزی ، کلیه ، لوزالمعده افزایش یافته است؟ سلولها ، اپیتلیوم رنگدانه شبکیه (RPE) و حتی در عضله اسکلتی (Adijanto et al.، 2014؛ Avogaro et al.، 1992؛ El Azzouny et al.، 2016؛ Grabacka et al.، 2016؛ Kang et al.، 2015 ؛ Le Foll و همکاران ، 2014 ؛ نوناکا و همکاران ، 2016 ؛ Takagi و همکاران ، 2016a ؛ Thevenet و همکاران ، 2016 ؛ Zhang و همکاران ، 2011). HMGCS2 خارج رحمی در بافتهایی مشاهده می شود که فاقد ظرفیت کتوژنیک خالص هستند (کوک و همکاران ، 2016 ؛ ونتز و همکاران ، 2010) و HMGCS2 فعالیتهای «نور مهتابی» مستقل از کتوژنز را نشان می دهد ، از جمله در هسته سلول (Chen و همکاران). ، 2016 ؛ Kostiuk و همکاران ، 2010 ؛ Meertens و همکاران ، 1998).
هر بافت خارج کبدی که اجزای کتون را اکسید می کند ، همچنین توانایی جمع شدن اجسام کتون از طریق مکانیزم های مستقل HMGCS2 را دارد (شکل 2A). با این حال ، هیچ بافت خارج کبدی وجود ندارد که در آن غلظت بدن کتون حالت پایدار بیش از آن باشد که در گردش خون وجود دارد (Cotter et al.، 2011؛ Cotter et al.، 2013b؛ Harrison and Long، 1940) ، با تأکید بر اینکه اجسام کتون به پایین منتقل می شوند شیب غلظت از طریق مکانیسم های وابسته به MCT1 / 2. یک مکانیسم کتوژنز خارج کبدی آشکارا ممکن است منعکس کننده اختلال نسبی اکسیداسیون کتون باشد. توضیحات بالقوه اضافی در حوزه تشکیل بدن کتون قرار دارد. اول ، کتوژنز نو ممکن است از طریق فعالیت آنزیمی برگشت پذیر تیولاز و SCOT رخ دهد (ویدمان و کربس ، 1969). وقتی غلظت استیل-CoA نسبتاً زیاد باشد ، واکنشهایی که معمولاً مسئول اکسیداسیون AcAc هستند در جهت معکوس عمل می کنند (GOLDMAN ، 1954). مکانیسم دوم زمانی اتفاق می افتد که واسطه های ناشی از اکسیداسیون؟ به دلیل تنگنای چرخه TCA جمع شوند ، AcAc-CoA از طریق یک واکنش کاتالیز شده توسط دهیدروژناز 3-هیدروکسی آسیل-CoA میتوکندری و بیشتر توسط 3-هیدروکسی بوتیریل به l-؟ OHB-CoA تبدیل می شود CoA deacylase به l-؟ OHB ، که با طیف سنجی جرمی یا طیف سنجی رزونانس از انانتیومر فیزیولوژیکی d-؟ OHB قابل تشخیص نیست (Reed and Ozand، 1980). l-؟ OHB را می توان از نظر كروماتوگرافی یا آنزیمی از d-؟ OHB تشخیص داد و در بافتهای خارج كبدی وجود دارد ، اما در كبد یا خون وجود ندارد (Hsu et al.، 2011). کتوژنز کبدی فقط d-؟ OHB ، تنها آنانتیومر که یک بستر BDH است ، تولید می کند (Ito et al.، 1984؛ Lincoln et al.، 1987؛ Reed and Ozand، 1980؛ Scofield et al.، 1982؛ Scofield et al.، 1982) سومین سازوکار مستقل از HMGCS2 از طریق کاتابولیسم اسیدهای آمینه ، به ویژه مکانیسم لوسین و لیزین ، d-؟ OHB تولید می کند. مکانیزم چهارم فقط به این دلیل آشکار است که به دلیل مصنوعی برچسب زنی است و بنابراین شبه کوکتوژنز نامیده می شود. این پدیده مربوط به برگشت پذیری واکنشهای SCOT و تیولاز است و می تواند به دلیل رقت ایزوتوپی ردیاب بدن کتون در بافت خارج کبدی ، باعث تخمین زیاد گردش بدن کتون شود (Des Rosiers و همکاران ، 1990 ؛ فینک و دیگران ، 1988) . با این وجود ، شبه کوکتوژنز ممکن است در اکثر زمینه ها قابل اغماض باشد (بیلی و همکاران ، 1990 ؛ کلر و همکاران ، 1978). یک شماتیک (شکل 2A) نشانگر یک روش مفید برای استفاده در حالی است که غلظت حالت پایدار بافتهای کتون را در نظر بگیرید.
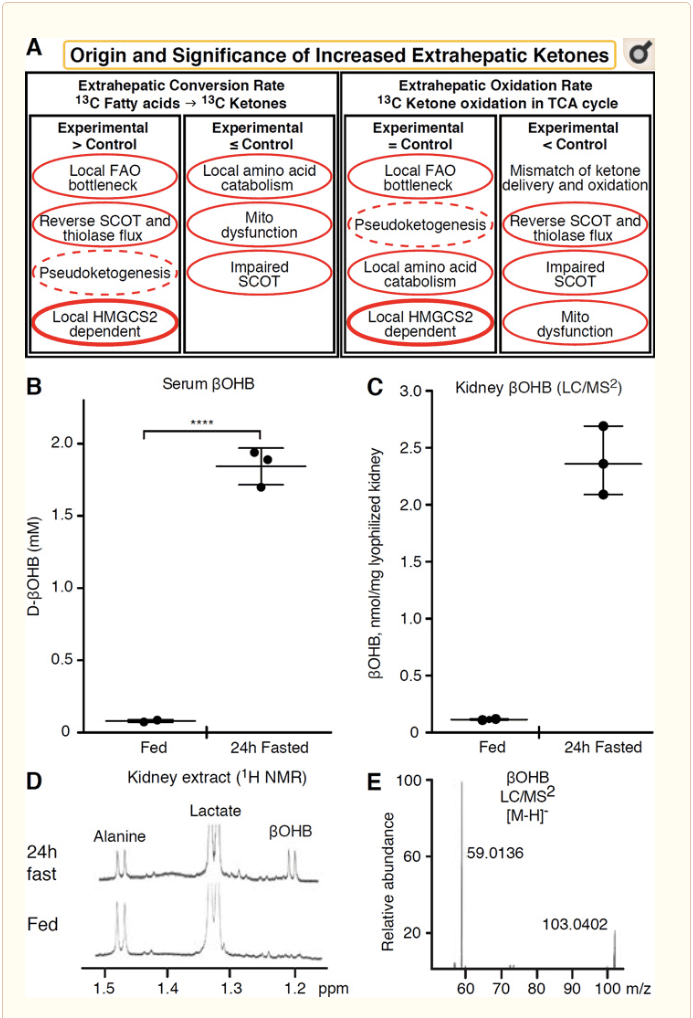

recently کلیه اخیراً به عنوان یک اندام بالقوه کتوژنیک مورد توجه قرار گرفته است. در اکثریت قریب به اتفاق ایالت ها ، کلیه یک مصرف کننده خالص از اجسام کتون مشتق شده از کبد است ، که بدن کتون را از جریان خون دفع یا جذب می کند و کلیه به طور کلی مولد یا متمرکز کننده بدن کتون خالص نیست (رابینسون و ویلیامسون ، 1980). نویسندگان یک مطالعه کلاسیک نتیجه گرفتند که حداقل کتوژنیز کلیوی که در یک سیستم آزمایشی مصنوعی کمی شده است ، از نظر فیزیولوژیکی مربوط نیست (ویدمان و کربس ، 1969). اخیراً ، کتوژنز کلیه در مدلهای موش مبتلا به کمبود دیابت و اتوفاژی استنباط شده است ، اما به احتمال زیاد تغییرات چند عضوی در هموستاز متابولیکی ، متابولیسم کتون یکپارچه را از طریق ورودی به اندامهای مختلف تغییر می دهد (Takagi و همکاران ، 2016a ؛ Takagi و همکاران ، 2016b ؛ ژانگ و همکاران ، 2011). یکی از انتشارات اخیر ، کتوژنز کلیه را به عنوان مکانیسم محافظتی در برابر آسیب ایسکمی جریان خون مجدد در کلیه پیشنهاد کرده است (تران و همکاران ، 2016). غلظت مطلق حالت پایدار OHHB از عصاره های بافت کلیوی موش در 4 12 میلی متر reported گزارش شد. برای آزمایش اینکه آیا این قابل قبول بود ، ما غلظت OHB را در عصاره های کلیه از موش های تغذیه شده و 24 ساعته روزانه تعیین کردیم. غلظت های OHB سرم با fast 100 ساعت ناشتا از ~ 2 M به 24 میلی مولار افزایش یافت (شکل 2B) ، در حالی که غلظت های OHB حالت پایدار کلیه 100 M در حالت تغذیه تقریبی و فقط 1 میلی متر در حالت روزه 24 ساعته است (شکل). 2C E) ، مشاهدات سازگار با غلظتهایی که بیش از 45 سال پیش تعیین شده است (همز و بروسنان ، 1970). این احتمال وجود دارد که در حالت های کتوتیک ، اجسام کتون مشتق از کبد بتوانند از محافظت مجدد محافظت کنند ، اما شواهد مربوط به کتوژنز کلیه نیاز به اثبات بیشتر دارد. شواهد قانع کننده ای که از کتوژنز خارج کبدی واقعی پشتیبانی می کند در RPE ارائه شده است (Adijanto و همکاران ، 2014). این تحول متابولیکی جذاب پیشنهاد شده است که به طور بالقوه اجازه می دهد کتونهای مشتق از RPE به سلولهای گیرنده نوری یا مولر گلیا منتقل شوند ، که می تواند به بازسازی بخش خارجی گیرنده نوری کمک کند.
OHB به عنوان یک واسطه سیگنالینگ
اگرچه آنها از نظر انرژی غنی هستند ، اجسام کتونی نقش هشدار دهنده "غیر متعارف" را در هموستاز سلولی دارند (شکل 3) (نیومن و وردین ، 2014 ؛ روجاس-مورالس و همکاران ، 2016). به عنوان مثال ،؟ OHB کلاس های HDAC را مهار می کند ، که استیلاسیون هیستون را افزایش می دهد و در نتیجه باعث بیان ژن هایی می شود که استرس اکسیداتیو را کاهش می دهند (Shimazu et al.، 2013). ؟ OHB خود یک اصلاح کننده کووالانسی هیستون در باقیمانده های لیزین در کبد موش های دیابتی ناشتا یا استرپتوزوتوسین است (Xie و همکاران ، 2016) (همچنین به زیر مراجعه کنید ، ادغام متابولیسم بدن کتون ، اصلاح پس از ترجمه و فیزیولوژی سلول و اجسام کتون ، استرس اکسیداتیو و محافظت در برابر نورون).
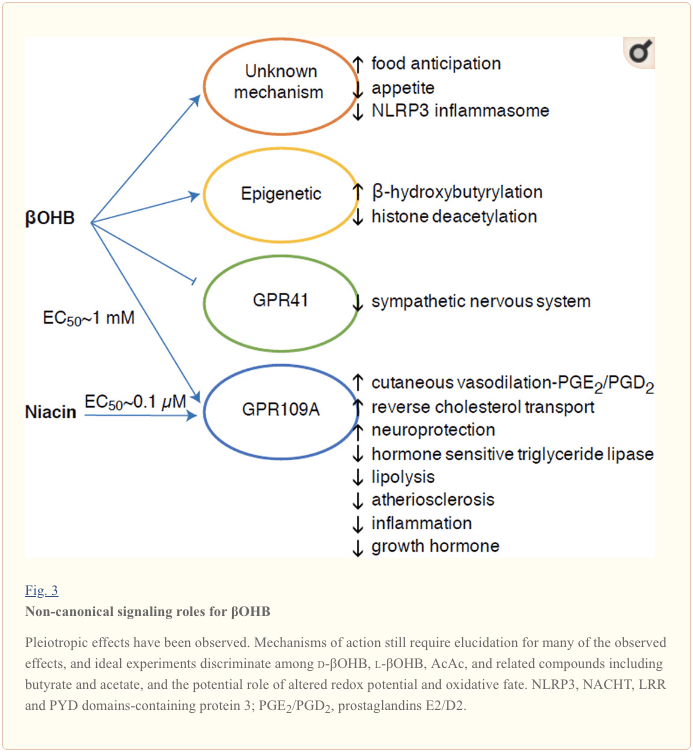
؟ OHB همچنین از طریق گیرنده های همراه پروتئین G تأثیرگذار است. از طریق مکانیسم های نامشخص مولکولی ، فعالیت سیستم عصبی سمپاتیک را سرکوب می کند و با مهار سیگنالینگ اسیدهای چرب زنجیره کوتاه از طریق گیرنده 41 پروتئین G (GPR41) ، کل انرژی و ضربان قلب را کاهش می دهد (کیمورا و همکاران ، 2011). یکی از مهمترین اثرات سیگنالینگ؟ OHB از طریق GPR109A (همچنین به عنوان HCAR2 شناخته می شود) ، عضوی از خانواده فرعی هیدروکربوکسیلیک اسید GPCR که در بافتهای چربی (سفید و قهوه ای) بیان می شود ، حاصل می شود (تونارو و دیگران ، 2003) و در سلولهای ایمنی (احمد و همکاران ، 2009). ؟ OHB تنها لیگاند درون زا گیرنده GPR109A شناخته شده است (EC50 ~ 770 M) که توسط d-؟ OHB ، l-؟ OHB و بوتیرات فعال می شود ، اما AcAc نیست (Taggart و همکاران ، 2005). آستانه غلظت بالا برای فعال سازی GPR109A از طریق پیروی از رژیم کتوژنیک ، گرسنگی یا در طی کتواسیدوز به دست می آید ، که منجر به مهار لیپولیز بافت چربی می شود. اثر ضد لیپولیتیک GPR109A از طریق مهار آدنیلیل سیکلاز و کاهش اردوگاه ، مهار تری گلیسیرید لیپاز حساس به هورمون پیش می رود (احمد و همکاران ، 2009 ؛ تونارو و دیگران ، 2003). این یک حلقه بازخورد منفی ایجاد می کند که در آن کتوز با کاهش ترشح اسیدهای چرب غیراستری شده از سلولهای چربی ، ترمز تعدیلی را روی کتوژنز ایجاد می کند (احمد و همکاران ، 2009 ؛ تاگگارت و همکاران ، 2005) ، تاثیری که می تواند با آن تعادل داشته باشد محرک دلسوزانه که لیپولیز را تحریک می کند. نیاسین (ویتامین B3 ، اسید نیکوتینیک) یک لیگاند قوی (EC50 ~ 0.1 M) برای GRP109A است ، که به طور م forثر برای دهه ها برای اختلالات چربی استفاده می شود (بنیو و همکاران ، 2005 ؛ بنیو و همکاران ، 2006 ؛ Fabbrini و همکاران ، 2010a ؛ لوکاسووا و دیگران ، 2011 ؛ تونارو و دیگران ، 2003). در حالی که نیاسین انتقال کلسترول معکوس را در ماکروفاژها افزایش می دهد و ضایعات آترواسکلروتیک را کاهش می دهد (Lukasova et al.، 2011) ، اثرات OHH بر ضایعات آترواسکلروتیک ناشناخته باقی مانده است. اگرچه گیرنده GPR109A نقش محافظتی دارد و ارتباطات جذاب بین استفاده از رژیم کتوژنیک در سکته مغزی و بیماری های نورودژنراتیو وجود دارد (Fu et al.، 2015؛ Rahman et al.، 2014) ، نقش محافظتی از؟ OHB از طریق GPR109A در داخل بدن اثبات نشده است .
سرانجام ، OHB ممکن است اشتها و سیری را تحت تأثیر قرار دهد. متاآنالیز مطالعاتی که اثرات رژیم های کتوژنیک و بسیار کم انرژی را اندازه گیری می کند به این نتیجه رسیده است که شرکت کنندگان در این رژیم ها نسبت به رژیم های شاهد سیری بیشتری نشان می دهند (گیبسون و همکاران ، 2015). با این حال ، یک توضیح قابل قبول برای این اثر عناصر اضافی متابولیکی یا هورمونی است که ممکن است اشتها را تعدیل کند. به عنوان مثال ، موشهایی که تحت رژیم کتوژنیک جوندگان قرار داشتند ، با وجود دریافت کالری مشابه ، افزایش انرژی را در مقایسه با موشهای کنترل شده چو افزایش دادند و لپتین در گردش خون یا ژنهای پپتیدهای تنظیم کننده رفتار تغذیه ای تغییر نکردند (کندی و همکاران ، 2007). در میان مکانیسم های پیشنهادی که نشان می دهد سرکوب اشتها توسط؟ OHB شامل سیگنالینگ و اکسیداسیون است (Laeger et al.، 2010). حذف اختصاصی هپاتوسیت از ژن ریتم شبانه روزی (Per2) و مطالعات ایمن سازی کروماتین نشان داد که PER2 به طور مستقیم ژن Cpt1a را فعال می کند و به طور غیر مستقیم Hmgcs2 را تنظیم می کند و منجر به اختلال در کتوز در موش های حذفی Per2 می شود (Chavan و همکاران ، 2016). این موش ها پیش بینی غذایی مختل شده ای را نشان دادند که تا حدی با استفاده از سیستم سیستمیک OHH ترمیم شد. برای تأیید سیستم عصبی مرکزی به عنوان هدف مستقیم OHB ، و اینکه آیا اکسیداسیون کتون برای اثرات مشاهده شده مورد نیاز است یا اینکه مکانیسم سیگنالینگ دیگری درگیر است ، به مطالعات آینده نیاز است. محققان دیگر احتمال کتوژنز محلی مشتق شده از آستروسیت را در هیپوتالاموس ونترومدیال به عنوان تنظیم کننده دریافت غذا استناد کرده اند ، اما این مشاهدات اولیه نیز از ارزیابی های ژنتیکی و شار بهره مند می شوند (Le Foll و همکاران ، 2014). رابطه بین کتوز و محرومیت از عناصر غذایی همچنان مورد توجه است زیرا گرسنگی و سیری عناصر مهم در تلاشهای ناموفق کاهش وزن هستند.
ادغام متابولیسم بدن کتون، اصلاح Post-translational و فیزیولوژی سلولی
بدن کتون ها به استخرهای کم عمق استیل کوا کمک می کند که یک میان وعده کلیدی است که نقش کلیدی در متابولیسم سلولی را ایفا می کند (Pietrocola et al.، 2015). یکی از نقش استیل کولا، آن است که به عنوان یک سوبسترای برای استیل کردن، یک اصلاح کوانتومی هیستون با کاتالیزوری آنزیمی کاتالیز شود (Choudhary et al.، 2014؛ Dutta et al.، 2016؛ Fan et al.، 2015؛ Menzies et al.، 2016 ) تعداد زیادی از پروتئین های میتوکندری که به صورت پویا آتیلیتی شده اند و بسیاری از آنها ممکن است از طریق مکانیسم های غیر آنزیمی رخ دهد نیز از مطالعات پروتئومیک محاسباتی (Dittenhafer-Reed و همکاران، 2015، Hebert و همکاران، 2013، Rardin و همکاران، 2013 ؛ Shimazu و همکاران، 2010). Lysine deacetylases از کافاکر روی (به عنوان مثال، HDAC های نوکلئوسیتوزول) و یا NAD + به عنوان یک سوبسترا استفاده می کنند (sirtuins، SIRTs) (Choudhary و همکاران، 2014؛ Menzies و همکاران، 2016). استیل پروتئوم به عنوان سنسور و اثر بخشی از کل استیل کولا سلولی عمل می کند، به نحوی که دستکاری های ژنتیکی و فیزیولوژیکی هر کدام منجر به تغییرات جهانی آنزیمی استیلینگ می شود (Weinert et al.، 2014). از آنجایی که متابولیتهای داخل سلولی به عنوان مدولاتورهای استیلایزر باقی مانده لیزین عمل می کنند، مهم است که نقش کتون ها، که فراوانی بسیار پویا هستند، مورد توجه قرار گیرد.
؟ OHB یک اصلاح کننده اپی ژنتیک است که حداقل از طریق دو مکانیزم انجام می شود. افزایش؟ سطح OHB ناشی از روزه داری ، محدودیت کالری ، تجویز مستقیم یا ورزش طولانی مدت باعث مهار HDAC یا فعال سازی استیل ترانسفراز هیستون می شود (ماروسی و همکاران ، 2016 ؛ سلیمان و همکاران ، 2016) یا به استرس اکسیداتیو (Shimazu و همکاران ، 2013) . مهار OHB از HDAC3 می تواند فیزیولوژی متابولیک نوزاد را تنظیم کند (Rando و همکاران ، 2016). به طور مستقل ،؟ OHB خود مستقیماً بقایای هیستون لیزین را اصلاح می کند (زی و دیگران ، 2016). روزه داری طولانی مدت یا کتواسیدوز دیابتی ناشی از استپتوزوتوسین باعث افزایش بتا-هیدروکسی بوتیریلاسیون هیستون می شود. اگرچه تعداد سایت های بتا-هیدروکسی بوتیریلاسیون و استیلاسیون لیزین قابل مقایسه بود ، اما از لحاظ استوکیومتری هیستون؟ -هیدروکسی بوتیریلاسیون بیشتر از استیلاسیون مشاهده شد. ژنهای متمایز تحت تأثیر آلفا-هیدروکسی بوتیریلاسیون هیستون لیزین ، در مقابل استیلاسیون یا متیلاسیون تحت تأثیر قرار گرفتند ، که عملکردهای سلولی متمایز را نشان می دهد. آیا هیدروکسی بوتیریلاسیون خود به خود است یا آنزیمی مشخص نیست ، اما دامنه مکانیسم ها را از طریق اجسام کتون به طور پویا رونویسی را تحت تأثیر قرار می دهد.
حوادث برنامه ریزی مجدد سلول ضروری در طول محدودیت کالری و محرومیت از مواد مغذی ممکن است در ازدیسیلاسیون میتوکندری و desuccinylation وابسته به SIRT3 و SIRT5 ، به ترتیب ، تنظیم پروتئین های کتوژنیک و کتولیتیک در سطح پس از ترجمه در بافت های کبدی و خارج کبدی (Dittenhafer-Reed و همکاران ، 2015 ؛ هبرت و همکاران ، 2013 ؛ راردین و همکاران ، 2013 ؛ شیمازو و همکاران ، 2010). حتی اگر مقایسه استوکیومتری مکانهای اشغال شده لزوماً مستقیماً به تغییر در شار متابولیکی ارتباط نداشته باشد ، استیلاسیون میتوکندری پویا است و ممکن است به جای استیل ترانسفرازهای آنزیمی توسط غلظت استیل-CoA یا pH میتوکندری هدایت شود (واگنر و پین ، 2013). اینکه SIRT3 و SIRT5 فعالیتهای آنزیمهای متابولیسم بدن کتون را تعدیل می کنند ، این س questionال را نشان می دهد که نقش متقابل کتونها در مجسمه سازی استیل پروتئین ، سوکسینیل پروتئین و سایر اهداف سلولی پویا چیست. در واقع ، همانطور که تغییرات کتوژنز منعکس کننده غلظت NAD + است ، تولید کتون و فراوانی آن می تواند فعالیت سیرتین را تنظیم کند ، در نتیجه بر استخرهای کل استیل-CoA / succinyl-CoA ، آسیل پروتئین و در نتیجه فیزیولوژی میتوکندری و سلول تأثیر می گذارد. ؟ -هیدروکسی بوتیریلاسیون باقیمانده آنزیم لیزین می تواند لایه دیگری به برنامه ریزی مجدد سلول اضافه کند. در بافتهای خارج کبدی ، اکسیداسیون بدن کتون ممکن است تغییرات مشابه در هموستاز سلول را تحریک کند. در حالی که محفظه استخرهای استیل-CoA بسیار تنظیم شده و طیف گسترده ای از تغییرات سلولی را هماهنگ می کند ، توانایی اجسام کتون در شکل دادن مستقیم غلظت استیل-CoA میتوکندری و سیتوپلاسمی به توضیح نیاز دارد (چن و همکاران ، 2012 ؛ Corbet و همکاران ، 2016 ؛ پوگوکوینا و دیگران ، 2014 ؛ شوور و همکاران ، 2009 ؛ ولن و تامپسون ، 2012). از آنجا که غلظت استیل-CoA به شدت تنظیم می شود ، و استیل-CoA غشا و فرآیندهای غشایی نفوذ ناپذیر است ، در نظر گرفتن مکانیسم های محرک هماهنگی هموستاز استیل-CoA از جمله میزان تولید و اکسیداسیون ترمینال در چرخه TCA ، تبدیل به اجسام کتون ، میتوکندری بسیار مهم است. پساب از طریق کارنیتین استیل ترانسفراز (CrAT) یا صادرات استیل-CoA به سیتوزول پس از تبدیل به سیترات و انتشار توسط ATP سیترات لیاز (ACLY). نقشهای اصلی این مکانیزمهای اخیر در استیل پروتئین سلول و هموستاز نیاز به درک منطقی نقش کتوژنز و اکسیداسیون کتون دارد (Das et al.، 2015؛ McDonnell et al.، 2016؛ Moussaieff et al.، 2015؛ Overmyer et al.) 2015 ؛ Seiler و همکاران ، 2014 ؛ Seiler و همکاران ، 2015 ؛ Wellen و همکاران ، 2009 ؛ Wellen و Thompson ، 2012). برای تعیین اهداف و نتایج ، به فن آوری های همگرا در متابولومیک و آسیلپروتئومیک در تنظیم مدل های دستکاری شده ژنتیکی نیاز خواهد بود.
پاسخ های ضد و ضد التهابی به بدن کتون
کتوز و اجسام کتون التهاب و عملکرد سلولهای ایمنی را تعدیل می کنند ، اما مکانیسم های متنوع و حتی متناقضی ارائه شده است. کمبود طولانی مدت مواد مغذی باعث کاهش التهاب می شود (یوم و همکاران ، 2015) ، اما کتوز مزمن دیابت نوع 1 یک حالت پیش التهابی است (Jain et al.، 2002؛ Kanikarla-Marie and Jain، 2015؛ Kurepa et al.، 2012 ) نقش های سیگنالینگ مبتنی بر مکانیسم برای؟ OHB در التهاب ظاهر می شود زیرا بسیاری از سلول های سیستم ایمنی بدن ، از جمله ماکروفاژها یا مونوسیت ها ، به طور فراوان GPR109A را بیان می کنند. در حالی که؟ OHB عمدتا یک واکنش ضد التهابی اعمال می کند (Fu و همکاران ، 2014 ؛ Gambhir و همکاران ، 2012 ؛ رحمان و همکاران ، 2014 ؛ Youm و همکاران ، 2015) ، غلظت های بالای بدن کتون ، به ویژه AcAc ، ممکن است پاسخ پیش التهابی را ایجاد کنید (Jain et al.، 2002؛ Kanikarla-Marie and Jain، 2015؛ Kurepa et al.، 2012).
نقش ضد التهابی لیگاندهای GPR109A در تصلب شرایین ، چاقی ، بیماری التهابی روده ، بیماری عصبی و سرطان بررسی شده است (Graff و همکاران ، 2016). بیان GPR109A در سلولهای RPE مدلهای دیابتی ، بیماران دیابتی انسان (Gambhir و همکاران ، 2012) و در میکروگلیا در طی تخریب سلولهای عصبی افزایش می یابد (Fu و همکاران ، 2014). اثرات ضد التهابی؟ OHB با بیان بیش از حد GPR109A در سلولهای RPE افزایش یافته و با مهار دارویی یا حذفی ژنتیکی GPR109A لغو می شود (گامبیر و همکاران ، 2012). ؟ OHB و اسید نیکوتینیک برون زا (Taggart و همکاران ، 2005) ، هر دو اثرات ضد التهابی در TNF ایجاد می کنند؟ یا التهاب ناشی از LPS با کاهش سطح پروتئین های پیش التهاب (iNOS ، COX-2) یا سیتوکین های ترشحی (TNF ؟، IL-1 ؟، IL-6، CCL2 / MCP-1) ، تا حدی از طریق مهار NF - انتقال B (Fu و همکاران ، 2014 ؛ گامبیر و همکاران ، 2012). ؟ OHB استرس ER و التهاب NLRP3 را کاهش می دهد و پاسخ استرس آنتی اکسیدانی را فعال می کند (Bae et al.، 2016؛ Youm et al.، 2015). با این حال ، در التهاب نورودژنراتیو ، محافظت با واسطه وابسته به GPR109A شامل واسطه های التهابی مانند سیگنالینگ مسیر MAPK (به عنوان مثال ، ERK ، JNK ، p38) نیست (Fu et al.، 2014) ، اما ممکن است به PGD1 وابسته به COX-2 نیاز داشته باشد تولید (رحمان و همکاران ، 2014). جالب است که ماکروفاژ GPR109A برای اعمال اثر محافظت عصبی در مدل سکته مغزی ایسکمیک مورد نیاز است (رحمان و همکاران ، 2014) ، اما توانایی؟ OHB برای مهار التهاب NLRP3 در ماکروفاژهای مشتق از مغز استخوان مستقل از GPR109A است (Youm و همکاران . ، 2015). اگرچه بیشتر مطالعات ، OHB را به اثرات ضد التهابی مرتبط می دانند ، اما OHB ممکن است پیش التهاب باشد و مارکرهای پراکسیداسیون لیپید را در سلولهای کبدی گوساله افزایش دهد (Shi et al.، 2014). اثرات ضد- در مقابل التهابی؟ OHB ممکن است به نوع سلول ، غلظت؟ OHB ، مدت قرار گرفتن در معرض ، و وجود یا عدم تعدیل کننده های مشترک بستگی داشته باشد.
بر خلاف؟ OHB ، AcAc ممکن است سیگنالینگ پیش التهابی را فعال کند. افزایش AcAc ، به ویژه با غلظت گلوکز بالا ، آسیب سلول های اندوتلیال را از طریق مکانیسم NADPH اکسیداز / استرس اکسیداتیو تشدید می کند (Kanikarla-Marie و Jain ، 2015). غلظت بالای AcAc در بند ناف مادران دیابتی با میزان اکسیداسیون پروتئین بالاتر و غلظت MCP-1 ارتباط داشت (Kurepa و همکاران ، 2012). AcAc بالا در بیماران دیابتی با TNF ارتباط داشت؟ بیان (Jain و همکاران ، 2002) ، و AcAc ، اما نه؟ OHB ، بیان TNF؟ ، MCP-1 ، تجمع ROS ، و سطح اردوگاه در سلولهای مونوسیت انسانی U937 کاهش می یابد (Jain و همکاران ، 2002 ؛ Kurepa و همکاران . ، 2012).
پدیده های سیگنالینگ وابسته به بدن کتون غالباً فقط با غلظت بالای بدن کتون (> 5 میلی متر) و در مورد بسیاری از مطالعات که کتون ها را به اثرات پیش التهابی یا ضد التهابی مرتبط می کند ، از طریق مکانیسم های نامشخص تحریک می شوند. علاوه بر این ، با توجه به اثرات متناقض؟ OHB در مقابل AcAc بر التهاب ، و توانایی نسبت AcAc /؟ OHB در تأثیر پتانسیل اکسایش میتوکندری ، بهترین آزمایش ارزیابی نقش اجسام کتون بر فنوتیپ های سلولی مقایسه اثرات AcAc و؟ OHB در نسبت های مختلف و در غلظت های مختلف تجمعی [به عنوان مثال ، (Saito et al.، 2016)]. سرانجام ، AcAc را می توان از طریق تجاری فقط به عنوان نمک لیتیوم یا به عنوان یک استر اتیل که قبل از استفاده به هیدرولیز پایه نیاز دارد ، خریداری کرد. کاتیون لیتیوم به طور مستقل باعث ایجاد آبشارهای انتقال سیگنال می شود (مانجی و همکاران ، 1995) و آنیون AcAc ناپایدار است. سرانجام ، مطالعات با استفاده از d / l-؟ OHB نژادی می تواند اشتباه گرفته شود ، زیرا فقط استریوایزومر d-؟ OHB می تواند به AcAc اکسید شود ، اما d-؟ OHB و l-؟ OHB می تواند هر یک از طریق GPR109A سیگنال داده ، التهاب NLRP3 را مهار کند ، و به عنوان بسترهای لیپوژنیک خدمت می کنند.
بدن کتون، استرس اکسیداتیو، و محافظت از عصبی
استرس اکسیداتیو معمولاً به عنوان حالتی تعریف می شود که ROS به دلیل تولید بیش از حد و / یا از بین بردن اختلال ، بیش از حد ارائه شود. نقش های کاهش دهنده استرس آنتی اکسیدانی و اکسیداتیو اجسام کتون به طور گسترده ای هم در شرایط in vitro و هم در داخل بدن ، خصوصاً در زمینه محافظت از نور ، توصیف شده است. از آنجا که اکثر سلولهای عصبی فسفاتهای پر انرژی از اسیدهای چرب به طور مثر تولید نمی کنند ، اما در صورت کمبود کربوهیدرات ها ، بدن کتون را اکسید می کنند ، اثرات محافظت از نور در بدن کتون به ویژه مهم است (Cahill GF Jr، 2006؛ Edmond et al.، 1987؛ Yang) و دیگران ، 1987). در مدل های استرس اکسیداتیو ، القای BDH1 و سرکوب SCOT نشان می دهد که متابولیسم بدن کتون می تواند برای حفظ سیگنالینگ سلول های متنوع ، پتانسیل اکسایش اکسیداسیون یا نیازهای متابولیکی ، دوباره برنامه ریزی شود (Nagao et al.، 2016؛ Tieu et al.، 2003).
اجسام کتون باعث کاهش درجه آسیب سلولی ، آسیب ، مرگ و کاهش آپوپتوز در سلولهای عصبی و قلب می شوند (Haces et al.، 2008؛ Maalouf et al.، 2007؛ Nagao et al.، 2016؛ Tieu et al.، 2003). مکانیسم های فراخوانی شده متنوع هستند و همیشه به طور خطی با غلظت ارتباط ندارند. غلظت میلی مولار پایین (d یا l) -؟ OHB ROS ROS (آنیون هیدروکسیل) ، در حالی که AcAc گونه های مختلف ROS را از بین می برد ، اما فقط در غلظت هایی که بیش از حد فیزیولوژیکی باشد (IC50 20-67 میلی متر) (Haces و همکاران ، 2008) . برعکس ، یک نفوذ مفید بر پتانسیل اکسایش اکسیداسیون زنجیره انتقال الکترون مکانیزمی است که معمولاً با d-؟ OHB مرتبط است. در حالی که هر سه بدن کتون (d / l-؟ OHB و AcAc) باعث کاهش مرگ سلول های عصبی و تجمع ROS ناشی از مهار شیمیایی گلیکولیز می شوند ، فقط d-؟ OHB و AcAc مانع از کاهش ATP عصبی می شوند. برعکس ، در یک مدل کاهش قند خون در داخل بدن ، (d یا l) -؟ OHB ، اما AcAc از پراکسیداسیون لیپید هیپوکامپ جلوگیری نمی کند (Haces et al.، 2008؛ Maalouf et al.، 2007؛ Marosi et al.، 2016؛ Murphy، 2009 ؛ Tieu و همکاران ، 2003). مطالعات in vivo بر روی موش هایی که از رژیم کتوژنیک تغذیه می کردند (87٪ کیلو کالری چربی و 13٪ پروتئین) ، تغییرات عصبی آناتومیکی ظرفیت آنتی اکسیدانی را نشان دادند (زیگلر و همکاران ، 2003) ، که بیشترین تغییرات عمیق در هیپوکامپ مشاهده شد ، با افزایش گلوتاتیون پراکسیداز و کل ظرفیت آنتی اکسیدان
رژیم کتوژنیک ، استرهای کتونی (همچنین به استفاده درمانی از رژیم کتوژنیک و اجسام کتون برونزا مراجعه کنید) ، یا دولت OHB از محافظت عصبی در مدل های سکته مغزی ایسکمیک استفاده می کند (رحمان و همکاران ، 2014). بیماری پارکینسون (Tieu و همکاران ، 2003) ؛ سیستم عصبی مرکزی تشنج سمیت اکسیژن (D'Agostino و همکاران ، 2013) ؛ اسپاسم صرع (یوم و همکاران ، 2015) ؛ انسفالومیوپاتی میتوکندریایی ، اسیدوز لاکتیک و سندرم اپیزودهای مشابه سکته مغزی (MELAS) (فری و همکاران ، 2016) و بیماری آلزایمر (Cunnane و Crawford ، 2003 ؛ یین و همکاران ، 2016). برعکس ، یک گزارش اخیر شواهد هیستوپاتولوژیک از پیشرفت نورودژنراتیو توسط یک رژیم کتوژنیک را در یک مدل موش تراریخته از ترمیم DNA غیر طبیعی میتوکندری ، با وجود افزایش در بیوژنز میتوکندری و امضای آنتی اکسیدان نشان داده است (Lauritzen و همکاران ، 2016). گزارش های متناقض دیگر حاکی از آن است که قرار گرفتن در معرض غلظت بالای بدن کتون باعث ایجاد استرس اکسیداتیو می شود. دوزهای بالا؟ OHB یا AcAc باعث ترشح اکسید نیتریک ، پراکسیداسیون لیپید ، کاهش بیان SOD ، گلوتاتیون پراکسیداز و کاتالاز در سلولهای کبدی گوساله می شود ، در حالی که در سلولهای کبدی موش صحرایی القای مسیر MAPK به AcAc نسبت داده می شود اما نه؟ OHB (Abdelmegeed و همکاران ، 2004) ؛ Shi و همکاران ، 2014 ؛ Shi و همکاران ، 2016).
روی هم رفته ، اکثر گزارشات ، OHH را به کاهش استرس اکسیداتیو مرتبط می کنند ، زیرا تجویز آن از تولید ROS / سوپراکسید جلوگیری می کند ، از پراکسیداسیون لیپید و اکسیداسیون پروتئین جلوگیری می کند ، سطح پروتئین آنتی اکسیدان را افزایش می دهد ، و تنفس میتوکندری و تولید ATP را بهبود می بخشد (عبدالمجید و دیگران ، 2004 ؛ Haces et al.، 2008؛ Jain et al.، 1998؛ Jain et al.، 2002؛ Kanikarla-Marie and Jain، 2015؛ Maalouf et al.، 2007؛ Maalouf and Rho، 2008؛ Marosi et al.، 2016؛ Tieu و همکاران ، 2003 ؛ یین و همکاران ، 2016 ؛ زیگلر و همکاران ، 2003). در حالی که AcAc با القای استرس اکسیداتیو ارتباط مستقیم تری نسبت به؟ OHB داشته است ، این تأثیرات همیشه به راحتی از پاسخ های احتمالی پیش التهابی جدا نمی شوند (Jain et al.، 2002؛ Kanikarla-Marie and Jain، 2015؛ Kanikarla-Marie و جین ، 2016). علاوه بر این ، بسیار مهم است که در نظر بگیریم که سود آنتی اکسیدانی آشکار ناشی از جیره های کتوژنیک پلیوتروپیک ممکن است توسط بدن کتون ها منتقل نشود و محافظت از سلول های عصبی توسط اجسام کتون ممکن است به طور کامل ناشی از استرس اکسیداتیو نباشد. به عنوان مثال در طول محرومیت از گلوکز ، در یک مدل از محرومیت از گلوکز در سلول های عصبی قشر مغز ،؟ OHB شار اتوفاژی را تحریک می کند و از تجمع اتوفاگوزوم جلوگیری می کند ، که با کاهش مرگ عصبی همراه است (کامبروس-لونا و همکاران ، 2016). d-؟ OHB همچنین از طریق مهار HDAC باعث ایجاد پروتئین های آنتی اکسیدانی متعارف FOXO3a ، SOD ، MnSOD و کاتالاز می شود (Nagao et al.، 2016؛ Shimazu et al.، 2013).
بیماری کبد چرب غیر الکلی (NAFLD) و متابولیسم بدن کتون
NAFLD مرتبط با چاقی و استئو هپاتیت غیر الکلی (NASH) شایعترین علل بیماری کبدی در کشورهای غربی هستند (Rinella and Sanyal، 2016) و نارسایی کبدی ناشی از NASH یکی از دلایل عمده پیوند کبد است. در حالی که ذخیره بیش از حد تری اسیل گلیسرولها در سلولهای کبدی> 5٪ از وزن کبد (NAFL) به تنهایی باعث عملکرد تخریب کبد نمی شود ، پیشرفت در NAFLD در انسان با مقاومت به انسولین سیستمیک و افزایش خطر ابتلا به دیابت نوع 2 ارتباط دارد و ممکن است در پاتوژنز بیماری قلبی عروقی و بیماری مزمن کلیه (Fabbrini et al.، 2009؛ Targher et al.، 2010؛ Targher and Byrne، 2013). مکانیسم های بیماری زا NAFLD و NASH کاملاً شناخته نشده اند اما شامل ناهنجاری های متابولیسم کبدی ، اتوفاژی سلولهای کبدی و استرس شبکه آندوپلاسمی ، عملکرد سلولهای ایمنی کبدی ، التهاب بافت چربی و واسطه های التهابی سیستمیک هستند (Fabbrini et al.، 2009؛ Masuoka and Chalasani، 2013 ؛ Targher و همکاران ، 2010 ؛ یانگ و همکاران ، 2010). اغتشاشات کربوهیدرات ، لیپید و متابولیسم اسیدهای آمینه در انسان و در ارگانیسم های مدل ایجاد می شود و به چاقی ، دیابت و NAFLD کمک می کند [بررسی شده در (Farese et al.، 2012؛ Lin and Accili، 2011؛ Newgard، 2012؛ Samuel and شولمن ، 2012 ؛ خورشید و لازار ، 2013)]. در حالی که ناهنجاری های سلولهای کبدی در متابولیسم لیپیدهای سیتوپلاسمی معمولاً در NAFLD مشاهده می شود (Fabbrini et al.، 2010b) ، نقش متابولیسم میتوکندریا ، حاکم بر دفع اکسیداتیو چربی ها ، در پاتوژنز NAFLD کمتر مشخص است. ناهنجاری های متابولیسم میتوکندری در پاتوژنز NAFLD / NASH اتفاق می افتد و به آن کمک می کند (Hyotylainen et al.، 2016؛ Serviddio et al.، 2011؛ Serviddio et al.، 2008؛ Wei et al.، 2008). کلی وجود دارد (Felig و همکاران ، 1974 ؛ Iozzo و همکاران ، 2010 ؛ کولیاکی و همکاران ، 2015 ؛ Satapati و همکاران ، 2015 ؛ Satapati و همکاران ، 2012 ؛ Sunny و همکاران ، 2011) اما یکنواخت نیست ( کولیاکی و رودن ، 2013 ؛ پری و همکاران ، 2016 ؛ رکتور و همکاران ، 2010) اتفاق نظر داشتند که ، قبل از توسعه NASH با ایمان ، اکسیداسیون میتوکندری کبدی ، و به ویژه اکسیداسیون چربی ، در چاقی ، مقاومت انسولین سیستمیک افزایش می یابد ، و NAFLD. این احتمال وجود دارد که با پیشرفت NAFLD ، ناهمگنی ظرفیت اکسیداتیو ، حتی در میان میتوکندری های فردی ، ظاهر شود و در نهایت عملکرد اکسیداتیو مختل شود (کولیاکی و همکاران ، 2015 ؛ رکتور و دیگران ، 2010 ؛ Satapati و همکاران ، 2008 ؛ Satapati و همکاران . ، 2012).
کتوژنز اغلب به عنوان پروکسی برای اکسیداسیون چربی کبد استفاده می شود. با پیشرفت NAFLD در مدل های حیوانی و احتمالاً در انسان ، اختلالات کتوژنز ظاهر می شود. از طریق مکانیسم های کاملاً مشخص نشده ، هایپرینسولینمی کتوژنز را سرکوب می کند ، احتمالاً در مقایسه با گروه های کنترل نابارور در هیپوکتونمی نقش دارد (Bergman et al.، 2007؛ Bickerton et al.، 2008؛ Satapati et al.، 2012؛ Soeters et al.، 2009؛ Sunny et al. ، 2011 ؛ معاون و همکاران ، 2005). با این وجود ، توانایی غلظت بدن کتون در گردش برای پیش بینی NAFLD بحث برانگیز است (M nnist et al.، 2015؛ Sanyal et al.، 2001). روشهای طیف سنجی رزونانس مغناطیسی کمی قوی در مدلهای حیوانی ، میزان گردش کتون با مقاومت متوسط به انسولین را افزایش داد ، اما با مقاومت به انسولین شدید ، میزان کاهش مشهود بود (Satapati et al.، 2012؛ Sunny et al.، 2010). در انسانهای چاق با کبد چرب ، میزان کتوژنیک طبیعی است (Bickerton et al.، 2008؛ Sunny et al.، 2011) ، و از این رو ، میزان کتوژنز نسبت به افزایش بار اسیدهای چرب در سلولهای کبدی کاهش می یابد. در نتیجه ، استیل-CoA مشتق شده از اکسیداسیون ممکن است به اکسیداسیون ترمینال در چرخه TCA ، افزایش اکسیداسیون ترمینال ، گلوکونئوژنز هدایت شده توسط فسفوآنولپیروات از طریق آناپلروز / کاتاپلروز و استرس اکسیداتیو هدایت شود. استیل-CoA همچنین ممکن است تحت عنوان سیترات ، یک بستر پیش ساز برای لیپوژنز ، از میتوکندری صادر شود (شکل 4) (Satapati et al.، 2015؛ Satapati et al.، 2012؛ Solinas et al.، 2015). در حالی که کتوژنز با چاقی طولانی مدت کمتر به انسولین پاسخ می دهد یا ناشتا است (Satapati et al.، 2012) ، مکانیسم های اساسی و عواقب پایین دست این کاملاً شناخته نشده است. شواهد اخیر نشان می دهد که mTORC1 کتوژنز را به روشی که ممکن است در پایین دست سیگنالینگ انسولین باشد سرکوب می کند (Kucejova و همکاران ، 2016) ، که با مشاهداتی که mTORC1 از القای Hmgcs2 با واسطه PPAR جلوگیری می کند همخوانی دارد (Sengupta و همکاران ، 2010) ( همچنین به مقررات HMGCS2 و SCOT / OXCT1 مراجعه کنید).

مشاهدات اولیه از گروه ما پیامدهای نامطلوب کبدی ناشی از نارسایی کتوژنیک را نشان می دهد (Cotter et al.، 2014). برای آزمایش این فرضیه که اختلال کتوژنیز ، حتی در حالت پر از کربوهیدرات و در نتیجه "غیر کتوژنیک" ، به متابولیسم گلوکز غیر طبیعی کمک می کند و استئو کبدی را تحریک می کند ، ما با استفاده از اولیگونوکلئوتیدهای ضد عفونی (ASO) با استفاده از یک الگونوکلئوتید ضد عفونی کننده ، یک مدل موش را تولید کردیم. Hmgcs2 از دست دادن HMGCS2 در موشهای بزرگسال استاندارد تغذیه شده با چربی کم باعث افزایش قند خون خفیف و افزایش قابل توجه تولید صدها متابولیت کبدی می شود ، مجموعه ای که به شدت فعال سازی لیپوژنز را پیشنهاد می کند. تغذیه رژیم غذایی با چربی بالا از موش های دارای کتوژنیس کافی منجر به آسیب و التهاب گسترده سلولهای کبدی شد. این یافته ها فرضیه های اصلی را پشتیبانی می کند که (ک) کتوژنز یک مسیر سرریز غیرفعال نیست بلکه یک گره پویا در هموستاز فیزیولوژیکی کبدی و یکپارچه است و (ب) افزایش کتوژنیک محتاطانه برای کاهش NAFLD / NASH و متابولیسم گلوکز کبدی بی نظیر است و قابل بررسی است. .
کتوژنز مختل شده چگونه ممکن است به آسیب کبدی و تغییر هموستاز گلوکز کمک کند؟ اولین بررسی این است که آیا مقصر کمبود شار کتوژنیک است یا خود کتون ها. یک گزارش اخیر نشان می دهد که بدن کتون ممکن است آسیب کبدی ناشی از استرس اکسیداتیو را در پاسخ به اسیدهای چرب اشباع نشده n-3 کاهش دهد (Pawlak et al.، 2015). به یاد بیاورید که به دلیل عدم بیان SCOT در سلولهای کبدی ، اجسام کتون اکسید نمی شوند ، اما می توانند در لیپوژنز نقش داشته باشند ، و نقشهای مختلف سیگنالینگ را مستقل از اکسیداسیون آنها انجام می دهند (همچنین به سرنوشت های متابولیکی غیر اکسیداتیو بدن کتون و؟ OHB مراجعه کنید) یک واسطه سیگنالینگ). همچنین ممکن است اجسام کتونی مشتق شده از سلولهای کبدی به عنوان یک سیگنال و / یا متابولیت برای سلولهای همسایه در آکینوس کبدی ، از جمله سلولهای ستاره ای و ماکروفاژهای سلول کوپفر عمل کنند. در حالی که ادبیات محدود موجود نشان می دهد که ماکروفاژها قادر به اکسیداسیون اجسام کتون نیستند ، این تنها با استفاده از روش های کلاسیک و فقط در ماکروفاژهای صفاقی اندازه گیری شده است (Newsholme et al.، 1986؛ Newsholme et al.، 1987) ، نشان می دهد که یک ارزیابی با توجه به بیان فراوان SCOT در ماکروفاژهای مشتق شده از مغز استخوان مناسب است (یوم و همکاران ، 2015).
شار کتوژنیک هپاتوسیت نیز ممکن است از سلول محافظت کند. گرچه ممکن است مکانیسم های درمانی به خودی خود به کتوژنز وابسته نباشند ، رژیم های غذایی کتوژنیک با کربوهیدرات کم با بهبود NAFLD همراه بوده اند (براونینگ و همکاران ، 2011 ؛ فاستر و همکاران ، 2010 ؛ کانی و همکاران ، 2014 ؛ شوگر و کرافورد ، 2012) . مشاهدات ما نشان می دهد که کتوژنز سلولهای کبدی ممکن است شار چرخه TCA ، شار آناپلروتیک ، گلوکونئوژنز مشتق شده از فسفوآنولپیروات را بازخورد و تنظیم کند (Cotter et al.، 2014) و حتی گردش گلیکوژن. اختلال کتوژنیک استیل-CoA را به سمت افزایش شار TCA هدایت می کند ، که در کبد با افزایش آسیب ناشی از ROS مرتبط است (Satapati et al.، 2015؛ Satapati et al.، 2012). انحراف کربن را به سمت گونه های چربی سنتز شده جدید انجام می دهد که می تواند سمیت سلولی را ثابت کند. و از اکسیداسیون مجدد NADH به NAD + جلوگیری می کند (Cotter و همکاران ، 2014) (شکل 4). روی هم رفته ، آزمایشات بعدی برای حل سازوکارهایی لازم است که از طریق آنها نارسایی کتوژنیک نسبی ممکن است ناسازگار شود ، به افزایش قند خون کمک کند ، استئو هپاتیت را تحریک کند و اینکه آیا این مکانیسم ها در NAFLD / NASH انسان عمل می کنند. همانطور که شواهد اپیدمیولوژیک نشان دهنده اختلال در کتوژنیز در طی پیشرفت استئاتوپاتیت است (Embade et al.، 2016؛ Marinou et al.، 2011؛ M nnist et al.، 2015؛ Pramfalk et al.، 2015؛ Safaei et al.، 2016) درمانهایی که کتوژنز کبدی را افزایش می دهند می توانند مفید باشند (Degirolamo et al.، 2016؛ Honda et al.، 2016).
بدن کتون و نارسایی قلب (HF)
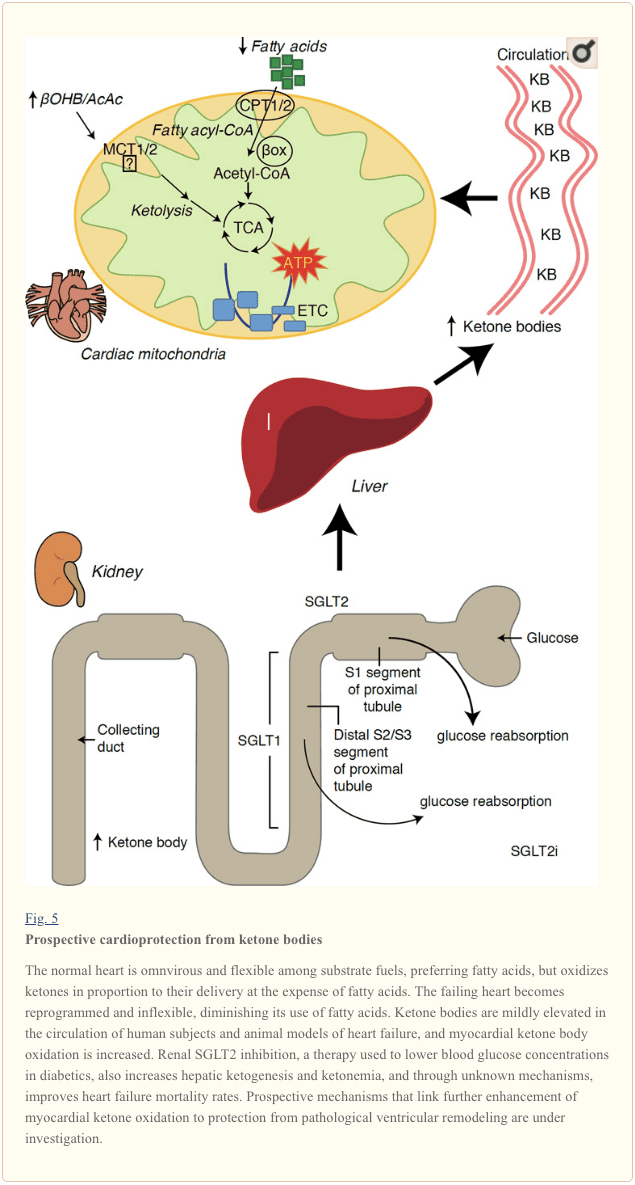
با سرعت متابولیسم بیش از 400 کیلوکالری در کیلوگرم در روز و گردش مالی 6-35 کیلوگرم ATP در روز ، قلب عضوی با بیشترین میزان مصرف انرژی و تقاضای اکسیداتیو است (اشرفیان و همکاران ، 2007 ؛ وانگ و همکاران ، 2010b) اکثریت قریب به اتفاق گردش انرژی میوکارد در میتوکندری ساکن است و 70٪ از این منبع از FAO سرچشمه می گیرد. قلب در شرایط عادی همه چیزخوار و انعطاف پذیر است ، اما بازسازی پاتولوژیک قلب (به عنوان مثال ، به دلیل فشار خون بالا یا سکته قلبی) و قلب دیابتی هر یک از نظر متابولیکی انعطاف پذیر نمی شوند (Balasse and Fery، 1989؛ BING، 1954؛ Fukao et al.، 2004 ؛ Lopaschuk و همکاران ، 2010 ؛ Taegtmeyer و همکاران ، 1980 ؛ Taegtmeyer و همکاران ، 2002 ؛ Young و همکاران ، 2002). در واقع ، ناهنجاری های برنامه ریزی شده ژنتیکی متابولیسم سوخت قلب در مدل های موش باعث تحریک کاردیومیوپاتی می شود (Carley et al.، 2014؛ Neubauer، 2007). در شرایط فیزیولوژیکی ، قلب های طبیعی بدن کتونی را متناسب با زایمان آنها اکسیداسیون می کنند ، این امر به قیمت اسیدهای چرب و اکسیداسیون گلوکز انجام می شود و میوکارد بیشترین مصرف کننده بدن کتون در واحد جرم است (BING، 1954؛ Crawford et al.، 2009؛ GARLAND و همکاران) . ، 1962 ؛ Hasselbaink و همکاران ، 2003 ؛ جفری و همکاران ، 1995 ؛ پلتیر و همکاران ، 2007 ؛ Tardif و همکاران ، 2001 ؛ یان و همکاران ، 2009). در مقایسه با اکسیداسیون اسیدهای چرب ، اجسام کتون از نظر انرژی کارآمدتر هستند و انرژی بیشتری را برای سنتز ATP به ازای هر مولکول اکسیژن سرمایه گذاری شده (نسبت P / O) تولید می کنند (Kashiwaya و همکاران ، 2010 ؛ Sato و همکاران ، 1995 ؛ Veech ، 2004) . اکسیداسیون بدن کتون همچنین به طور بالقوه انرژی بیشتری نسبت به فاو تولید می کند ، و اوبی کوینون را اکسید می کند ، که باعث کاهش دهانه اکسایش اکسیداسیون در زنجیره انتقال الکترون می شود و انرژی بیشتری را برای سنتز ATP فراهم می کند (Sato et al.، 1995؛ Veech، 2004). اکسیداسیون اجسام کتون همچنین ممکن است تولید ROS و در نتیجه استرس اکسیداتیو را کاهش دهد (Veech ، 2004).
مطالعات اولیه مداخله ای و مشاهده ای نشان می دهد که نقش بالقوه ای در بدن کتون در قلب وجود دارد. در زمینه آسیبهای ایسکمی / رپرفیوژن تجربی، اعضای بدن کتون، توانایی بالقوه محافظت در برابر قلبتان را دارند (الزید و همکاران، 2007؛ وانگ و همکاران، 2008)، احتمالا به دلیل افزایش فراوانی میتوكندری در قلب یا تنظیم مقابله با فسفوریلاسیون اكسیداتیک حیاتی واسطه ها (Snorek و همکاران، 2012؛ Zou و همکاران، 2002). مطالعات اخیر نشان می دهد که استفاده از بدن کتون در دل شکستگی موش ها (Aubert و همکاران، 2016) و انسان ها (Bedi et al.، 2016)، از مشاهدات قبلی در انسان پشتیبانی می کند (BING، 1954؛ Fukao et al.، 2000؛ Janardhan و همکاران، 2011، Longo و همکاران، 2004، رودولف و Schinz، 1973، Tildon و Cornblath، 1972). غلظت کتون در گردش خون در بیماران مبتلا به نارسایی قلب افزایش می یابد، به طور مستقیم با فشار پر شدن، مشاهدات که مکانیزم و اهمیت آن هنوز معلوم نیست (Kupari و همکاران، 1995، Lommi و همکاران، 1996، Lommi و همکاران، 1997، Neely و همکاران .، 1972)، اما موش هایی با کمبود SCOT انتخابی در کراتومیوسیت ها، در بهبود واکنش های بطنی پاتولوژیک بطن ها و واکنش های ROS در پاسخ به آسیب های اضطراب تحت فشار جراحی (Schugar و همکاران، 2014) افزایش یافته است.
مشاهدات جالب توجه اخیر در دیابت درمان یک پیوند بالقوه بین متابولیسم کتون های قلب و ساختار مجدد بطنی پاتولوژیک را نشان داد (شکل 5). غلظت 2 (SGLT2i)، پروتئین سولفوریک پروتئین سولفوریک / گلوکز (SGLT2016i) باعث افزایش غلظت کتون بدن در انسان (Ferrannini و همکاران، 2015a، Inagaki و همکاران، 2014) و موش (Suzuki و همکاران، 2014) از طریق افزایش کتوژنز کبدی (Ferrannini و همکاران، 2016، Ferrannini و همکاران، 2015a، Katz و Leiter، 2015، Mudaliar و همکاران، 2016). به طور قابل توجهی، حداقل یکی از این عوامل باعث کاهش زمان بستری شدن HF (به عنوان مثال در آزمایش EMPA-REG) و بهبود مرگ و میر قلبی عروقی (Fitchett و همکاران، 2016؛ Sonesson و همکاران، 2016؛ Wu و همکاران، 2015a ؛ Zinman و همکاران، 2). در حالی که مکانیسم های راننده پس از نتایج سودمند HF برای اتصال SGLT2016i به طور فعال مورد بحث قرار می گیرد، مزایای زنده ماندن احتمالا چند فاکتوریل است، در آینده شامل کتوز، اما همچنین اثرات سالم بر وزن، فشار خون، گلوکز و اسید اوریک، سختی شریان، سیستم عصبی سمپاتیک، اسمزی دیورتیک / کاهش حجم پلاسما و افزایش هماتوکریت (راز و کان، 2016، والون و تامسون، 2016). در کنار هم، مفهوم افزایش کتونمی درمانی در بیماران HF یا افرادی که در معرض خطر ابتلا به HF قرار دارند، همچنان بحث برانگیز است، اما تحت تحقیق فعال در مطالعات پیش از بالینی و بالینی قرار دارد (Ferrannini et al.، 2016b؛ Kolwicz et al. 2016؛ Lopaschuk و Verma؛ 2016؛ Mudaliar و همکاران، 2016؛ Taegtmeyer، XNUMX).
بدن کتون در زیست شناسی سرطان
ارتباط بین بدن کتون و سرطان به سرعت در حال ظهور است، اما مطالعه در هر دو مدل حیوانی و انسان نتیجه های متنوعی به دست آورده است. از آنجایی که متابولیسم کتون پویا و حالت مغذی پاسخگو است، لذت بردن از پیوند زیستی با سرطان به دلیل پتانسیل درمان های تغذیه با هدایت دقیق است. سلول های سرطانی تحت برنامه ریزی متابولیکی برای حفظ سریع تکثیر و رشد سلولی (DeNicola و Cantley، 2015، Pavlova و Thompson، 2016) قرار می گیرند. اثر Warburg کلاسیک در متابولیسم سلول های سرطانی ناشی از نقش غالب گلوکز و تخمیر اسید لاکتیک برای انتقال انرژی و جبران وابستگی کمتر به فسفوریلاسیون اکسیداتیو و تنفس میتوکندری محدود است (De Feyter et al.، 2016؛ Grabacka et al.، 2016؛ Kang و همکاران، 2015؛ پوف و همکاران، 2014؛ Shukla و همکاران، 2014). کربن گلوکز عمدتا از طریق گلیکولیز، مسیر پنتوز فسفات و لیپوژنز هدایت می شود که به طور همزمان واسنجی لازم برای گسترش زیست توده تومور را فراهم می کند (Grabacka و همکاران، 2016، Shukla و همکاران، 2014، Yoshii و همکاران، 2015). انطباق سلول های سرطانی با محرومیت گلوکز از طریق توانایی استفاده از منابع جایگزین سوخت، از جمله استات، گلوتامین و آسپارتات می باشد (Jaworski et al.، 2016؛ Sullivan et al.، 2015). برای مثال، دسترسی محدود به پریووت نشان دهنده توانایی سلول های سرطانی برای تبدیل گلوتامین به استیل کولا بوسیله کربوکسیلینگ، حفظ نیازهای انرژی و آنابولیک است (یانگ و همکاران، 2014). سازگاری جالب از سلول های سرطانی، استفاده از استات به عنوان یک سوخت است (Comerford و همکاران، 2014، Jaworski و همکاران، 2016، Mashimo و همکاران، 2014، رایت و سیمون، 2016، Yoshii و همکاران، 2015). استات نیز یک بستر برای لیپوژنز است که برای تکثیر سلول های تومور حیاتی است و افزایش این کانال لیپوژنیک با بقای کوتاه مدت بیمار و افزایش تومور بیشتر مرتبط است (Comerford و همکاران، 2014، Mashimo و همکاران، 2014، Yoshii et al .، 2015).
سلولهای غیرسرطانی در طی محرومیت از گلوکز ، به راحتی منبع انرژی خود را از گلوکز به بدن کتون تغییر می دهند. این انعطاف پذیری ممکن است در میان انواع سلولهای سرطانی متغیر باشد ، اما در داخل بدن تومورهای مغز کاشته شده اکسید شده [2,4،13-2C2016] -؟ OHB تا حدی مانند بافت اطراف مغز (De Feyter et al.، 2010). اثر معکوس اثر واربورگ یا دو متابولیسم تومور محفظه ای این فرضیه را ایجاد می کند که سلول های سرطانی باعث تولید OHH در فیبروبلاست های مجاور می شوند و نیازهای انرژی سلول تومور را تأمین می کنند (بونوچلی و دیگران ، 2012 ؛ مارتینز-اوتسچورن و همکاران ، 1) . در کبد ، تغییر سلولهای کبدی از کتوژنز به اکسیداسیون کتون در سلولهای سرطان سلولهای کبدی (هپاتوم) با فعال سازی فعالیتهای BDH1989 و SCOT مشاهده شده در دو رده سلول هپاتوم سازگار است (ژانگ و همکاران ، 1). در واقع ، سلولهای کبدی OXCT1 و BDH2016 را بیان می کنند و کتونها را اکسید می کنند ، اما فقط در صورت گرسنگی سرم (هوانگ و همکاران ، 2). از طرف دیگر ، کتوژنز سلول توموری نیز پیشنهاد شده است. جابجایی های دینامیکی در بیان ژن کتوژنیک در طی تغییر شکل سرطانی اپیتلیوم روده بزرگ ، یک نوع سلول که به طور معمول HMGCS2 را بیان می کند ، به نمایش گذاشته می شود و گزارش اخیر نشان می دهد که HMGCS2006 ممکن است یک نشانگر پیش آگهی پیش آگهی ضعیف در سرطان سلول های روده بزرگ و سنگفرشی باشد (Camarero و همکاران ، 2016 ؛ چن و همکاران ، 2). اینکه آیا این ارتباط به کتوژنز نیاز دارد یا شامل آن می شود ، یا عملکرد مهتابی HMGCS2016 را مشخص می کند. برعکس ، تولید OHB توسط سلولهای ملانوم و گلیوبلاستوما ، تحریک شده توسط PPAR؟ آگونیست fenofibrate ، با توقف رشد همراه بود (Grabacka و همکاران ، 2). برای مشخص کردن نقش بیان HMGCSXNUMX / SCOT ، کتوژنز و اکسیداسیون کتون در سلولهای سرطانی ، مطالعات بیشتری لازم است.
فراتر از حوزه متابولیسم سوخت ، اخیراً کتونها از طریق مکانیزم سیگنالینگ در زیست سلولهای سرطانی نقش دارند. تجزیه و تحلیل ملانومای BRAF-V600E + نشان داد که القای HMGCL وابسته به OCT1 به روشی وابسته به BRAF سرطان زا است (کانگ و همکاران ، 2015). افزایش HMGCL با غلظت بالاتر سلولی AcAc در ارتباط بود ، که به نوبه خود تعامل BRAFV600E-MEK1 را افزایش می دهد ، با تقویت سیگنالینگ MEK-ERK در یک حلقه خوراکی که باعث تکثیر و رشد سلول های توموری می شود. این مشاهدات سوال جالب توجهی از کتوژنیز خارج کبدی احتمالی را ایجاد می کند که سپس از یک مکانیسم سیگنالینگ پشتیبانی می کند (همچنین به OHB به عنوان یک واسطه سیگنالینگ و اختلافات در کتوژنز خارج کبدی مراجعه کنید). همچنین مهم است که اثرات مستقل AcAc ، d-؟ OHB و l-؟ OHB بر متابولیسم سرطان در نظر گرفته شود ، و هنگام بررسی HMGCL ، کاتابولیسم لوسین نیز ممکن است از بین برود.
اثرات رژیم های کتوژنیک (همچنین به درمان درمانی رژیم کتوژنیک و اجسام کتون برونزا مراجعه کنید) در مدل های حیوانی سرطانی متنوع است (De Feyter et al.، 2016؛ Klement et al.، 2016؛ Meidenbauer et al.، 2015؛ Poff et al. . ، 2014 ؛ سیفرید و همکاران ، 2011 ؛ شوکلا و همکاران ، 2014). در حالی که ارتباطات اپیدمیولوژیک بین چاقی ، سرطان و رژیم های کتوژنیک مورد بحث است (Liskiewicz و همکاران ، 2016 ؛ رایت و سیمون ، 2016) ، یک متاآنالیز با استفاده از رژیم های کتوژنیک در مدل های حیوانی و در مطالعات انسانی تأثیر سلامتی بر بقا را نشان داد ، با مزایای آینده نگر به بزرگی کتوز ، زمان شروع رژیم غذایی و محل تومور مرتبط است (کلمنت و همکاران ، 2016 ؛ وولف و همکاران ، 2016). درمان سلولهای سرطانی پانکراس با اجسام کتون (d-؟ OHB یا AcAc) رشد ، تکثیر و گلیکولیز و رژیم کتوژنیک (81٪ کیلو کالری چربی ، 18٪ پروتئین ، 1٪ کربوهیدرات) را کاهش می دهد ، از نظر وزن بدن تومور ، گلیسمی و افزایش عضله و وزن بدن در حیوانات مبتلا به سرطان کاشته شده (شوکلا و همکاران ، 2014). نتایج مشابهی با استفاده از مدل سلول گلیوبلاستوما متاستاتیک در موشهایی که مکمل کتون در رژیم غذایی دریافت کردند مشاهده شد (پوف و همکاران ، 2014). برعکس ، یک رژیم کتوژنیک (91٪ کیلو کالری چربی ، 9٪ پروتئین) باعث افزایش غلظت OHB در گردش خون و کاهش گلیسمی می شود ، اما هیچ تأثیری بر حجم تومور یا مدت زنده ماندن در موشهای صحرایی وجود ندارد (De Feyter و همکاران ، 2016). یک شاخص گلوکز کتون به عنوان یک شاخص بالینی ارائه شده است که باعث بهبود مدیریت متابولیسم درمان سرطان مغز ناشی از رژیم کتوژنیک در انسان و موش می شود (Meidenbauer et al.، 2015). روی هم رفته ، نقش متابولیسم بدن کتون و اجسام کتونی در زیست شناسی سرطان دلهره آور است زیرا هر یک از آنها گزینه های درمانی قابل حل است ، اما جنبه های اساسی باید توضیح داده شوند ، با تأثیرات واضح از ماتریس متغیرها ، از جمله (من) تفاوت بین کتون برون زا بدن در مقابل رژیم کتوژنیک ، (ii) نوع سلول سرطانی ، چندشکلی ژنومی ، درجه و مرحله ؛ و (III) زمان و مدت زمان قرار گرفتن در معرض حالت کتوتیک.

کتوژنیزاسیون بوسیله تجزیه اسیدهای چرب و اسیدهای آمینه اتیلن توسط اجزای کتون ایجاد می شود. این فرایند بیوشیمی انرژی را به ارگان های مختلف، به ویژه مغز، در شرایط ناشتا به عنوان پاسخ به عدم دسترسی به قند خون، انرژی می دهد. بدن کتون ها عمدتا در میتوکندری سلول های کبدی تولید می شود. در حالی که سلول های دیگر قادر به انجام کتونی هستند، در سلول های کبدی کارایی ندارند. از آنجا که کتوژنز در میتوکندری اتفاق می افتد، فرآیندهای آن به طور مستقل تنظیم می شود. دکتر الکس جیمنز DC، CCST Insight
کاربرد درمانی رژیم کتونی و بدن کتون خارجی
کاربردهای رژیم های کتوژنیک و اجسام کتون به عنوان ابزار درمانی در زمینه های غیر سرطانی از جمله چاقی و NAFLD / NASH نیز به وجود آمده است (براونینگ و همکاران ، 2011 ؛ فاستر و همکاران ، 2010 ؛ شوگر و کرافورد ، 2012). نارسایی قلبی (Huynh، 2016؛ Kolwicz et al.، 2016؛ Taegtmeyer، 2016) ؛ بیماری عصبی و تخریب عصبی (مارتین و همکاران ، 2016 ؛ مک نالی و هارتمن ، 2012 ؛ رو ، 2015 ؛ روگاوسکی و همکاران ، 2016 ؛ یانگ و چنگ ، 2010 ؛ یائو و همکاران ، 2011) ؛ خطاهای ذاتی متابولیسم (Scholl-B rgi و همکاران ، 2015) ؛ و عملکرد ورزشی (کاکس و همکاران ، 2016). اثر رژیم های کتوژنیک به ویژه در درمان تشنج صرع ، به ویژه در بیماران مقاوم به دارو ، قدردانی شده است. اکثر مطالعات رژیم های کتوژنیک را در بیماران کودکان ارزیابی کرده اند و نشان می دهد که تا 50 reduction کاهش فراوانی تشنج پس از 3 ماه ، با بهبود اثر در سندرم های انتخاب شده (Wu et al.، 2016b). این تجربه در صرع بزرگسالان محدودتر است ، اما کاهش مشابه آن ، با پاسخ بهتر در بیماران مبتلا به صرع عمومی علامت دار ، مشهود است (نی و همکاران ، 2014). مکانیسم های ضد تشنج زمینه ای نامشخص است ، اگرچه فرضیه های فرضی شامل کاهش استفاده از گلوکز / گلیکولیز ، حمل و نقل مجدد برنامه ریزی شده گلوتامات ، تأثیر غیرمستقیم بر کانال پتاسیم حساس به ATP یا گیرنده آدنوزین A1 ، تغییر بیان ایزوفرم کانال سدیم یا تأثیر بر هورمون های در گردش از جمله لپتین ( Lambrechts et al.، 2016؛ Lin et al.، 2017؛ Lutas and Yellen، 2013). هنوز مشخص نیست که آیا اثر ضد تشنج عمدتاً به بدن کتون نسبت داده می شود یا به دلیل عواقب متابولیکی آبشارهای رژیم های کم کربوهیدرات است. با این حال ، به نظر می رسد استرهای کتون (در زیر را ببینید) آستانه تشنج را در مدل های حیوانی تشنج های تحریک شده بالا می برند (سیارلون و همکاران ، 2016 ؛ داگوستینو و همکاران ، 2013 ؛ ویگیانو و همکاران ، 2015).
رژیم های کم کربوهیدرات سبک اتکینز و کتوژنیک اغلب غیرمعمول هستند و می توانند باعث یبوست، هیپوریکمی، هیپوکلسمی، هیپومنیزمی، منجر به نفروتیلاسیون، کتواسیدوز، ایجاد هیپرگلیسمی و افزایش کلسترول تجمع یافته و غلظت اسید چرب آزاد شوند (Bisschop et al.، 2001 ؛ Kossoff و Hartman، 2012؛ Kwiterovich و همکاران، 2003؛ Suzuki و همکاران، 2002). به همین علت پیوستگی درازمدت چالش هایی را ایجاد می کند. مطالعات جوندگان معمولا از توزیع مغذی متمایز استفاده می کنند (94٪ کیلوگرم چربی، 1٪ کربوهیدرات کیلوکالری، پروتئین KNK 5 پروتئین، Bio-Serv F3666)، که باعث کتوز قوی می شود. با این حال، افزایش محتوای پروتئین، حتی به 10٪ kcal به طور قابل ملاحظه ای کتوز را کاهش می دهد، و محدودیت پروتئین KKAL 5 اثرات متابولیکی و فیزیولوژیکی را مخدوش می کند. این فرمول رژیم غذایی نیز کولین تخلیه شده است، یکی دیگر از متغیرهایی است که حساسیت به آسیب های کبدی و حتی کتوژنز را تحت تاثیر قرار می دهد (Garbow و همکاران، 2011، جورنایواز و همکاران، 2010، کندی و همکاران، 2007، Pissios و همکاران، 2013، Schugar و غیره، 2013). اثرات مصرف طولانی مدت رژیم های کتوژنیک در موش هنوز به طور کامل تعریف نشده است، اما مطالعات اخیر در موش ها نشان می دهد که بقای طبیعی و عدم نشانگر آسیب کبدی در موش ها در طول رژیم های غذایی کتوژنیک، هرچند متابولیسم آمینو اسید، هزینه انرژی و سیگنالینگ انسولین به طور قابل توجهی دوباره برنامه ریزی شده بودند (Douris et al.، 2015).
مکانیسم های افزایش کتوز از طریق مکانیسم های جایگزین برای رژیم های کتوژنیک شامل استفاده از پیش سازهای کتون در دسترس می باشد. اعمال بدن کتون خارجی ممکن است یک حالت فیزیولوژیک منحصر به فرد ایجاد کند که در فیزیولوژی طبیعی مواجه نشود زیرا غلظت گلوکز و غلظت انسولین نسبتا نرمال است، در حالی که سلول ها ممکن است جذب و مصرف گلوکز را از بین ببرند. بدن کتون ها نیمه عمر کوتاهی دارند و بلع یا تزریق نمک سدیم؟ OHB برای دستیابی به کتوز درمانی باعث تحریک بار سدیم ناخوشایند می شود. R / S-1,3،1992-butanediol یک الکل غیر سمی است که به راحتی در کبد اکسید می شود و باعث تولید d / l-؟ OHB می شود (Desrochers et al.، XNUMX). در زمینه های تجربی مجزا ، این دوز به مدت هفت هفته به طور روزانه بر روی موش یا موش تجویز می شود و در طی 5 ساعت پس از تجویز غلظت های OHB تا 2 میلی مولار در گردش است که حداقل برای 3 ساعت اضافی (D ') پایدار است. آگوستینو و دیگران ، 2013). سرکوب بخشی از مصرف غذا در جوندگان دیده شده است که به R / S-1,3-Butanediol (Carpenter and Grossman، 1983) داده شده است. علاوه بر این ، سه استر کتون متمایز از نظر شیمیایی (KE) ، (من) مونوستر R-1,3،3-بوتاندیول و d-؟ OHB (R-1,3-هیدروکسی بوتیل R-؟ OHB). (ii) گلیسیریل-تریس-؟ OHB ؛ و (iii) R ، S-1997،2012-butanediol acetoacetate diester نیز به طور گسترده مورد مطالعه قرار گرفته است (Brunengraber، 2012؛ Clarke et al.، 1995a؛ Clarke et al.، 1995b؛ Desrochers et al.، 2010a؛ Desrochers et al. . ، XNUMXb ؛ Kashiwaya و همکاران ، XNUMX). یک مزیت ذاتی مورد اول این است که به دنبال هیدرولیز استراز در روده یا کبد ، 2 مول d-OHHB فیزیولوژیکی در هر مول KE تولید می شود. ایمنی ، فارماکوکینتیک و تحمل به طور گسترده در انسانهایی که R-3-hydroxybutyl R-؟ OHB مصرف می کنند ، در دوزهای حداکثر 714 میلی گرم در کیلوگرم ، و غلظت های d-؟ OHB در گردش را تا 6 میلی متر ارائه می دهد (کلارک و همکاران ، 2012a ؛ کوکس و همکاران ، 2016 ؛ کمپر و همکاران ، 2015 ؛ شیووا و همکاران ، 2016). در جوندگان، این KE کاهش مصرف کالری و کلسترول کلسترول را افزایش می دهد، بافت چربی قهوه ای را تحریک می کند و مقاومت به انسولین را بهبود می بخشد (Kashiwaya et al.، 2010؛ Kemper et al.، 2015؛ Veech، 2013). یافته های اخیر نشان می دهد که در حین ورزش در ورزشکاران آموزش دیده ، بلع R-3-hydroxybutyl R-؟ OHB باعث کاهش گلیکولیز عضله اسکلتی و غلظت لاکتات پلاسما ، افزایش اکسیداسیون تری اسیل گلیسرول عضلانی و حفظ محتوای گلیکوژن عضله ، حتی در هنگام مصرف همزمان کربوهیدرات ترشح انسولین () کاکس و همکاران ، 2016). توسعه بیشتر این نتایج جالبی لازم است، زیرا بهبود عملکرد استقامتی عمدتا توسط پاسخ قوی به KE در افراد 2 / 8 هدایت می شود. با این وجود، این نتایج از مطالعات کلاسیک حمایت می کند که نشان دهنده اولویت اکسیداسیون کتون بر روی دیگر مواد (GARLAND و همکاران، 1962، Hasselbaink و همکاران، 2003، Stanley و همکاران، 2003، Valente-Silva و همکاران، 2015) از جمله در حین ورزش، و این که ورزشکاران آموزش دیده ممکن است برای استفاده از کتون ها به کار گرفته شوند (جانسون و همکاران، 1969a، جانسون و والنتن، 1972، Winder و همکاران، 1974، Winder و همکاران، 1975). در نهایت، مکانیسم هایی که ممکن است عملکرد ورزشی بهبود یافته را با در نظر گرفتن کالری یکسانی (که به صورت توزیع بین مواد مغذی توزیع شده است) و میزان مصرف اکسیژن مساوی باقی بماند، هنوز تعیین می شود.
چشم انداز آینده
مشاهدات اخیر که به عنوان یک مسیر سرریز که قادر به جمع آوری انتشار سمی از احتراق چربی در کشورهای محدود شده با کربوهیدرات است ، انگ زده می شود ، این مفهوم را پشتیبانی می کند که متابولیسم بدن کتون حتی در حالت های پر از کربوهیدرات نیز نقش های نجات دهنده ایفا می کند ، فرضیه در حالی که رویکردهای تغذیه ای و دارویی آسان برای دستکاری متابولیسم کتون ، آن را به یک هدف درمانی جذاب تبدیل می کند ، اما آزمایشات محتاطانه ای در هر دو آزمایشگاه تحقیق اولیه و ترجمه باقی مانده است. نیازهای برآورده نشده در زمینه های تعیین نقش استفاده از متابولیسم کتون در نارسایی قلبی ، چاقی ، NAFLD / NASH ، دیابت نوع 2 و سرطان ظاهر شده است. دامنه و تأثیر نقشهای "غیر متعارف" سیگنالینگ اجسام کتون ، از جمله تنظیم PTM ها که احتمالاً به مسیرهای متابولیکی و سیگنالینگ تغذیه می شوند و به جلو هدایت می شوند ، به کاوش عمیق تری نیاز دارند. سرانجام ، کتوژنز خارج کبدی می تواند مکانیسم های سیگنالینگ پاراکرین و اتوکرین جذاب و فرصت هایی را برای تأثیر بر متابولیسم در سیستم عصبی و تومورها برای دستیابی به اهداف درمانی باز کند.
تشکر و قدردانی
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
پانویسها و منابع
در نتیجه ، بدن کتون توسط کبد ایجاد می شود تا وقتی که گلوکز کافی در بدن انسان موجود نیست ، به عنوان منبع انرژی استفاده شود. کتوژنز زمانی اتفاق می افتد که سطح گلوکز در خون کم باشد ، به ویژه پس از اتمام سایر ذخایر کربوهیدرات سلولی. هدف مقاله بالا بحث در مورد نقشهای چند بعدی بدن کتون در متابولیسم سوخت ، سیگنالینگ و درمانها بود. دامنه اطلاعات ما محدود به مسائل مربوط به بهداشت عمل جراحی و نخاع است. برای بحث در مورد موضوع ، لطفاً از دکتر جیمنز سوال کنید یا با ما تماس بگیرید915-850-0900.
دکتر الکس جیمنز سرپرستی می کند
ارجاع شده از:Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

بحث در مورد مبحث اضافی: درد کمر حاد
درد پشتاین یکی از مهمترین دلایل معلولیت و روزهای از دست رفته در کار در سراسر جهان است. کمردرد دومین دلیل شایع مراجعه به مطب توسط پزشکان است که بیشتر از عفونت های دستگاه تنفسی فوقانی است. تقریباً 80 درصد مردم حداقل یک بار در طول زندگی خود درد کمر را تجربه خواهند کرد. ستون فقرات یک ساختار پیچیده است که از استخوان ها ، مفاصل ، رباط ها و ماهیچه ها در میان سایر بافت های نرم تشکیل شده است. آسیب ها و / یا شرایط وخیم ، ماننددیسک های فتق دیسک، می تواند در نهایت به علائم کمردرد منجر شود. آسیب های ورزشی یا صدمات ناشی از تصادفات اتومبیل اغلب شایعترین علت کمر درد است ، با این حال ، گاهی اوقات ساده ترین حرکات می تواند نتایج دردناکی داشته باشد. خوشبختانه ، گزینه های درمانی جایگزین مانند مراقبت های کایروپراکتیک ، می توانند با استفاده از تنظیمات ستون فقرات و دستکاری های دستی ، درد کمر را کاهش دهند و در نهایت تسکین درد را بهبود بخشند.

EXTRA EXTRA | موضوع مهم: توصیه شده El Paso، TX Chiropractor
***
اطلاعات اینجا در "نقش چند بعدی بدنهای کتون"در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من