سولفورفان یک فیتوشیمیایی است که درون گروه ایزوتوسیانات از ترکیبات ارگنسی سولفات موجود در سبزیجات cruciferous مانند بروکلی، کلم، گل کلم و گلدان بروکسل یافت می شود. همچنین می توان در کیک بوک، کلم، کلث، سبز خردل و کاکائو پیدا کرد. مطالعات انجام شده نشان داده است که سولفورفان می تواند به جلوگیری از انواع مختلف سرطان کمک کند فعال سازی تولید Nrf2، یا فاکتور هسته ای مربوط به اریتروئید 2 ، یک فاکتور رونویسی است که مکانیسم های آنتی اکسیدانی محافظ را تنظیم می کند که پاسخ سلول به اکسیدان ها را کنترل می کند. هدف مقاله زیر توصیف عملکرد سولفورافان است.
فهرست
چکیده
سیستم آنتی اکسیدانی KEAP1-Nrf2-ARE یک وسیله اصلی است که سلول ها به تنش های اکسیداتیو و زانوبیوتیک پاسخ می دهند. سولفورفان (SFN)، یک ایزوتوسیانات الکتروفیل مشتق شده از سبزیجات cruciferous، مسیر KEAP1-Nrf2-ARE را فعال می کند و در درمان بیماری هایی که استرس اکسیداتیو مزمن نقش اصلی ایتیولوژیک ایفا می کند، تبدیل به یک مولکول شده است. ما در اینجا نشان می دهیم که میتوکندری سلول های اپیتلیال رنگدانه شبکیه (RPE-1) که تحت درمان با SFN کشت می شوند، تحت فشار زیاد قرار می گیرند که مستقل از هر دو مهارکننده Nrf2 و KEAP1 مهار کننده سیتوپلاسمی آن است. در طی آپوپتوز، با ایجاد مهار تولید ذرات در میتوکندری گزارش شده است که فیوژن میتوکندری به عنوان سیتوپروتئینی محسوب می شود و به این ترتیب، مستقل از سیتوپروتئین سفتی سلول های تحت درمان با SFN نشان می دهد که تحت تاثیر آپوپتوزیس-استوروسورپین قرار دارند. به طور مکانیکی، SFN جذب و یا حفظ فاکتور شکنندگی محلول Drp2 را به میتوکندریها و پراکسیوم ها کاهش می دهد اما بر میزان فراوانی Drp1 تاثیر نمی گذارد. این داده ها نشان می دهد که خواص سودمند SFN فراتر از فعال شدن سیستم KEAP1-Nrf1-ARE می باشد و بازجویی های بیشتری را اعطا می کند با توجه به استفاده فعلی از این عامل در چندین آزمایش بالینی.
کلید واژه ها: سولفورفان، Nrf2، Drp1، میتوکندریا، شکافت، فیوژن، آپوپتوز
معرفی
سولفورفان یک مهار کننده مستقل Nrf2 از شکافت هسته ای است
سولفورفان (SFN) یک ترکیب ایزوتیوسیانات است که در رژیم غذایی بیشتر از سبزیجات cruciferous [56] یافت می شود. این در گیاهان به عنوان یک واکنش زبو بیوتیک به شکارچیان از طریق انتشار vesicular آنزیم هیدرولیز myrosinase از سلول های آسیب دیده تولید می شود؛ این آنزیم گلوکوزینولات را به ایزوتایوسیانت [42] تبدیل می کند. در طول دو دهه گذشته، SFN به طور گسترده ای برای خواص ضد سرطان، آنتی اکسیدان و ضد میکروبی گزارش شده است [57]. بیشتر این اثربخشی به ظرفیت SFN مربوط است تا مسیر سیگنالینگ KEAP1-Nrf2-antioxidant element (ARE) را تعدیل کند، اگر چه فعالیت های اضافی این ترکیب شناسایی شده است، از جمله مهار فعالیت هیستون داستیلاز و پیشرفت چرخه سلولی [ 29] Nrf2 عامل فاکتور رونویسی آنتی اکسیدان است و در شرایط هوموتازیست، پایداری آن از طریق عمل مجدد Cylin3KEAP1 ubiquitin ligase [20] سیتوپلاسمی سکته می کند. به طور خاص، Nrf2 به ليگاز Cullin3KEAP1 با اتصال به آداپتور Substrate دايرهيک KEAP1 استخدام مي شود و سپس با زنجيرهاي polyUb اصلاح مي شود که فاکتور رونويسي را براي تخليه مداخله پروتئازوم هدف قرار مي دهند. این توافق قانونی نیمه عمر "Nrf2" را در سلول های غیر قابل تحمل محدود می کند به ~ 15 دقیقه [30]، [33]، [46]، [55]. KEAP1، یک پروتئین غنی از پروتئین، به عنوان یک سنسور بازآفرینی عمل می کند و تغییرات اکسیداتیو سیتین های بحرانی، به ویژه C151، از KEAP1 دیس فیتی Nrf2-KEAP1 از CUL3 و از این طریق مانع از تجزیه Nif2 می شود [ 8]، [20]، [55]. به طور قابل ملاحظه ای، SFN، و احتمالا دیگر activators Nrf2، تقلید از استرس اکسیداتیو را با تغییر C151 از KEAP1 مانند [21]. تثبیت Nrf2 اجازه می دهد تا انتقال آن به هسته ای که آن را بیان یک باتری از ژن های آنتی اکسیدان فاز II و سم زدایی است. Nrf2 به عناصر پروتئینی واکنش آنتی اکسیدان (ARE) از ژن های هدف شناخته شده آن متصل می شود، از طریق heterodimerization با پروتئین های کوچک Maf [19]. این سیستم یک پاسخ پویا و حساس به آنتی اکسیدان های غیر مستقیم مانند SFN، رادیکال های آزاد تولید شده توسط میتوکندری [16] یا سایر منابع فیزیولوژیک استرس اکسیداتیو [41] را ارائه می دهد.
میتوکندریا اندامهای پویا و سلولی هستند که تعدادی از توابع سلولی را که از تولید ATP و بافر کلسیم داخل سلولی تا تنظیم مجدد و آپوپتوز [13]، [49] تنظیم می شود. میتوکندریا منبع اصلی گونه های اکسیژن واکنشی (ROS) را درون سلول نشان می دهد. بنابراین تنظیم مناسب از عملکرد میتوکندری ها برای بهینه سازی تولید ATP برای پاسخگویی به نیازهای سلولی ضروری است، در حالی که همزمان به حداقل رساندن اثرات بالقوه مضر تولید رادیکال های آزاد بیش از حد است. یک نیاز حیاتی برای مدولاسیون خوبی از عملکرد میتوکندری، ظرفیت میتوکندری است که به طور مستقل به عنوان دستگاه های بیوشیمیایی عمل می کند و به عنوان بخشی از یک شبکه گسترده و واکنش پذیر است.
مورفولوژی و عملکرد شبکه های میتوکندری توسط تعادل تنظیم شده بین تقسیم و همجوشی تعیین می شود. تقسیم میتوکندری برای ارث بری سلول های دختر میتوکندری در حین تقسیم سلولی [28] و همچنین برای تخریب اتفاجی انتخابی میتوکندری دپولاریزه یا آسیب دیده، نامیده می شود [1]. در مقابل، همجوشی برای تکمیل ژنوم های میتوکندری و به اشتراک گذاری اجزای زنجیره ای انتقال الکترون بین میتوكندری های همسایه [54] ضروری است. در سطح مولکولی، تقسیم و همجوشی میتوکندری توسط GTPases بزرگ مانند دینام تنظیم می شود. سه آنزیم تنظیم کننده فیوژن هستند: Mitofusins 1 و 2 (Mfn1 / 2) پروتئین غشایی بیرونی دو طرفه هستند که متمایز شدن غشای بیرونی با همکاری های heterotypic میان میتوکندری های مجاور [15]، [25]، [37] است، در حالی که OPA1 یک درون پروتئین غشایی که به طور همزمان باعث تطبیق ماتریکس می شود با تنظیم مبرد غشاء درونی [5]. فعالیت GTPase از هر سه پروتئین برای فیوژن قوی [5]، [18] و OPA1 بیشتر توسط پروتئولیز پیچیده در غشای داخلی میتوکندری توسط پروتئازهای OMA1 [14]، PARL [6] و YME1L [45 ] مهم این است که پتانسیل غشایی میتوکندری بدون در نظر گرفتن همجوشی کارآمد برای جلوگیری از ادغام میتوکندری آسیب دیده و سالمی [26] مورد نیاز است.
تقسیم میتوکندری عمدتا توسط یک پروتئین سیتوزول به نام پروتئین 1 وابسته به دینین (Drp1 / DNM1L) کاتالیز می شود. Drp1 از سیتوزول به مکان های آینده نابودی تقسیم شده در غشای بیرونی میتوکندری [43] استخدام می شود. گیرنده های اصلی Drp1 در غشای خارجی فاکتور تقسیم میتوکندری (MF) [32] و، به میزان کم، Fission 1 (Fis1) [51] می باشد. علاوه بر این، یک گیرنده کادویی، MIEF1 / MiD51 کشف شد که فعالیت بیشتری را برای پروتئین Drp1 در مناطق شکافت پالسی [58] محدود می کند. هنگامی که در غشای بیرونی میتوکندری قرار می گیرد، Drp1 oligomerizes به ساختار مارپیچی در اطراف بدن از میتوکندریون و سپس با استفاده از انرژی حاصل از هیدرولیز GTP برای میانجیاد زیست فیزیکی غشاهای بیرونی و داخلی میتوکندری [17]. لوله های مشتق شده از رتیکولوم اندوپلاسمی به عنوان یک تداخل اولیه از میتوکندری قبل از الگومیزاسيون Drp1 عمل می کنند، که نشان می دهد که میتوکندری های غیرمتعارف گسترده تر از محدوده مجاز یک مارپیچ Drp1 [12] است. دینامیک آتیین نیز برای تعاملات میتوکندری ER که قبل از تقسیم میتوکندری [24] مهم است. Drp1 علاوه بر نقش آن در تقسیم میتوکندری، تقسیم پراکسسیوم ها [40] را تجزیه می کند.
Drp1 بسیار شبیه به پروتئین دینامانی شناخته شده است که در هر دو پروتئین حاوی دامنه GTPase N-terminal است، دامنه میانی که برای خود الگومریزیزه حیاتی است و دامنه GFTase [31] C-terminal G-terminal است. Drp1 انتخابی برای غشاهای میتوکندری را از طریق ترکیبی از تعاملات با پروتئین گیرنده Mff و Fis1 و همچنین از طریق وابستگی آن به قلب یولپین فسفولیپید خاص با میتوکندری از طریق حوزه ی منحصر به فرد B-Drp1 [2]، به دست می دهد. Drp1 معمولا به عنوان یک هوموتوترامر در سیتوپلاسم وجود دارد، و مونتاژ بالاتر در مکان های تقسیم میتوکندری توسط قلمرو مرکزی Drp1 [3] متصل می شود.
با توجه به ارتباط ضمنی بین عملکرد میتوکندری و مسیر KEAP1-Nrf2-ARE، اثرات فعال سازی Nrf2 بر ساختار و عملکرد میتوکندری بررسی شد. ما در اینجا نشان می دهیم که SFN موجب افزایش فشار خون میتوکندری می شود که به طور غیر منتظره مستقل از هر دو Nrf2 و KEAP1 است. این اثر SFN از طریق مهار عملکرد Drp1 است. ما بیشتر نشان می دهیم که SFN مقاومت در برابر آپوپتوز را به وجود می آورد که مستقل از Nrf2 است و تقلید آن در سلول هایی که از Drp1 دیده می شوند، مشاهده می شود. این داده ها به طور کلی نشان می دهد که علاوه بر پاکسازی و فعال کردن Nrf2، SFN مولکولی پویایی میتوکندری را حفظ می کند و حفظ تناسب و بقاء سلولی را حفظ می کند.
نتایج
سولفورفان موجب بروز Hyperfusion مستقل از Mitohondria و Nrf2 / KEAP1 می شود.
در طی مطالعه تأثیرات فعال سازی Nrf2 بر پویایی شبکه میتوکندری ، متوجه شدیم که درمان سلول های اپیتلیال رنگدانه شبکیه چشم انسان (RPE-1) جاودانه با سولفورافان (SFN) ، یک فعال کننده قوی سیگنالینگ Nrf2 ، باعث همجوشی قوی شبکه میتوکندری وقتی با سلولهای کنترل شده با وسیله نقلیه مقایسه شود (شکل 1 A و B). مورفولوژی میتوکندری در این سلول ها تا حد زیادی شبیه میتوکندری در سلولهای تخلیه شده توسط siRNA از Drp1 درون زا ، عامل اصلی شکافت میتوکندری است (شکل 1 A). این نتیجه این ایده جذاب را ایجاد می کند که شکافت میتوکندری و وضعیت همجوشی مستقیماً به سطح Nrf2 در سلول پاسخ می دهد. با این حال ، تحریک سلول ها با سایر تثبیت کننده ها و فعال کننده های Nrf2 مانند مهارکننده پروتئازوم MG132 ، tBHQ پرو اکسیدان یا ناکارد مهارکننده Nrf2 KEAP1 باعث همجوشی میتوکندری (شکل 1 A و B) نمی شود. تثبیت Nrf2 توسط این دستکاری ها توسط وسترن بلات برای Nrf2 درون زا تأیید شد (شکل 1C). علاوه بر این ، بیان Nrf2 برای همجوشی میتوکندری ناشی از SFN قابل توزیع بود ، زیرا شکست Nrf2 درون زا با siRNA برای مقابله با این فنوتیپ شکست خورد (شکل 1D F). از آنجا که SFN با اصلاح کووالانسی باقیمانده های سیستئین KEAP1 [2] مسیر KEAP1-Nrf21-ARE را تحریک می کند ، ما KEAP1 را پایین آوردیم تا ببینیم آیا بیش از حد میتوکندری ناشی از SFN از طریق یک مسیر مستقل از KEAP1 وابسته به KEAP2 تحریک می شود. با این حال ، کاهش KEAP1 همچنین نتوانست همجوشی میتوکندری ناشی از SFN را لغو کند (شکل 1G I). در حقیقت ، SFN شکل گیری پیش شکافت ناشی از کاهش KEAP1 را معکوس کرد (شکل 1G ، صفحه b در مقابل صفحه d). این نتایج نشان می دهد که درمان SFN باعث همجوشی میتوکندری مستقل از مسیر متعارف KEAP1-Nrf2-ARE می شود و ما را به بازجویی سوق می دهد که آیا SFN به طور مستقیم بر اجزای شکافت میتوکندری یا ماشین آلات همجوشی تأثیر می گذارد.
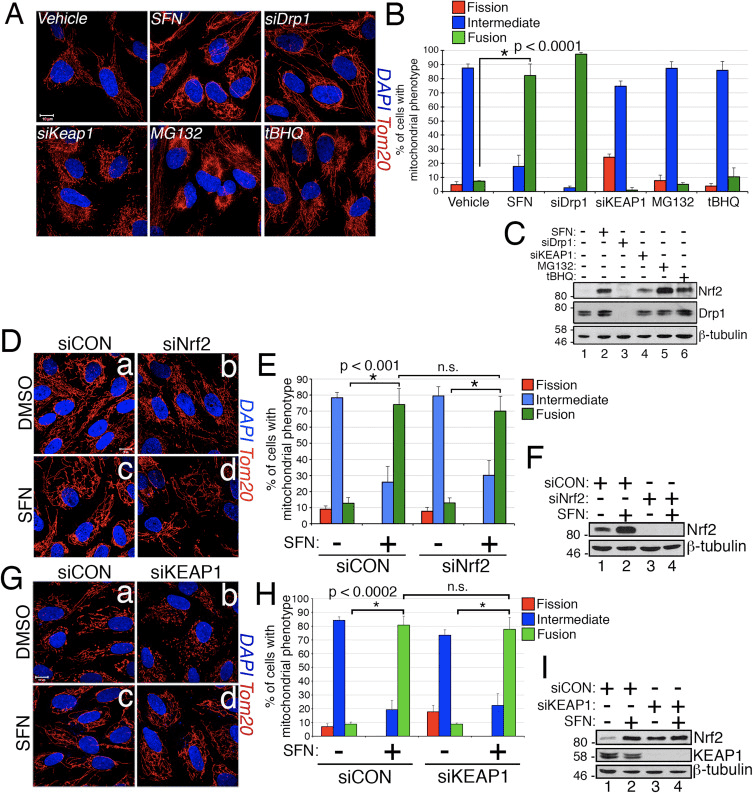
سولفورفان باعث آسیب رساندن به انجمن میتوکندری Drp1 می شود
بر اساس یافته هایی که درمان SFN موجب هیپوفیز کردن میتوكندری می شود، ما تصور كردیم كه این فنوتیپ یا نتیجه فعالیت فیوژن بیش از حد یا مهار فعالیت های تجزیه است. برای تمایز بین این دو ویژگی، ما مورفولوژی پراکسیزوم را در حضور و عدم وجود SFN مقایسه کردیم. پراکسیزم ها شبیه به میتوکندری هستند، زیرا آنها اندام های پویا هستند که طول آنها به طور مداوم در شار [44] می باشد. پراکسیزوم ها حاوی Fis1 و MF در غشای خارجی هستند و در نتیجه اهداف شبیه سازی [1]، [22] Drp23 می باشند. با این حال، پراکسسیوم ها از ماشین آلات همجوشی شبکه های میتوکندری استفاده نمی کنند و در نتیجه فوجی [39] را انجام نمی دهند. در عوض، تقسیم پراکسسیوم با افزایش پراکسیزوم های موجود از طریق افزودن غشای غشاء و پروتئین ها [44] مخالف است. از آنجا که پراکسیوم ها Mfn1 / 2 و OPA1 ندارند، ما تصور کردیم که اگر SFN به جای مهار ماشین آلات تجزیه کننده، ماشین آلات فیوز را فعال کند، طول پراکسیوم موثر نخواهد بود. در سلول های تحت درمان با وسیله نقلیه، پراکسیزوم ها به عنوان اندام کوتاه، دور، پانکستیوم (شکل 2، پانل های b و d) نگهداری می شوند. با این حال، درمان با SFN طول پروکسیوم را با 2 برابر با سلول های کنترل (شکل 2، پانل های f و h) افزایش داد. علاوه بر این، بسیاری از پراکسیوم ها در نزدیکی مرکز منقبض شده اند، که نشان دهنده نقص انکساری بالقوه است (شکل 2، پانل h، سرها). به همین ترتیب، پراکسیزم ها در سلول های انتقال دهنده siRNA Drp1 غیر طبیعی طولانی بودند (شکل 2، پانل ها j و l)، تایید کرد که Drp1 برای تقسیم پراکسسیوم مورد نیاز است و پیشنهاد می کند که درمان SFN باعث ایجاد فنوتیپ های میتوکندریال و پراکسسیوم می شود با اختلال در دستگاه های تجزیه کننده.
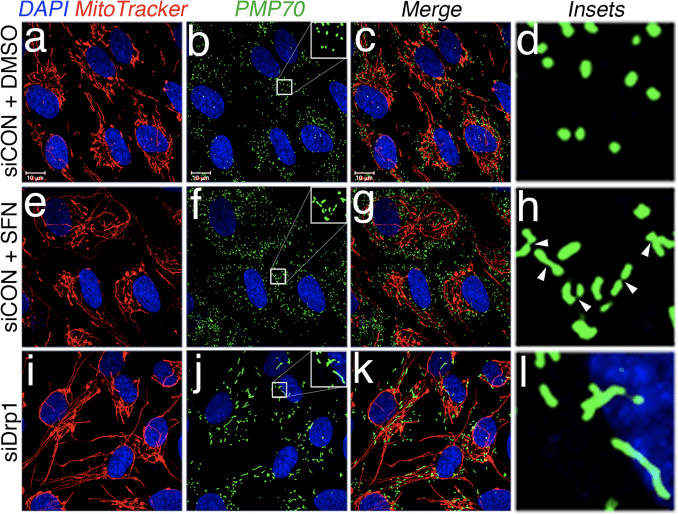
سپس تعیین کردیم که چگونه SFN عملکرد Drp1 را محدود می کند. احتمالات شامل کاهش در سطوح بیان، استخدام / حفظ در میتوکندری، الیگومریزاسیون، یا فعالیت آنزیمی GTPase بود. نقص در هر یک از اینها منجر به کاهش شکافت و هیپرفیوژن میتوکندری می شود. ما تغییرات قابل تکرار در سطوح پروتئین Drp1 را پس از درمان با SFN شناسایی نکردیم (شکل 1C و 3A)، و بنابراین به این نتیجه رسیدیم که SFN پایداری یا بیان Drp1 را تغییر نمیدهد، مطابق با نیمه عمر Drp1 بیش از 10 ساعت [50]. و درمان SFN ما مدت زمان کمتری دارد. در مرحله بعد، بررسی کردیم که آیا SFN بر جذب یا حفظ Drp1 در میتوکندری تأثیر می گذارد یا خیر. مطالعات شکنش نشان داد که SFN باعث از دست دادن Drp1 از بخش میتوکندری می شود (شکل 3A، خطوط 7-8 و شکل 3B). همانطور که قبلاً گزارش شد [43]، تنها بخش کوچکی از Drp1 (3٪) با شبکه میتوکندری در هر زمان معین در شرایط حالت پایدار همراه است و بیشتر آنزیم در سیتوپلاسم ساکن است (شکل 3A، خطوط 5-8). ). این دادههای تقسیمبندی با استفاده از تجزیه و تحلیل هممحلسازی تأیید شد که کاهش 40 درصدی را در کانونهای Drp1 نقطهگذاری شده با میتوکندری پس از درمان SFN نشان داد (شکل 3C و D). با هم، این داده ها نشان می دهد که همجوشی میتوکندری ناشی از SFN، حداقل تا حدی، به دلیل ارتباط ضعیف Drp1 با میتوکندری است. دادههای ما بین اینکه آیا SFN با جذب میتوکندریایی در مقابل حفظ میتوکندری Drp1 تداخل میکند یا هر دو، تمایز قائل نمیشود، زیرا تجزیه و تحلیل Drp1 درونزا برای تجسم GTPase توسط میکروسکوپ سلول زنده قابل قبول نبود.
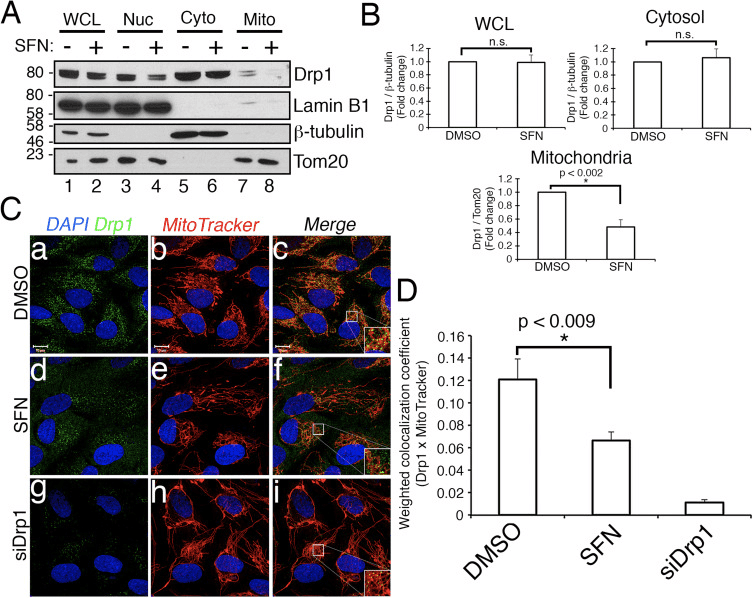
سولفورفان محافظتی علیه آپوپتوز ناشی از استاستوسپورتین را مستقل از Nrf2
کار قبلی نشان داده است که شکافت میتوکندری در تشکیل منافذ در غشای خارجی میتوکندری که توسط Bax/Bak در طول آپوپتوز ایجاد میشود، مجاز است [11]. نشان داده شده است که Drp1 به طور انتخابی در طول آپوپتوز به میتوکندری ها وارد می شود [11] و مطابق با این، میتوکندری های تکه تکه شده در اوایل فرآیند مشاهده شده اند [27]. برعکس، تصور می شود که مهار شکافت میتوکندری با مسدود کردن تشکیل منافذ غشای خارجی که امکان آزادسازی سیتوکروم c را فراهم می کند، آپوپتوز را مهار می کند [53]. بر این اساس، تحریک همجوشی میتوکندری پیشرفت آپوپتوز ناشی از ترکیباتی از جمله استاوروسپورین (STS) را به تاخیر می اندازد [14]. برای تعیین اینکه آیا SFN از سلولهای RPE-1 در برابر آپوپتوز با واسطه STS محافظت میکند و اگر چنین است، آیا این به Nrf2 نیاز دارد یا خیر، ما سنجشی را برای القای آسان برش پلی مراز پلی مراز ADP ریبوز (PARP)، بستری از کاسپاز-3 فعال شده و نشانگر قطعی ایجاد کردیم. آپوپتوز درمان سلولهای RPE-1 با 1 میکرومولار STS بهمدت 6 ساعت تنها باعث برش بسیار کم PARP شد، اما با درمان مشترک SFN از این امر جلوگیری شد (به عنوان مثال، شکل 4A، خط 3 در مقابل 4). برای افزایش استحکام این روش، ما سلولها را با پیشدرمان کردن سلولها با siRNA که فاکتور ضد آپوپتوز Bcl-XL را هدف قرار میدهد، به آپوپتوز ناشی از STS بیشتر حساس کردیم. این پیش درمانی بیان Bcl-XL را کاهش داد و به طور قابل توجهی برش PARP را به عنوان تابعی از زمان قرار گرفتن در معرض STS ارتقا داد (شکل 4B، خط 2 را با خطوط 4-10 مقایسه کنید). نکته مهم این است که 2 ساعت قبل از درمان با SFN برش PARP را در سلول های در معرض STS کاهش داد (شکل 4C، خط 3 در مقابل 4 و خط 5 در مقابل 6). به همین ترتیب، سلول هایی که به طور پایدار از Nrf2 توسط CRISPR/Cas9 تخلیه شده بودند، به طور قابل قیاسی از سمیت STS توسط پیش درمان SFN محافظت شدند (شکل 4C، خط 11 در مقابل 12 و خط 13 در مقابل 14 و شکل 4D). این حفاظت با استفاده از برش PARP (شکل 4C و D) و مورفولوژی سلولی (شکل 4E) به عنوان بازخوانی مشاهده شد. کارایی کاهش Nrf2 توسط CRISPR/Cas9 توسط وسترن بلات تایید شد (شکل 4C، بلات Nrf2). همانطور که پیشبینی میشد، سلولهای کاهشدهنده Drp1، که همچنین یک فنوتیپ هیپرفیوژن (شکل 1A) را ایجاد میکند، در مقایسه با سلولهای کنترل انکوبهشده با SFN (شکل 4F و G)، برش PARP را در پاسخ به STS مسدود کرد. با هم، این یافتهها با SFN که از طریق ظرفیت آن برای محدود کردن عملکرد Drp1، مستقل از تثبیت و فعالسازی Nrf2، محافظت در برابر آپوپتوز ایجاد میکند، سازگار است.
بحث
ما کشف کرده ایم که SFN مدولاسیون پویایی تقسیم / همجوشی میتوکندری مستقل از اثرات آن بر مسیر KEAP1-Nrf2-ARE است. این امر به دلیل یک پیوند فرض شده بین اختلال عملکرد میتوکندریال و تولید ROS و ضرورت استحکام رادیکال های آزاد ماتوخناندی از طریق فعال شدن Nof2 جالب است. این تاثیر کاربردی اضافی SFN از اهمیت بالایی برخوردار است زیرا بیشتر از آزمایشات بالینی 30 در حال انجام آزمایش SFN برای درمان انواع بیماری ها از جمله سرطان پروستات، بیماری های انسدادی ریوی و بیماری سلول های سگ [7]، [10]، [ 47]
از آنجا که SFN isothiocyanate [56] است و آن سیگنال های انتقالی KEAP2 را به طور مستقیم آکیل کردن سیستین های بحرانی KEAP1 برای مهار توزیع NLF2 [21] فعال می کند، بدین معنی است که SFN اثرات پرولوژی خود را بوسیله تعدیل فعالیت یک عامل تقسیم یا فیوژن از طریق اصلاح سیستین . داده های ما به شدت از Drp1 حمایت می کند که توسط SFN منفی تنظیم می شود، هرچند که آیا GTPase یک هدف مستقیم آسیل سازی است که هنوز مشخص نشده است. علیرغم این شکاف دانش، عملکرد Drp1 به صراحت توسط SFN به خطر افتاده است؛ چرا که هر دو میتوكندری و پراكسیوم ها در پاسخ به درمان SFN بیش از حد فرسوده می شوند و این ارگانل ها Drp1 را برای رویدادهای مربوط به تجزیه آن [38] به اشتراک می گذارند. علاوه بر این، SFN میزان Drp1 را کاهش می دهد که در میتوکندری موضعی و تجمع می یابد (شکل. 3). از آنجایی که آزمایشات ما با تمام پروتئین های درونی انجام می شود، تشخیص Drp1 در محل های تقسیم میتوکندری تحت شرایط پایدار است و در نتیجه ما نمی توانیم بین استخدام و نقص نگهداری از آنزیم ناشی از SFN را تشخیص دهیم. علاوه بر این، ما نمی توانیم احتمال این که SFN یک گیرنده در میتوکندری (Fis1 یا MF) آشکار می کند تا مانع جذب Drp1 شود، ما معتقدیم Drp1 به طور مستقیم اصلاح می شود. Drp1 داراي 9 سيستئين است که هشت نفر از آنها در دامنه مياني قرار دارند که براي اليگومريزاسيون لازم است [3] و يکي از آنها در دامنه افترتور GTPase (GED) در انتهاي C Drp1 قرار دارد. Acylation مستقیم هر کدام از این سيستئین ها می تواند باعث اختلال فعالیت در Drp1 شود و بنابراین اثر SFN بر پویایی میتوکندری را تحت تأثیر قرار می دهد. به طور قابل توجهی، کار قبلی نشان می دهد که نقص در oligomerization و فعالیت کاتالیزوری می تواند حفظ Drp1 در میتوکندری [52]. Cys644 در دامنه GED هدف خاصی است که بر اساس کار قبلی نشان می دهد که جهش های جهش های این فنوتیپ های سیتئین که فعالیت Drp1 GTPase [4] را مختل می کنند و این سیتستین خاص با الکتروفیل های واکنشی تیول [9] اصلاح می شود. رفع این سوال فوقالذکر نیاز به اعتبار سنجی طیف سنجی دارد. به طور خلاصه، ما یک تابع جدید، سیتوپروتیک را برای SFN ترکیبی بالینی داریم. علاوه بر فعال شدن عامل اصلی رونویسی ضد عفونی کننده Nrf2، SFN باعث افزایش تلفات میتوکندری و پراکسسیوم می شود و این اثر مستقل از Nrf2 می باشد. مکانیسم اصلی این پدیده شامل کاهش عملکرد GTPase Drp1، واسطه اصلی تقسیم میتوکندری و پراکسسیوم است. یک نتیجه عمده از SFN-متمرکز فیوژن میتوکندری این است که سلول ها به اثرات سمی استوروسورپین القا کننده آپوپتوز مقاوم می شوند. این اثر اضافی سیتوپروتئینی SFN میتواند از ابزار بالینی خاصی در بیماریهای نورودژنراتیک متعدد باشد که سن آنها عامل اصلی خطر است (به عنوان مثال بیماری پارکینسون، بیماری آلزایمر، دژنراسیون ماکولای مربوط به سن) به عنوان این بیماری با آپوپتوز همراه است و کاهش سطوح و / یا اختلال تنظیم Nrf2 [35]، [36]، [48].
مواد و روش ها
تست آپوپتوز
همانطور که در زیر نشان داده شده ، سلولها بذر و با siRNA ترانسفکت شدند سلول ها برای القای همجوشی میتوکندری به مدت 50 ساعت با 2μ M سولفورافان تحت درمان قرار گرفتند و سپس با القای 1 استاروسپورین M برای القای آپوپتوز تحت درمان قرار گرفتند. در زمان برداشت ، محیط در لوله های جداگانه جمع آوری شد و تحت سلولهای سانتریفوژ با سرعت بالا به سلولهای آپوپتوز گلوله قرار گرفت. این گلوله سلولی با سلولهای چسبنده ترکیب شده و در بافر 2 برابر غلیظ Laemmli حل شد. نمونه ها تحت لکه گیری ضد PARP قرار گرفتند.
CRISPR / Cas9 Construct Generation
برای ایجاد LentiCRISPR / eCas9 1.1، LentiCRISPR v2 (addgene #52961) ابتدا با Age1 و BamH1 بریده شد. سپس، SpCas9 از eSpCas9 1.1 (addgene #71814) PCR amplified با استفاده از primer ها در رده های Age1 و BamH1 با استفاده از پرایمر های زیر (جلو AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC، معکوس AAGCGCGGATCCCTTTTTCTTTTTTGCCTGGCCGG) و در برش برش بالا بالا لیگاد شده است. توالی sgRNA با استفاده از Benchling.com تعیین شد. پارامترها برای دنبال کردن توالی کدگذاری با بالاترین میزان بر روی هدف و کمترین نمرات غیر هدف قرار گرفتند. توالی های زیر (با هدف قرار دادن توالی زیر خط دار، HS sgNFE2L2 # 1 حس CACCGCGACGGAAAGAGTATGAGC، آنتی AAACGCTCATACTCTTTCCGTCGC؛ HS sgNFE2L2 # 2 CACCGGTTTCTGACTGGATGTGCT معنا، AAACAGCACATCCAGTCAGAAACC آنتی سنس؛ HS sgNFE2L2 # 3 حس CACCGGAGTAGTTGGCAGATCCAC، آنتی AAACGTGGATCTGCCAACTACTCC) آنیل و مسدود به BsmB1 قطع LentiCRISPR / eCas9 1.1 شد. سلول های RPE-1 آلوده به لنفوویروس با پوموویسیین انتخاب شدند و به عنوان یک جمعیت جمع شده نگهداری شدند. ناکوته توسط ایمونوفلورسانس و غربالگری غربی تأیید شد.
فرهنگ سلولی و ترانسفکشن
سلولهای اپیتلیال رنگدانه ای شبکیه انسان که با تلومراز (RPE-1) تبدیل شده اند (ATCC) در اصلاح شده عقاب متوسط Dulbecco (DMEM) حاوی 1 گرم در لیتر گلوکز همراه با پنی سیلین ، استرپتومایسین ، 1X کوکتل اسید آمینه غیر ضروری (Life Technologies) ، و 10٪ سرم جنین گاو (فن آوری های زندگی). برای انتقال siRNA ، 30,000 cells 35,000 سلول در میلی لیتر یک شب بذر شد. سلولها 10 نانومولار siRNA رقیق شده در DMEM بدون سرم و همراه با 0.3٪ واکنش ترانسفورین اینترفرین (PolyPlus) دریافت کردند. برای حساسیت به آپوپتوز ، سلول ها 1 nM Bcl-XL siRNA دریافت کردند. سلول ها 2 3 روز پس از عفونت برداشت شدند.
مواد شیمیایی، آنتی بادی، و siRNA Oligos
آنتی بادی های ضد؟ توبولین (سیگنالینگ سلولی) ، بتوبولین (سیگما) ، Drp1 (BD Biosciences) ، KEAP1 (پروتئین تک) ، لامین B1 (آبکم) ، PARP (سیگنالینگ سلولی) ، PMP70 (آبکم) و Tom20 (BD علوم زیستی) ) در رقت 1: 1000 برای وسترن بلات و برای ایمونوفلورسانس استفاده شد. از آنتی بادی خرگوش ضد Nrf2 در خانه 1: 2000 برای وسترن بلات استفاده شد [34] ، [59]. از سولفورافان (سیگما) و استاوروسپورین (توکریس) به ترتیب در 50؟ M و 1؟ M استفاده شد. siRNA ها در برابر Drp1 (Dharmacon) ، Nrf2 (Dharmacon) ، KEAP1 (سیگنالینگ سلول) و Bcl-XL (سیگنالینگ سلولی) در 10 نانومتر استفاده شد مگر اینکه خلاف آن ذکر شده باشد.
ایمونوفلورسانس و در برچسب Vivo
سلول های بذر شده روی روکش های شیشه ای 18 میلی متری با وسیله نقلیه یا دارو تحت تیمار قرار گرفتند ، در 3.7٪ فرمالدئید فیکس شدند و سپس در 0.2٪ تریتون X-100 / PBS روی یخ به مدت 10 دقیقه نفوذ یافتند. آنتی بادی های اولیه در 3 album آلبومین سرم گاو (BSA) در PBS یک شب در دمای 4 درجه سانتیگراد انکوبه شدند. به دنبال شستشوی PBS ، سلول ها به مدت 1 ساعت در آنتی بادی های ثانویه مزدوج مناسب الکسا 488- یا الکسا 546- ، رقت 1: 1000) و 0.1 گرم در میلی لیتر DAPI (سیگما) در 3٪ BSA / PBS انکوبه شدند. میتوکندری یا توسط ایمونوفلورسانس ضد Tom20 یا با سلول های جوجه کشی در 200 نانومولار MitoTracker Red CMXRos (پروب مولکولی ، شرکت) در DMEM بدون سرم به مدت 30 دقیقه در 37 درجه سانتیگراد قبل از تثبیت مشاهده شد.
میکروسکوپ و تحلیل تصویر
نمونه های ایمونوفلورسانس بر روی میکروسکوپ کانفوکال LSM710 (Carl Zeiss) مشاهده شد. میکروگرافها با استفاده از اهداف غوطه وری روغن 63X یا 100X و تصاویر با استفاده از Adobe Photoshop CS6 تنظیم و بهبود یافته اند. تجزیه و تحلیل محلی سازی با استفاده از Carl Zeiss LSM710 ویژگی محلی سازی مشترک با آستانه تنظیم دستی انجام شد در حالی که کور به هویت نمونه ها. میله های مقیاس در کل ، مگر اینکه خلاف آن مشخص شده باشد ، 10 می باشد. مورفولوژی میتوکندری با نمره گذاری کور ارزیابی شد. اگر میتوکندری سلول به صورت چند نقطه ای ، گرد و تفکیک پذیر حفظ شود ، سلول به عنوان "شکافت" امتیاز گرفت. اگر میتوکندری های فردی قابل تشخیص نبودند و کل شبکه میتوکندری به طور مداوم ظاهر می شد ، سلول به عنوان "فیوژن" به ثمر رسید. تمام سلولهای دیگر ، از جمله سلولهای دارای میتوکندری خوشه ای ، به عنوان "متوسط" امتیاز بندی شدند.
تقسیم بندی های زیر سلولی
سلولهای RPE-1 تا محل تلاقی رشد کردند. پس از شستشوی PBS ، سلول ها در دمای 600 گرم به مدت 10 دقیقه تحت سانتریفیوژ قرار گرفتند و در بافر جداسازی 600 ل L (210 میلی متر مانیتول ، 70 میلی متر ساکارز ، 5 میلی متر MOPS ، 1 میلی متر EDTA pH 7.4 + 1 میلی متر PMSF) مجدداً تعلیق شدند. سیستم تعلیق 30 بار در هموژنایزر دانس لیز شد. کسری از هموژن به عنوان یک لیزات سلول کامل حفظ شد. باقیمانده در 800 گرم به مدت 10 دقیقه به هسته گلوله در سانتریفوژ قرار گرفت. سوپرونتنت ها برای پاک کردن هسته های باقیمانده و سلول های بدون لیزر تحت حرارت 1500 گرم به مدت 10 دقیقه تحت سانتریفوژ قرار گرفتند. این ماده رویی در 15,000 گرم برای 15 دقیقه به میتوکندری گلوله در سانتریفیوژ قرار گرفت. مایع رویی به عنوان "کسر سیتوزولی" حفظ شد. گلوله را به آرامی با PBS شستشو داده و در بافر جداسازی مجدداً معلق نمود. غلظت پروتئین هر بخش با استفاده از روش بیسینکونینیک اسید (BCA) اندازه گیری شد و مقادیر معادل پروتئین توسط SDS-PAGE حل شد.
Blotting غرب
سلول ها در PBS شسته شدند و در بافر حل کننده 2 بار غلیظ Laemmli (100 میلی مولار Tris [pH 6.8]، 2٪ SDS، 0.008٪ بروموفنول بلو، 2٪ 2- مرکاپتواتانول، 26.3٪ گلیسرول، و 0.001٪ Pyrinin) حل شدند. لیزها قبل از بارگذاری روی ژل پلی آکریل آمید سدیم دودسیل سولفات (SDS) به مدت 5 دقیقه جوشانده شدند. پروتئین ها به غشاهای نیتروسلولزی منتقل شدند و غشاها به مدت 1 ساعت در شیر/TBST 5 درصد مسدود شدند. آنتی بادی های اولیه در شیر/TBST 5 درصد رقیق شده و با بلات یک شبه در دمای 4 درجه سانتیگراد انکوبه شدند. آنتی بادی های ثانویه کونژوگه ترب پراکسیداز (HRP) در شیر/TBST 5 درصد رقیق شدند. بلات با نورتابی شیمیایی افزایش یافته پردازش شد و کمی سازی چگالی سنجی با استفاده از نرم افزار ImageJ انجام شد.

سولفورفان یک ماده شیمیایی است که از مجموعه ایزوتیوسیانات مواد تشکیل دهنده سولفوریک به دست آمده از سبزیجات cruciferous، از جمله بروکلی، کلم، گل کلم، کلم و کلث ها، از جمله دیگر است. سولفورفان تولید می شود زمانی که آنزیم میروزیناز، گلوکوراپامین، گلوکوزینولات، را به سولفورفان تبدیل می کند که همچنین به عنوان سولفورفان گلوکوزینولات شناخته می شود. جوانه های بروکلی و گل کلر دارای بالاترین غلظت گلوکوراپامین یا پیش ماده سولفورفان هستند. تحقیقات انجام شده نشان داده است که سولفورفان توانایی های آنتی اکسیدانی بدن انسان را برای جلوگیری از مسائل مختلف بهداشتی افزایش می دهد. دکتر الکس جیمنز DC، CCST Insight
سولفورافان و تأثیرات آن بر سرطان ، مرگ و میر ، پیری ، مغز و رفتار ، بیماری های قلبی و موارد دیگر
ایزوتیوسیانات ها یکی از مهمترین ترکیبات گیاهی هستند که می توانید در رژیم غذایی خود داشته باشید. در این ویدئو من جامع ترین مورد برای آنهایی است که تاکنون ساخته شده است. فاصله کم توجهی؟ با کلیک کردن روی یکی از نقاط زمانی زیر، موضوع مورد علاقه خود را پر کنید. جدول زمانی کامل در زیر
بخش های کلیدی:
- 00: 01: 14 - سرطان و مرگ و میر
- 00: 19: 04 - پیری
- 00: 26: 30 - مغز و رفتار
- 00: 38: 06 - خلاصه نهایی
- 00: 40: 27 - دوز
جدول زمانی کامل:
- 00: 00: 34 - معرفی سولفورفان، تمرکز اصلی این ویدئو است.
- 00: 01: 14 - مصرف سبزیجات کریستالی و کاهش مرگ و میر در همه موارد.
- 00: 02: 12 - خطر سرطان پروستات.
- 00: 02: 23 - خطر سرطان مثانه.
- 00: 02: 34 - سرطان ریه در افراد سیگاری خطر دارد.
- 00: 02: 48 - خطر ابتلا به سرطان پستان.
- 00: 03: 13 - Hypothetical: اگر سرطان دارید، چه؟ (مداخله)
- 00: 03: 35 - مکانیسم قابل قبول داده های وابسته به سرطان و مرگ و میر.
- 00: 04: 38 - سولفورفان و سرطان.
- 00: 05: 32 - شواهد حيواني نشان دهنده اثرات شديد عصاره برانکاري بر رشد تومور مثانه در موش صحرايي.
- 00: 06: 06 - اثر مکمل مستقیم سولفورفان در بیماران مبتلا به سرطان پروستات.
- 00: 07: 09 - ذخیره سازی بیولوژیکی متابولیت های ایزوتوسیانات در بافت های پستان واقعی.
- 00: 08: 32 - مهار سلول های بنیادی سرطان پستان.
- 00: 08: 53 - درس تاریخ: برنجهای با خواص سلامتی حتی در روم باستان تاسیس شده اند.
- 00: 09: 16 - توانایی سولفورفان برای افزایش دفع سرطان زایی (بنزن، آکرولئین).
- 00: 09: 51 - NRF2 به عنوان یک سوئیچ ژنتیکی از طریق عناصر پاسخ آنتی اکسیدان.
- 00: 10: 10 - چگونه فعالیت NRF2 باعث افزایش دفع سرطانزا از طریق ترکیبات گلوتاتیون-S می شود.
- 00: 10: 34 - جوانه های بروکسل گلوتاتیون S-transferase را افزایش می دهند و آسیب DNA را کاهش می دهند.
- 00: 11: 20 - نوشیدنی نای بروکلی باعث افزایش دفع بنزن توسط 61٪ می شود.
- 00: 13: 31 - هموگلوبین بوته بروکلی آنزیم های آنتی اکسیدان را در فضای باز بالا می برد.
- 00: 15: 45 - مصرف سبزیجات کریستالی و مرگ و میر بیماری قلبی.
- 00: 16: 55 - پودر تخم مرغ بروکلی موجب افزایش چربی خون و خطر بیماری کلیوی قلب در افراد مبتلا به دیابت نوع 2 می شود.
- 00: 19: 04 - شروع فصل پیری.
- 00: 19: 21 - رژیم غنی شده با سولفورفان باعث افزایش طول عمر سوسک از 15 به 30٪ (در شرایط خاص) می شود.
- 00: 20: 34 - اهمیت التهاب کم برای طول عمر.
- 00: 22: 05 - سبزیجات کریستالی و پودر تخم گشنیز بروکلی به نظر می رسد که انواع مختلف نشانگرهای التهابی را در انسان کاهش دهند.
- 00: 23: 40 - بازپخش ویدئویی: سرطان، بخش های پیری
- 00: 24: 14 - مطالعات ماوس نشان می دهد سولفورفان ممکن است در بهبودی سیستم ایمنی سازگاری را بهبود بخشد.
- 00: 25: 18 - سولفورفان باعث بهبود رشد مو در مدل موشك پستان شد. تصویر در 00: 26: 10.
- 00: 26: 30 - آغاز بخش مغز و رفتار.
- 00: 27: 18 - تأثیر عصاره پرتقال بروکلی بر اوتیسم.
- 00: 27: 48 - اثر گلوکورافامین بر اسکیزوفرنیا.
- 00: 28: 17 - شروع بحث افسردگی (مکانیزم قابل اعتماد و مطالعات).
- 00: 31: 21 - مطالعه ماوس با استفاده از مدل های مختلف 10 از افسردگی ناشی از استرس نشان می دهد سولفورفان به طور مشابه به عنوان فلوکستین (پروزاک) موثر است.
- 00: 32: 00 - مطالعه نشان می دهد که مصرف مستقیم گلوکورافامین در موش ها در جلوگیری از افسردگی از مدل استرس شکست اجتماعی موثر است.
- 00: 33: 01 - آغاز بخش نابودسازی.
- 00: 33: 30 - سولفورفان و بیماری آلزایمر.
- 00: 33: 44 - بیماری سولفورفان و پارکینسون.
- 00: 33: 51 - بیماری سولفورفان و Hungtington.
- 00: 34: 13 - سولفورفان باعث افزایش پروتئین شوک حرارت می شود.
- 00: 34: 43 - شروع بخش آسیب مغزی آسیب دیده.
- 00: 35: 01 - سولفورفان بلافاصله پس از تزریق TBI تزریق می شود (مطالعه ماوس).
- 00: 35: 55 - سولفورفان و پلاستیک نرون.
- 00: 36: 32 - سولفورفان باعث بهبود یادگیری در مدل دیابت نوع II در موش می شود.
- 00: 37: 19 - دیستروفی عضلانی سولفورفان و دوئن.
- 00: 37: 44 - مهار مایواستاتین در سلول های ماهواره ای عضلانی (in vitro).
- 00: 38: 06 - ضبط ویدئویی بعدی: مرگ و میر و سرطان، آسیب DNA، استرس اکسیداتیو و التهاب، دفع بنزن، بیماری قلبی عروقی، دیابت نوع II، اثرات مغز (افسردگی، اوتیسم، اسکیزوفرنی، تولید نئوپروز)، مسیر NRF2.
- 00: 40: 27 - افکار در مورد بدست آوردن دوز از جوانه های بروکلی یا سولفورفان.
- 00: 41: 01 - داستان های تخیلی در منزل.
- 00: 43: 14 - در دمای آشپزی و فعالیت سولفورفان.
- 00: 43: 45 - تبدیل باکتری های قارچی سولفورفان از گلوکورافین.
- 00: 44: 24 - مکمل ها بهتر است در ترکیب با میروسیناز فعال سبزیجات کار کنند.
- 00: 44: 56 - تکنیک های آشپزی و سبزیجات cruciferous.
- 00: 46: 06 - ایزوتوسیانات به عنوان گیتروژن.
سپاسگزاریها
Sciencedirect.com/science/article/pii/S2213231716302750
چگونه سولفورفان تولید می شود؟
گرمایش فعالیت پروتئین Epithiospecifier را کاهش می دهد و سازنده سولفورفان را در بروکلی افزایش می دهد
چکیده
سولفورافان، ایزوتیوسیانات کلم بروکلی، یکی از قویترین مواد ضد سرطان مشتق شده از مواد غذایی است. این ترکیب در سبزی دست نخورده وجود ندارد، بلکه از پیش ساز گلوکوزینولات آن، گلوکورافانین، در اثر عمل میروزیناز، آنزیم تیوگلوکوزیداز، در هنگام خرد شدن یا جویدن بافت بروکلی به وجود می آید. با این حال، تعدادی از مطالعات نشان دادهاند که بازده سولفورافان از گلوکورافانین کم است و یک آنالوگ نیتریل غیر فعال زیستی، سولفورافان نیتریل، محصول هیدرولیز اولیه است که بافت گیاه در دمای اتاق خرد میشود. شواهد اخیر نشان می دهد که در آرابیدوپسیس، تشکیل نیتریل از گلوکوزینولات ها توسط یک پروتئین حساس به حرارت، پروتئین epithiospecifier (ESP)، یک کوفاکتور غیر کاتالیزوری میروزیناز کنترل می شود. هدف ما بررسی اثرات حرارت دادن گلچه ها و جوانه های کلم بروکلی بر تشکیل سولفورافان و سولفورافان نیتریل بود، برای تعیین اینکه آیا کلم بروکلی حاوی فعالیت ESP است یا خیر، سپس تغییرات وابسته به گرما در فعالیت ESP، محتوای سولفورافان و زیست فعالی را که با القای اندازه گیری می شود، مرتبط کنیم. فاز دوم آنزیم سم زدایی کوئینون ردوکتاز (QR) در کشت سلولی. گرم کردن گلچه های کلم بروکلی تازه یا جوانه های کلم بروکلی تا دمای 60 درجه سانتیگراد قبل از همگن سازی، به طور همزمان باعث افزایش تشکیل سولفورافان و کاهش تشکیل نیتریل سولفورافان می شود. کاهش قابل توجهی از فعالیت ESP به موازات کاهش تشکیل نیتریل سولفورافان بود. حرارت دادن به دمای 70 درجه سانتیگراد و بالاتر باعث کاهش تشکیل هر دو محصول در گلچه های کلم بروکلی شد، اما نه در جوانه های بروکلی. القای QR در سلولهای هپاتوم lclc7 کشتشده موش به موازات افزایش تشکیل سولفورافان است.

گلها و جوانه های کلم بروکلی قبل از گرم کردن تا دمای 60 درجه سانتیگراد به طور قابل توجهی تشکیل سولفورافان (SF) کاتالیز شده توسط میروسیناز را در عصاره های بافت گیاهی پس از خرد کردن افزایش داد. این امر با کاهش تشکیل سولفورافان نیتریل (SF نیتریل) و فعالیت پروتئین سازنده اپی تسیوس (ESP) همراه بود.
کلید واژه ها: کلم بروکلی، Brassica oleracea، Cruciferae، سرطان، Anticarcinogen، Sulforaphane، سولفورفان نیتریل، پروتئین Epithiospecifier، Quinone Reductase
در نتیجه، سولفورافان یک ماده شیمیایی گیاهی است که در کلم بروکلی و سایر سبزیجات چلیپایی یافت می شود. مقدار کنترل نشده اکسیدان ناشی از عوامل داخلی و خارجی می تواند باعث استرس اکسیداتیو در بدن انسان شود که در نهایت ممکن است منجر به انواع مشکلات سلامتی شود. سولفورافان می تواند تولید Nrf2 را فعال کند، یک فاکتور رونویسی که به تنظیم مکانیسم های آنتی اکسیدانی محافظ که پاسخ سلول به اکسیدان ها را کنترل می کند، کمک می کند. دامنه اطلاعات ما محدود به مسائل مربوط به کایروپراکتیک و سلامت ستون فقرات است. برای بحث در مورد موضوع، لطفاً از دکتر خیمنز بپرسید یا با ما تماس بگیرید915-850-0900.
دکتر الکس جیمنز سرپرستی می کند
اشاره از: Sciencedirect.com

بحث در مورد مبحث اضافی: درد کمر حاد
درد پشتاین یکی از مهمترین دلایل معلولیت و روزهای از دست رفته در کار در سراسر جهان است. کمردرد دومین دلیل شایع مراجعه به مطب توسط پزشکان است که بیشتر از عفونت های دستگاه تنفسی فوقانی است. تقریباً 80 درصد مردم حداقل یک بار در طول زندگی خود درد کمر را تجربه خواهند کرد. ستون فقرات یک ساختار پیچیده است که از استخوان ها ، مفاصل ، رباط ها و ماهیچه ها در میان سایر بافت های نرم تشکیل شده است. به همین دلیل ، صدمات و یا شرایط وخیم مانند دیسک های فتق دیسک، در نهایت می تواند منجر به علائم درد پشت شود. آسیب های ورزشی یا آسیب های ناشی از تصادفات خودرو اغلب اغلب علت درد پشت هستند، اما گاهی اوقات ساده ترین حرکات می توانند نتایج دردناکی داشته باشند. خوشبختانه، گزینه های درمان جایگزین، مانند مراقبت از کیهان پراکسی، می تواند به کاهش درد در استفاده از تنظیمات ستون فقرات و دستکاری دست کمک کند و در نهایت بهبود تسکین درد را کاهش دهد.

EXTRA EXTRA | موضوع مهم: توصیه شده El Paso، TX Chiropractor
***
اطلاعات اینجا در "سولفورفان چیست؟"در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من






