عصب خونی:
چکیده
خطوط چندگانه شواهد از نقش بیماریزا در بیماری های روانپزشکی عصبی حمایت می کنند. در حالی که بیماری های خود ایمنی سیستمیک علل خوبی در زمینه اختلالات روانپزشکی هستند، آنسفالیت های خود ایمنی سیناپسی با علائم روان پریشی اغلب به طور ناشناخته شناخته می شوند. به موازات پیوند بین علائم روانپزشکی و خودایمنی در بیماری های خودایمنی، اختلالات عصبی مصنوعی در اختلالات روانپزشکی کلاسیک (به عنوان مثال، افسردگی شدید، دوقطبی، اسکیزوفرنی و اختلالات وسواسی- اجباری) رخ می دهد. تحقیقات در مورد پاتوفیزیولوژی این شرایط به طور سنتی بر تنظیم غلط سیستم های گلوتاماترگیک و مونوآمینرژیک تأکید داشت، اما مکانیزم هایی که این ناهنجاری های انتقال دهنده عصبی را به وجود می آورد ناپدید شد. ما پیوند بین autoimmunity و اختلالات روانپزشکی را بررسی می کنیم و شواهد انسانی و تجربی راجع به نقض پاتوژن التهاب عصبی در اختلالات روان پزشکی کلاسیک منتخب را بررسی می کنیم. درک اینکه چگونه سیستمهای روانشناختی، ژنتیکی، ایمونولوژیک و سیستم عصبی ارتباط برقرار میشوند، میتوانند علائم بیماریزا را نشان دهند و به درمان جدید پیشگیری و علامتدار کمک کنند.
کلید واژه ها:
- عصب خونی،
- روان یونومونولوژی
- آستروسیت
- میکروگلایا
- سیتوکین ها
- استرس اکسیداتیو،
- افسردگی،
- اختلال وسواسی-اجباری،
- اختلال دوقطبی، اسکیزوفرنی
فهرست
معرفی
از آنجایی که اختلالات بیولوژیکی در بین بیماران مبتلا به اختلالات روانشناختی به طور فزاینده ای مشخص می شود، تمایز بین بیماری های عصبی و روان شناختی از بین می رود. علاوه بر بیماری های خود ایمنی سیستمیک همراه با تظاهرات روانپزشکی (به عنوان مثال، لوپوس) [1]، اخیرا بیماران مبتلا به روانپزشکی جدا شده حاد با آنسفالیتیدهای سیتوپلاسم اتوایمیون (جدول 1) [2-6] شناسایی شدند. این بیماران اغلب به اشتباه تشخیص داده می شوند که مبتلا به اختلالات روانپزشکی اولیه می شوند و به تأخیر افتادن شروع ایمن سازی موثر (جدول 1). علاوه بر این، شواهد رو به رشد، از نقش بیماریزایانه آنتیبادیهای ضد نورون در اختلالات روانپزشکی [7] حمایت می کند.
جداسازی اختلالات عصبی و روانپزشکی، با حمایت دکارت از «ذهن» به عنوان یک موجود هستیشناختی متمایز و با تکرارپذیری ناهنجاریهای آسیبشناسی عصبی، بر پزشکی غالب شد.19th و سده 20th 8th [9]. از آن زمان به بعد، یک مجموعه در حال گسترش از علل بیولوژیکی قابل تجدید، از neurosyphilis، سرماخوردگی، سکته مغزی، تومور، demyelination و بسیاری دیگر، باعث ایجاد علائم پیچیده ای شد که با اختلالات روانپزشکی کلاسیک همراه بود [11-XNUMX]. اخیرا، اختلالات عصبی و التهابی ایمنی در بیماران مبتلا به اختلالات روانپزشکی کلاسیک ثبت شده است.
تعدیل کننده های ایمنی محیطی می توانند علائم روانپزشکی را در مدل های حیوانی و انسان القا کنند [12-19]. به حیوانات سالم IL-1 پیش التهابی تزریق شد؟ و سیتوکین های فاکتور نکروز تومور آلفا (TNF-?) رفتار بیماری مرتبط با کناره گیری اجتماعی را نشان می دهند [12]. در انسان، تزریق اندوتوکسین با دوز پایین، جسم مخطط شکمی را غیرفعال میکند، منطقهای که برای پردازش پاداش حیاتی است، و باعث ایجاد آنهدونیا یک علامت افسردگی ناتوانکننده میشود [14]. تقریباً 45 درصد از بیماران هپاتیت C غیرافسرده و سرطانی تحت درمان با IFN-? علائم افسردگی مرتبط با افزایش سطح سرمی IL-6 را ایجاد می کند [12,15,17,18،XNUMX،XNUMX،XNUMX].
شرایط پزشکی مرتبط با ناهنجاری های التهابی و ایمنی مزمن، از جمله چاقی، دیابت، بدخیمی ها، آرتریت روماتوئید و مولتیپل اسکلروزیس، از عوامل خطر افسردگی و اختلال دوقطبی هستند [10,12,13,15,17,18،XNUMX،XNUMX،XNUMX،XNUMX،XNUMX]. مثبتهمبستگی بین این بیماری های پزشکی و بیماری روانپریشی، نشان دهنده وجود یک فرآیند التهابی گسترده تحت تأثیر مغز در میان سایر اعضای بدن است [10,19,20]. یک مطالعه مبتنی بر جمعیت 30 نشان داد که داشتن یک بیماری خودایمنی یا یک بستری قبلی برای عفونت جدی، خطر ابتلا به اسکیزوفرنی را با 29٪ و 60٪ افزایش داد [16]. علاوه بر این، ویروس هرپس سیمپلکس، توکسوپلاسما گوندی، سیتومگالوویروس و آنفلوانزا در دوران بارداری خطر ابتلا به اسکیزوفرنی را افزایش می دهد [16].
سلولی محیطی [21,22،2] (جدول 13,21) و ناهنجاری های ایمنی هومورال [23،34-43] در بیماران روانپزشکی نسبت به افراد سالم بیشتر شیوع دارد. در هر دو آزمایش آزمایشی (تعداد 36 بیمار مبتلا به اختلال افسردگی اساسی (MDD) ، n = 43 شاهد سالم) و مطالعات تكثیر (91.7 مورد MDD ، 81.3 نفر شاهد سالم) ، یك روش سرمی شامل 1 نشانگر زیستی سرم ، افراد MDD را از افراد سالم تشخیص می دهد. کنترل با حساسیت 23 and و ویژگی XNUMX؛ نشانگرهای زیستی قابل توجهی برای علائم عصبی روانپزشکی مولکول های ایمنی آلفا XNUMX آنتی تریپسین ، میلوپراکسیداز و TNF- محلول بودند؟ گیرنده دوم [XNUMX].
 ابتدا ارتباط بین autoimmunity و اختلالات روانپزشکی، از جمله: 1) لوپوس اريتماتوز سیستمی (SLE) به عنوان نمونه اولیه بیماری سیستم ایمنی بدن، بررسی می شود. 2) آنسفالیتی های autoimmune مرتبط با آنتی بادی های ضد سیناپسی و گلوتامیک اسید دکربوکسیلاز (GAD)؛ و 3) کودکان مبتلا به اختلالات اتوايميون عصبي مرتبط با عفونت استرپتوكوكي (PANDAS) و اختلال وسواسی-اجباری خالص (OCD) همراه با آنتیبادی های ضد انقباض گانگلیا / تالامال است. سپس در مورد نقش التهاب ذاتی / خود ایمنی در اختلالات روانپزشکی کلاسیک، از جمله MDD، اختلال دوقطبی (BPD)، اسکیزوفرنی و OCD بحث می کنیم.
ابتدا ارتباط بین autoimmunity و اختلالات روانپزشکی، از جمله: 1) لوپوس اريتماتوز سیستمی (SLE) به عنوان نمونه اولیه بیماری سیستم ایمنی بدن، بررسی می شود. 2) آنسفالیتی های autoimmune مرتبط با آنتی بادی های ضد سیناپسی و گلوتامیک اسید دکربوکسیلاز (GAD)؛ و 3) کودکان مبتلا به اختلالات اتوايميون عصبي مرتبط با عفونت استرپتوكوكي (PANDAS) و اختلال وسواسی-اجباری خالص (OCD) همراه با آنتیبادی های ضد انقباض گانگلیا / تالامال است. سپس در مورد نقش التهاب ذاتی / خود ایمنی در اختلالات روانپزشکی کلاسیک، از جمله MDD، اختلال دوقطبی (BPD)، اسکیزوفرنی و OCD بحث می کنیم.
اختلالات روانپزشکی همراه با Autoimmunity
لوپوس اریتماتوی سیستمیک
بین 25 تا 75 درصد از بیماران SLE درگیری سیستم عصبی مرکزی (CNS) دارند که علائم روانپزشکی معمولاً در دو سال اول شروع بیماری رخ می دهد. علائم روانپزشکی ممکن است شامل اضطراب، خلق و خوی و اختلالات روانی باشد [97]. تصویربرداری رزونانس مغناطیسی مغز (MRI) در تقریباً 42٪ موارد SLE عصبی-روانی طبیعی است [97]. میکروآنژیوپاتی و شکست سد خونی مغزی (BBB) ممکن است اجازه ورود اتوآنتی بادی ها را به مغز بدهد [97]. این آنتی بادی ها شامل P ضد ریبوزومی (مثبت در 90 درصد بیماران مبتلا به SLE روان پریشی) [1]، سلول ضد اندوتلیال، ضد گانگلیوزید، ضد dsDNA، زیرواحدهای ضد 2A/2B گیرنده های N-متیل-D-آسپارتات می باشد. NMDAR) و آنتی بادی های ضد فسفولیپید [97]. سیتوکین های پیش التهابی عمدتاً IL-6 [97]، S100B.[97]، مولکول چسبندگی داخل سلولی 1 [97] و ماتریکس- متالوپروتئیناز-9 [98] نیز در SLE بالا هستند. تظاهرات روانپزشکی SLE، بیماری Sjo?gren، سندرم Susac، واسکولیت CNS، بیماری CNS Whipple و بیماری Behc?et اخیرا مورد بررسی قرار گرفته است [1].
انسفالیتیدهای خود ایمنی عصبی روانپزشکی مرتبط با سرم ضددردی و اسید گلوتامیک دکاربوکسیلاز
آنتیبادیهای خودکار
انسفالیتیدهای خودایمن با شروع حاد تشنج لوب گیجگاهی ، ویژگی های روانپزشکی و نقص شناختی مشخص می شوند [2,3,99،108،3-1]. پاتوفیزیولوژی به طور معمول توسط آنتی بادی های هدف قرار دادن اتو آنتی ژن های سیناپسی یا داخل سلولی در ارتباط با منشا پلاستیک پارانئو یا غیرپارنوپلاستی واسطه می شود [100,108,109]. آنتی بادی های ضد سیناپسی زیر واحد های NR1 NMDAR [1،2،2] مجتمع کانال پتاسیم ولتاژ دار (VGKC) (زیر واحد Kv101,102,106 ، گلیوم غنی از لوسین غیرفعال (LGI1) و پروتئین 2 مرتبط با کنتاکتین (CASPR3)) را هدف قرار می دهند [5،4] زیر واحد های GluR6,110,111 گیرنده اسید آمینه-1- هیدروکسی-3,99,103-متیل-l-65-ایزوکسازولپروپیونیک اسید (AMPAR) [2,3،XNUMX،XNUMX] و زیر واحد BXNUMX گیرنده های B -aminobu-tyric acid B (GABABR) [XNUMX،XNUMX،XNUMX]. آنتی بادی های ضد سلولی اتوآنتی ژن های آنکرونورونال و GAD-XNUMX را هدف قرار می دهند [XNUMX،XNUMX].
التهاب همراه با آنتی بادی های ضد سیناپسی، به ویژه آنتی بادیهای NMDAR، معمولا خفیف تر از آنتی بادی های GAD یا آنتی بادی های ضد نورون مربوط به اختلالات سیستم ایمنی سیستم ایمنی یا سندرم های پارانوپلاستی [2,107] می باشند.
گرچه علائم عصبی در نهایت ظاهر می شود، تظاهرات روانپزشکی از اعتیاد به اضطراب [2,3] تا سایکوزی شبیه سازی اسکیزوفرنی [2-6]، در ابتدا می توانند ویژگی های عصبی را تحت سلطه یا پیش بروند. تا دو سوم بیماران مبتلا به آنسفالیت اتوایمیون anti-NMDAR، که در ابتدا به خدمات روانپزشکی [5] ارائه می شود. آنتی بادی های ضد سیناپسی - عوامل انسفالیتی اتوایمیون متعهد باید در تفاوت افسردگی حاد [2-6] در نظر گرفته شوند. ارائه روانپزشکی می تواند شامل MRI طبیعی مغز و مایع مغزی نخاعی (CSF)، بدون آنسفالوپاتی یا تشنج [2,3,5,6,107] باشد. ما گزارش یک مورد آنتی بادی های GAD مثبت مرتبط با بیوپسی اثبات شده التهاب عصبی، با وجود MRI مغزی و تجزیه و تحلیل CSF مغزی، که در آن بیمار ارائه شده با روان درمانی جدا شده به عنوان اسکیزوفرنی با استفاده از راهنمای تشخیصی و آماری اختلالات روانی، معیار 4th (DSM-IV) [2] علاوه بر این، آنسفالیتی های autoimmune seronegative همچنین می تواند با اختلالات روانپزشکی برجسته، ارائه تشخیص زودرس [107,112,113]. ویژگی های روانپزشکی و عصبی مرتبط با آنتی بادی های ضد سیناپسی و GAD در جدول 1 [1-6,99-108,114] خلاصه شده است.
آنتی بادی های ضد سیناپسی و GAD سرم ممکن است در بیماران مبتلا به اختلالات روانپزشکی خالص ایجاد شود [2,4,5,112,115،121،29،5،1-100]. در یک گروه احتمالی از 122 نفر که معیارهای DSM-IV برای اسکیزوفرنی را داشتند ، آنتی بادی های ضد NMDAR سرم در سه نفر پیدا شد و آنتی بادی های ضد VGKC پیچیده در یک موضوع یافت شدند [2]. با استفاده از تکنیک های حساس تر برای شناسایی آنتی بادی های ایمونوگلوبولین G (IgG) NR90 در 2 بیمار مبتلا به اسکیزوفرنی مشخص ، هیچ آنتی بادی مشخص نشد [2.78]. با این حال ، این مطالعه آنتی بادی های هدف قرار دادن زیر واحد NR95 NMDAR را ارزیابی نمی کند. مطالعات دیگر احتمال افزایش سطح آنتی بادی NR1.26 (درصد احتمال (OR) 6.14 ، فاصله اطمینان 0.012٪ (CI) 43 تا 116 ، XNUMX = P)) در افراد مبتلا به شیدایی حاد را به طور قابل توجهی افزایش داد ( n = XNUMX) ، اما در شیدایی مزمن یا اسکیزوفرنی وجود ندارد [XNUMX].
PANDAS و اختلال وسواسی-اجباری خالص مرتبط با آنتی بادی های ضد گانگلیا / تالامیک
OCD اغلب اختلالات عصبی مربوط به عقده های قاعده ای از جمله کره سیدنهام، بیماری هانتینگتون و بیماری پارکینسون را پیچیده می کند. آنتی بادی های ضد گانگلیون پایه در کره سیدنهام نقش دارند [123]. PANDAS با تشدید حاد علائم OCD و/یا تیک های حرکتی/ آوایی به دنبال عفونت استرپتوکوک بتا همولیتیک گروه A پیش درومال مشخص می شود. تصور می شود که پاتوفیزیولوژی شامل واکنش متقاطع بین آنتی بادی های ضد استرپتوکوک و پروتئین های گانگلیون پایه است [124]. همپوشانی بالینی بین PANDAS و OCD خالص یک مکانیسم علت شناسی مشترک را نشان می دهد [125].
در میان یک گروه تصادفی از 21 بیمار OCD خالص، 91.3٪ دارای گانگلیون های ضد قاعده CSF (0.05 > P) و اتوآنتی بادی های ضد تالاموس (P <0.005) در 43 کیلو دالتون [88] بودند، که به موازات ناهنجاری های عملکردی در کورتیکو-استریاتال-استریاتال است. مدارهای کورتیکویی افراد OCD [84]. مطالعه دیگری مستند کرد که 42% (21=n) از افراد مبتلا به OCD دارای اتوآنتی بادی ضد گانگلیون پایه سرم در 40، 45 و 60 کیلو دالتون در مقایسه با 2% تا 10% از افراد کنترل (0.001 = P) بودند [7]. اتوآنتی بادی های ضد گانگلیون بازال در سرم های 64 درصد از افراد PANDAS (14 نفر) در مقایسه با تنها 9 درصد (2 نفر) از گروه کنترل مثبت/OCD منفی (P<0.001) شناسایی شد [126]. یک مطالعه هیچ تفاوتی بین شیوع اتوآنتی بادی های ضد عقده های پایه در OCD (5.4٪، n = 4) در مقابل کنترل MDD (0٪) پیدا نکرد [127]. با این حال، یک محدودیت استفاده تصادفی از قشر موش و گانگلیون و قشر بازال گاو بود که ممکن است شناسایی موارد مثبت سرمی را محدود کرده باشد.
اتوآنتی ژن های عقده های پایه عبارتند از: آلدولاز C (40 کیلو دالتون)، انولاز اختصاصی عصبی/غیر عصبی (45 کیلو دالتون دوتایی) و پیروات کیناز M1 (60 کیلو دالتون) آنزیم های گلیکولیتیک عصبی که در انتقال عصبی، متابولیسم عصبی نقش دارند.
صفحه 3 از 24 و سیگنالینگ سلولی [128]. این آنزیم ها همسانی ساختاری قابل توجهی را با پروتئین های استرپتوکوک نشان می دهند [129]. آخرین مطالعه (96 OCD، 33 MDD، 17 فرد مبتلا به اسکیزوفرنی) سرم بیمار را در برابر پیروات کیناز، آلدولاز C و انولاز به طور خاص آزمایش کرد. بخش بیشتری از افراد مبتلا به OCD نسبت به گروه کنترل مثبت بودند (19.8٪ (19 = n) در مقابل 4٪ [n = 2]، 0.012 = P) [130].
با این حال، در همان مطالعه تنها یک نفر از بیماران مبتلا به OCD سرم مثبت 19 نیز دارای آنتی بادی های ضد استرپتولیسین O مثبت بود، و این نشان می دهد که در OCD خالص، ضد حساسیت آنتی بادی ضد استرپتولیسین O از وجود آنتی بادی های گانگلیوی ضد آنتیبادی جلوگیری نمی کند .
در OCD خالص، مثبت بودن سرولوژیک برای آنتیبادی های گانگلیوی ضد تالاسمی / ضد تالاسمی با افزایش سطح گلیسین CSF (0.03) [88] همراه است، که نشان می دهد که این آنتیبادی ها به هیپرگولاتاماتورژی در OCD [84,88,131] کمک می کند. بهبود OCD ناشی از عفونت با درمان های ایمنی از بیماری های آنتی بادی های [132] حمایت می کند. یک آزمایش بزرگ NIH برای ارزیابی اثربخشی ایمونوگلوبولین وریدی (IVIG) برای کودکان مبتلا به OCD آغاز شده و آنتی بادی ضد استرپتوکوک ادامه دارد (ClinicalTrials.gov: NCT01281969). با این وجود یافته های کمی بالاتر از گلوتامات CSF در بیماران مبتلا به OCD با آنتیبادی های ضد انعقادی گانگلیو / تالامال ضد انعقادی CSF نسبت به کسانی که دارای آنتیبادی های مثبت CSF هستند، نشان می دهد که مکانیزم های غیر ایمونولوژیکی ممکن است در OCD [84] نقش داشته باشند. مکانیسم های دیگر، از جمله التهاب مصنوعی سینتیکین (جدول 2)، نیز فرض می شود.
اختلالات روانپزشکی همراه با التهاب درونی
اختلالات التهاب ذاتی/خود ایمنی در برخی از بیماران مبتلا به اختلالات روانپزشکی کلاسیک رخ می دهد. ما در مورد ناهنجاری های ذاتی مرتبط با التهاب CNS از جمله آسیب شناسی گلیال، افزایش سطح سیتوکین ها، فعال شدن سیکلواکسیژناز، اختلال در تنظیم گلوتامات، افزایش سطح S100B، افزایش استرس اکسیداتیو و اختلال عملکرد BBB در MDD، BPD، اسکیزوفرنی و OCD بحث می کنیم. ما همچنین توضیح می دهیم که چگونه التهاب ذاتی ممکن است به طور مکانیکی با ناهنجاری های سنتی مونوآمینرژیک و گلوتاماترژیک گزارش شده در این اختلالات مرتبط باشد (شکل 1 و 2). نقش درمانی عوامل ضدالتهابی در اختلالات روانپزشکی نیز بررسی شده است.
 آسیب شناسی Astroglial و Oligodendroglial
آسیب شناسی Astroglial و Oligodendroglial
Astroglia و Oligodendroglia برای عصب ضروری هستند سوخت و ساز بدن هموستاز، رفتار و عملکردهای شناختی بالاتر [54-56,133،136-2]. آستروگلیا ساکن عادی انرژی و حمایت تغذیه ای را برای نورون ها فراهم می کند، انتقال عصبی سیناپسی را تنظیم می کند (شکل 134,136,137)، سیناپتوژنز، جریان خون مغزی، و یکپارچگی BBB را حفظ می کند [XNUMX]. الیگودندروگلیا بالغ انرژی و حمایت تغذیه ای را برای نورون ها فراهم می کند و یکپارچگی BBB را حفظ می کند و ترمیم آکسون را تنظیم می کند.و مولکولی از مواد ماده سفید که باعث اتصال بین و نیمکره ای می شوند [54-56]. هر دو astroglia و oligodendroglia تولید سیتوکین های ضد التهابی است که می تواند تنظیم التهاب مضر [52,55].
در MDD، از دست دادن astroglial یک نتیجه متوالی پس از مرگ در ناحیه های کاربردی مرتبط، از جمله قشر مفصلی قشر، قشر پیش فونتیال، آمیگدال و ماده سفید [35-38,42-46,55,138-147]، با استثنای کمی [42,43] است. مطالعات بعد از مرگ نشان داد که تراکم آستروگلالی مثبت فیبریلیال پرولیفراتیک گلایال (GFAP) در غلظت کورتکس پیش فونتیال [37,38] و آمیگدال [36] نشان داده شده است. یک تجزیه پروتئومیکای بزرگ از cortices فرونتال از بیماران افسرده نشان دهنده کاهش معنی داری در سه ایزوفرم GFAP [39] بود. اگر چه در یک مطالعه که نشان داد هیچ کاهش قابل توجهی از گلیال گزارش نشده است، تجزیه و تحلیل زیر گروه نشان دهنده کاهش قابل توجه (75٪) در تراکم آستروگلالی مثبت GFAP مثبت در افراد مورد مطالعه کمتر از 45 سن [35]. مطالعه ی مورفومتریک به طور مشابه هیچ تغییری در تراکم گلای در مغز MDD دیر هنگام [148] نشان نداد. ما فرض می کنیم که فقدان آشکار از دست دادن astroglial در بیماران مبتلا به MDD ممکن است منعکس کننده astrogliosis ثانویه [35] است که با سن بالاتر از [42,50] به جای یک منفی واقعی است.
مطالعات حیوانی با مطالعات انسانی که از دست دادن آستروگلیال را در MDD نشان می دهد، مطابقت دارد. موشهای ویستار-کیوتو که رفتارهای شبه افسردگی از خود نشان میدهند، کاهش تراکم اختروگلیال را در همان مناطقی که در انسان مشاهده شد نشان دادند [40]. تجویز عامل سمی آستروگلیال، L-alpha-aminoadipic acid، علائمی شبیه افسردگی را در موشها ایجاد میکند که نشان میدهد از دست دادن آستروگلیال در MDD بیماریزا است [41].
مطالعات پس از مرگ افراد مبتلا به MDD نشان دهنده کاهش تراکم الیگودندرگلیال در قشر پیش و گردن و آمیگدال [54-57,66] است که ممکن است با تغییرات MHC مغزی مغزی در بعضی از بیماران MDD [57] ارتباط داشته باشد. با این حال، اختلالات میکروویروس همچنین ممکن است به این تغییرات کمک کند [57].
در BPD، برخی از مطالعات نشان می دهد که از دست دادن جالب توجه [138,143,149,150]، در حالی که دیگران [37,44-46] را نشان نمی دهند. این یافته های ناسازگار ممکن است ناشی از عدم کنترل: 1) درمان با تثبیت کننده های خلق باشد، زیرا تجزیه و تحلیل بعد از وقوع برخی از مطالعات نشان می دهد کاهش قابل توجهی در کاهش گلیال تنها پس از کنترل برای درمان با لیتیوم و اسید والپروئیک [46]؛ 2) فرم های خانوادگی BPD، به عنوان کاهش ضربان قلب در میان بیماران BPD با سابقه خانوادگی قوی [143] برجسته است؛ و / یا، 3) حالت غالب افسردگی در مقابل شیدایی است، زیرا در MDD [35-38,42-46,55,138-147] ضایعات گلیال مکرر است. این که آستروگلیا یا الیگودندروگلیا اکثریت از دست رفتن گلیال را تشکیل می دهند، مشخص نیست؛ در حالی که تجزیه پروتئومیک نشان دهنده کاهش قابل توجهی در یک ایزوفرم GFAP astroglial [39] بود، چندین مطالعات بعد از مرگ هم بدون تغییر [36,37] یا کاهش بیان GFAP-مثبت آستروگلیال در قشر اورترتیل فورناتال [47] یا کاهش تراکم اولیگوندندرگلالی [54- 56,58,59]
در اسکیزوفرنیا، از دست دادن آستروگلیس یک یافته ناسازگار است [48,150]. در حالی که برخی مطالعات نشان دادند که از دست دادن وزن قابل توجهی نیست [42,50,51]، چندین نفر دیگر کاهش تراکم آستروگلیس [37,38,43,44,48,49,151] و کاهش قابل توجهی در دو ایزوفرم GFAP [39] را نشان دادند. یافته های غیرقابل انکار ممکن است از: 1 باشد) همبودی MDD، که اغلب همراه با از دست رفتن گلایسین است؛ 2) تغییرات سن، به عنوان بیماران مسن افزایش astroglia مثبت GFAP [35,42,50]؛ 3) منطقه ای [150] و تغییرات لایه های قشر [48]؛ 4) درمان با داروهای ضد پریشیوتیک، به عنوان مطالعات تجربی نشان می دهد هر دو کاهش یافته [152] و افزایش [153] تراکم آستروگلالی مرتبط با درمان آنتیس سایکوتی مزمن [70]؛ و 5) وضعیت بیماری (مثلا رفتار خودکشی در مقابل رفتار غیر خودکشی) [154]. مطالعات پس از مرگ، ضایعات الیگودندرگلالیس [54,56,60-65,148,155,156]، به ویژه در قشر پیشانی، قشر جلویی قدام و هیپوکامپ [148] ثبت شده است. معاینه Ultrastructural در منطقه پیش فونتیال، فیبرهای مینولین غیر طبیعی را در مواد خاکستری و سفید نشان می دهد؛ هر دو سن و مدت بیماری به طور مثبت با ناهنجاریهای ماده سفید [157] ارتباط داشتند.
در مقایسه با اختلالات نوروژنیک، که معمولا با ترویج آستروگلیال [136] مرتبط است، اختلالات روانپزشکی در عوض با تراکم آستروگلیال یا 138 کم یا بدون تغییر مرتبط است. فقدان تراکم گلیال در ابتلا به اختلالات روانپزشکی اولیه [44,138] ممکن است منجر به کند شدن روند پیشرفت دژنراتیو در بیماری های روانپزشکی شود [138].
ما فرض می کنیم که تغییرات دژنراتیو مرتبط با اختلالات روانپزشکی بسیار ظریف بوده و به اندازه کافی شدید نیستند تا عوامل رونویسی درون سلولی آستروگلیایی را تنظیم کنند که بطور طبیعی آستروگلیوز را تنظیم می کنند ، از جمله فعال کننده مبدل سیگنال رونویسی 3 و فاکتور هسته ای کاپا B (NF-؟ B) [136].
در حالی که اکثر مطالعات پس از مرگ متمرکز بر تغییر چگالی گلیال در MDD، BPD و اسکیزوفرنی بودند، برخی دیگر تغییرات مورفولوژی سلولهای گلایلی را با یافته های مخلوط توصیف کردند. در MDD و BPD، اندازه glial یا افزایش یا بدون تغییر [55] است. یک مطالعه کاهش اندازه گلیال در BPD و اسکیزوفرنیا را کاهش داد، اما نه در MDD [43]. یک مطالعه پس از مرگ مبتلایان افسرده که خودکشی کرده اند، افزایش اندازه آستروگلالی در ماده سفید سفید قدام یافته، اما نه در قشر [158]. یک مطالعه در افراد مبتلا به اسکیزوفرنیک اندازه لگن آستروگلیال را در لایه V قشر پیشانی قدامی دور کمر کاهش داد، با وجود آن که تراکم آستروگلالی دو برابر بیشتر از کنترل در همان لایه است [48]. نتایج مخلوط ممکن است تا حدی مطالعات پیشین تغییرات گلیال در بیماری های روانپزشکی را نشان دهد که آسترولیا را در مقابل الیگودندرگلیا مشخص نکرد [148].
از دست دادن گلیال در بیماری های روانپزشکی ممکن است از طریق مکانیسم های مختلفی به التهاب عصبی کمک کند، از جمله سطوح غیر طبیعی سیتوکین (به بخش سیتوکین مراجعه کنید)، متابولیسم گلوتامات نامنظم (به بخش گلوتامات مراجعه کنید)، افزایش پروتئین S100B (به بخش S100B مراجعه کنید).و عملکرد BBB را تغییر دهید (نگاه کنید به بخش مانع مغز خون)، که منجر به نقص شناختی و رفتاری [44,45,54,133,159] می شود.
هیستوپاتولوژی میکروگلیال
Microglia سلول های ایمنی سلولی CNS است. آنها مراقبت های ایمنی مداوم را انجام می دهند و هرس سیناپسی رشد [160,161] را تنظیم می کنند. آسیب CNS باعث می شود میکروگلیاسیون استحکام کششی را به سلولهای آمیبوئیدی فاگوسیتیک شکل گرفته و به شکل ماکروفاژ فعال فعال کرده و به سمت محل آسیب در طی شبیه سازی های شیمیایی (یعنی فعال سازی و تکثیر میکروگلیا (MAP)) [161] مهاجرت می کنند. سلول های میکروگلالی انسانی NMDAR را منتشر می کنند که ممکن است MAP را منجر به آسیب های عصبی [162] شود.
در MDD، BPD و اسکیزوفرنیا، نتایج مطالعات بعد از مرگ در بررسی حضور MAP مخلوط می شوند. مطالعات پس از مرگ نشان داد که تنها یک مورد از پنج مورد MDD [67] MAP را افزایش می دهد. در بعضی از بیماران مبتلا به اختلال BPD، میکرولیمی های ضد میکروبی مثبت ضد انعقاد لکوستیک انسانی، که در فرایند ضخیم دیده شده اند، در قشر جلویی [69] ثبت شد. در اسکیزوفرنیا، در حالی که برخی مطالعات MAP را نسبت به کنترل افزایش دادند، برخی دیگر تفاوت بین گروه های [22,67,70] را نشان دادند. در یک مطالعه پس از مرگ، ارزیابی MAP در MDD و BPD؛ تراکم سلولهای میکروگلالیال اسید مثبت چینی سینوولات در زیر قاعدگی افزایش می یابد و قشر ناحیه قدام متوسط قدام MDD و BPD که خودکشی را نسبت به کنترل [53] انجام دادند. آنالیز پسا-hoc نشان داد که این افزایش MAP تنها به MDD و نه BPD مربوط می شود، از آنجایی که رنگ آمیزی ایمنی با میکروگلایلی در افراد MDD به طور قابل توجهی بیشتر از گروه زیر BPD در هر دو سینه انقباض زردی و قدام میانی بود تراکم میکروگلایز در هر دو گروه BPD و گروه کنترل [53] مشابه بود. مطالعه در مقایسه با هر سه اختلال (نه MDD، پنج BPD، چهارده اسکیزوفرنی، ده کنترل سالم) تفاوت معناداری در تراکم میکروگلالی در چهار گروه [68] نداشت.
این نتایج مخلوط ممکن است به نشانگرهای ایمنولوژیک متغیر microglial که در میان مطالعات مختلف [70] استفاده می شود و / یا عدم کنترل شدت بیماری [22,53,68] استفاده شود. به طور قابل توجهی، سه مطالعه پس از مرگ MDD و اسکیزوفرنیک، یک همبستگی مثبت قوی میان MAP و خودکشی در قشر مفصلی قدام و تالاموس Medidorsal، مستقل از تشخیص روانپزشکی [22,53,68] بود. بنابراین، MAP ممکن است یک حالت باشد، نه یک شاخص مشخص برای MDD و اسکیزوفرنیا.
در OCD، مدل های حیوانی نشان می دهد که اختلال عملکرد و کاهش برخی از فنوتیپ های میکروگلیال، مانند کسانی که ژن Hoxb8 را بیان می کنند که فاکتور رونویسی homeobox را رمزگذاری می کند، می تواند به رفتار رفتار OCD [71,72] منجر شود.
موش های نابود Hoxb8 رفتار و گرایش بیش از حد مراقبت کننده را در ارتباط با کاهش تراکم میکروگلیال [71,72] نشان می دهند. این رفتار گرمی بیش از حد شباهت به ویژگی های رفتاری OCD انسان است. تزریق Hoxb8 در موش های بالغ Hoxb8 از بین بردن میکروگلیال و تغییر رفتار طبیعی [71,72] را از بین می برد. نقش این فنوتیپهای میکروگلالی در OCD انسان مشخص نیست.
داده های تجربی نشان می دهد که MAP شامل فنوتیپ های مضر و عصبی متفاوتی است (شکل 2). Microglia مضر سازنده ترکیب اصلی بافت سازگاری II (MHC-II) را بیان نمی کند و بنابراین نمی تواند به عنوان سلول های ارائه دهنده آنتی ژن (APC) [163,164] عمل کند؛ آنها 17,69,165 را از طریق تولید سیتوکین پروتئین التهابی، سیگنالینگ سیتواستیک نیتریک اکسید [17,166]، ترویج بیان سیکلواکسیژناز گلیال و BBB-peritsite / endothelial cyclooxygenase-2 (COX-2) [167]، ایجاد القاء ترشح S100B در astroglial (به بخش S100B) و انتشار گلوتامات microglial [17,136,168,169]. Microglia مضر همچنین پروستاگلاندین E-2 (PGE-2) را ترشح می کند که باعث تولید پروتئین های التهابی سیتوکین ها می شود که به نوبه خود باعث افزایش سطح PGE-2 در یک چرخه ی فیدر [29] می شود. علاوه بر این، PGE-2 بیان COX-2 را تحریک می کند، که مبادله اسید آراکیدونیک با PGE-2 را متوقف می کند، و یک چرخه دیگر [29] را فراهم می کند.
میکروگلایزرهای محافظتی عصبی با کنتراست میتوانند: 1) MHC-II را در in vivo و in vitro [163,166] بیان کنند و به عنوان APC معکوس (شکل 2) [163,164,166] عمل کنند؛ 2) ترشح سیتوکین های ضد التهابی [17]، عامل فاکتور نوروتروفیک [17] و فاکتور رشد مانند انسولین 1 [166] را بهبود می بخشد و عضلات عضلانی را محدود می کند. و 3) حمل و نقل اسید آمینه اکسیدان (2) (EAAT2) را انجام می دهد که از گلوتامات اضافی سلولی خارج [163,166] حذف می کند و از خود ایمنی لنفوسیتی T (عضلانی) (شکل 2) [163,164] محافظت می کند. با این حال، برای تأیید نقش مؤثر microglia محافظتی عصبی به اختلالات روانپزشکی در انسان، مطالعات بیشتری لازم است.
در شرایط آزمایشگاهی مطالعات حیوانی نشان می دهد که نسبت میکروگلیای مضر در برابر محافظت از نور می تواند تحت تأثیر خالص مکانیسم های ضد نظارتی التهابی قرار گیرد [15,74,164,166،4،25،3]. این مکانیسم ها شامل تعدادی از سلولهای نظارتی محافظت نورونی CD1 + CD15,74,164,166 + FOXP2 + T ((T regs) شکل 166) [166،XNUMX،XNUMX،XNUMX] و سطح سیتوکین مغز است. کم IFN-؟ سطح ممکن است میکروگلیا محافظت از نور را تقویت کند (شکل XNUMX) [XNUMX] ، در حالی که سطح بالا می تواند فنوتیپ مضر را تقویت کند [XNUMX].
نقش سیتوکین ها
سیتوکین های پیش التهابی شامل IL-1?، IL-2، IL-6، TNF-? و IFN-?. آنها عمدتاً توسط میکروگلیاها، لنفوسیتهای Th1 و مونوسیتها/ماکروفاژها با فنوتیپ M1 ترشح میشوند (شکل 1) [15,170]. آنها التهاب مضر را ترویج می کنند. سیتوکین های ضد التهابی عبارتند از IL-4، IL-5 و IL-10. آنها عمدتاً توسط اخترگلیا ترشح می شوندلنفوسیتهای Th2، T regs و مونوسیتهای / ماکروفاژهای فنوتیپ M2 [15,52,74]. آنها می توانند التهاب مضر [15,74] را با تبدیل پروتئین M1-phenot-proinflammatory به فنوتیپ M2 [15] ضد عفونی کننده مفید و به طور بالقوه با پیشبرد فنوتیپ میکروگلیا [15,17,74,163,166] عصبی محافظت کنند. نقش سیتوکین های ضد التهابی / ضد التهابی در اختلالات روانی با چندین شواهد (شکل 1، جدول 2) [15,17,29,52,74] پشتیبانی می شود.
در MDD ، جدیدترین متاآنالیز (29 مطالعه ، 822 MDD ، 726 شاهد سالم) سیتوكین های پیش التهابی سرم تأیید كرد كه گیرنده های محلول IL-2 ، IL-6 و TNF-؟ سطح در MDD (نشانگرهای صفت) افزایش می یابد [91] ، در حالی که ، IL-1؟ ، IL-2 ، IL-4 ، IL-8 و IL-10 ، از نظر آماری با شاهد تفاوت ندارند [91]. در یک مطالعه اولیه سیتوکین مقایسه زیر گروه های MDD (47 خودکشی- MDD ، 17 غیر خودکشی MDD ، 16 کنترل سلامت) ، هر دو سرم IL-6 و TNF-؟ به طور قابل توجهی بالاتر بود ، در حالی که سطح IL-2 در افراد MDD که نسبت به هر دو گروه خودکشی کردند ، به طور قابل توجهی پایین تر بود [96]. این یافته نشان می دهد که IL-6 و TNF-؟ همچنین نشانگرهای حالت MDD هستند [96]. کاهش سطح IL-2 سرم در ارتباط با رفتار حاد خودکشی ممکن است نشان دهنده افزایش اتصال به گیرنده تنظیم مجدد آن در مغز باشد. به موازات متاآنالیز فوق الذکر که نشان دهنده افزایش گیرنده IL-2 محلول در MDD است [91]. مطالعات بررسی اهمیت بالینی سیتوکین ها در MDD نشان داد که سطح سیتوکین سرم در دوره های افسردگی حاد افزایش می یابد [171,172،17] و پس از درمان موفقیت آمیز با داروهای ضد افسردگی [29] و الکترو تشنج [XNUMX] عادی می شود. این یافته ها نقش بیماریزا احتمالی سیتوکین ها را نشان می دهد.
در BPD ، تغییرات سایتوکاین سرم در یک بررسی اخیر خلاصه شد. TNF-؟ ، IL-6 و IL-8 در طی مراحل شیدایی و افسردگی افزایش می یابد ، در حالی که IL-2 ، IL-4 و IL-6 در طی شیدایی افزایش می یابد [92]. مطالعات دیگر نشان داد که سرم IL-1؟ و سطح گیرنده IL-1 از نظر آماری با شاهد سالم تفاوت ندارد [92] ، اگرچه مطالعات بافتی افزایش سطح IL-1 را ثابت کرده است؟ و گیرنده IL-1 در قشر پیشانی BPD [69].
در اسکیزوفرنی، نتایج مطالعاتی که ناهنجاریهای سیتوکین را بررسی میکنند متناقض هستند (جدول 2). در حالی که برخی از مطالعات هم کاهش پیش التهابی سرم (IL-2, IFN-?) و هم افزایش سیتوکین های ضد التهابی سرم و CSF (IL-10) را نشان دادند [52]، برخی دیگر افزایش سیتوکین های پیش التهابی و ضد التهابی سرم را با غالب نوع پیش التهابی یافتند [22,173,174]. ]. یک متاآنالیز سیتوکین (62 مطالعه، 2,298 اسکیزوفرنی، 858 فرد سالم) سطوح افزایش یافته آنتاگونیست IL-1R، sIL-2R و IL-6 را نشان داد [174]. با این حال، این مطالعه استفاده از داروهای ضد روان پریشی را که تصور می شود تولید سیتوکین های پیش التهابی را افزایش می دهد، در نظر نگرفت [52]. یک متاآنالیز جدیدتر سیتوکین (40 مطالعه، 2,572 اسکیزوفرنی،4,401 کنترل کننده) که به عنوان ضد روان پریشی شناخته می شوند ، دریافتند که TNF- ؟، IFN- ؟، IL-12 و sIL-2R بطور مداوم در اسکیزوفرنی مزمن مستقل از فعالیت بیماری افزایش می یابند (نشانگرهای صفت) ، در حالی که IL-1 ؟، IL-6 و فاکتور رشد بتا با فعالیت بیماری (نشانگرهای حالت) ارتباط مثبت دارد [173]. کشت سلولی سلولهای تک هسته ای خون محیطی (PBMC) به دست آمده از بیماران اسکیزوفرنیک سطح بالاتری از IL-8 و IL-1 را تولید می کند؟ خود به خودی و همچنین پس از تحریک توسط LPS ، نقش مهمی در سلولهای منوسیت / ماکروفاژها در آسیب شناسی اسکیزوفرنی نشان می دهد [175].
در OCD ، نتایج حاصل از یک نظرسنجی تصادفی از سیتوکینهای سرما و CSF و مطالعات PBMC تحریک شده با LPS ، متناقض است [93-95,176،179-34]. همبستگی بین OCD و چندشکلی عملکردی در ناحیه پروموتر TNF- وجود دارد؟ ژن [180] ، اگرچه مطالعات کم مصرف این ارتباط را تأیید نمی کند [93,176]. بنابراین ، نتایج مخلوط حاصل از مطالعات مستند افزایش یا کاهش TNF-؟ سطح سیتوکین [178،XNUMX-XNUMX] ممکن است شامل تغییر متغیر آنها از زیر مجموعه افراد OCD با این چندشکلی خاص در گروه های آنها باشد.
قطبش پاسخ سیتوکین در افسردگی اساسی و اسکیزوفرنی
فنوتیپ های پاسخ سیتوکین بر اساس عملکردهای ایمنی که تنظیم می کنند به عنوان Th1 پیش التهابی (IL-2، IFN-?) یا Th2 ضد التهابی (IL-4، IL-5، IL-10) طبقه بندی می شوند. در حالی که سیتوکین های Th1 ایمنی سلولی علیه آنتی ژن های درون سلولی را تنظیم می کنند، سیتوکین های Th2 ایمنی هومورال را علیه آنتی ژن های خارج سلولی تنظیم می کنند [29,52،1]. سیتوکین های Th1 توسط لنفوسیت های Th1 و مونوسیت های M2 تولید می شوند در حالی که سیتوکین های Th2 توسط لنفوسیت های Th2 و مونوسیت های M29,52 تولید می شوند [1،2]. در مغز، میکروگلیاها عمدتاً سیتوکین های Th29,52 را ترشح می کنند، در حالی که آستروگلیا عمدتاً سیتوکین های Th1 را ترشح می کنند [2،1]. نسبت متقابل سیتوکینهای Th2: Th1، از این پس «الاکلنگ Th2-Th1» تحت تأثیر نسبت میکروگلیای فعال شده (Th2 اضافی) به آستروگلیا (Th29,163,166 اضافی) و تأثیر متقابل بین سلولهای T فعال و سطوح بیش از حد گلوتامات CNS است که ما فرض کردیم. به نفع پاسخ ThXNUMX (شکل XNUMX) [XNUMX].
ناپایداری Th1-Th2 ممکن است با تغییر آنزیم های آن [21,52] بر متابولیسم تریپتوفان تاثیر بگذارد و در نتیجه تغییر کاتابولیسم تریپتوفان را نسبت به کینورینین (KYN) و کاتابولیسم KYN نسبت به هر دو متابولیت پایین تر آن را تغییر دهد؛ اسید کینولینیک microglia که واکنش Th1 یا اسید کینورنیک استروگلالی (KYNA) (شکل 1) است که واکنش Th2 است [21,29,170].
آنزیم های متابولیسم تریپتوفان تحت تاثیر الاکلنگ Th1-Th2 عبارتند از (شکل 1): ایندول آمین 2,3،5-دی اکسیژناز (IDO) بیان شده توسط میکروگلیا و آستروگلیا، آنزیم های محدود کننده سرعت که واسطه تبدیل تریپتوفان به KYN و سروتونین به XNUMX- هستند. اسید هیدروکسی اندول استیک[21,29،3]. کینورنین 3-مونواکسیژناز (KMO)، که صرفاً توسط میکروگلیا بیان می شود، آنزیمی محدود کننده سرعت است که KYN را به 3-هیدروکسی کینورنین (21,29-OH-KYN) تبدیل می کند، که بیشتر به اسید کینولینیک متابولیزه می شود [2,3،XNUMX]. تریپتوفان-XNUMX،XNUMX-دیاکسیژناز (TDO)، که تنها توسط آستروگلیا بیان میشود، آنزیم محدودکننده سرعت است که تبدیل میکند.تریپتوفان به KYN [21,29]. Kynurenine aminotransferase (KAT)، که عمدتا در فرآیندهای astroglial بیان می شود، آنزیم محدود کننده سرعت است که تبدیل KYN را به KYNA [21,29] می دهد.
سیتوکین های Th1 IDO و KMO میکروگلیال را فعال می کنند و کاتابولیسم میکروگلیال KYN را به سمت کینولینی تغییر می دهند.سنتز اسید (NMDAR agonist)، در حالی که سیتوکین های Th2 غیر فعال کردن میکروگیلال IDO و KMO، تغییر کاتابولیسم KYN آستروگلالی به سنتز KYNA (آنتاگونیست NMDAR) (شکل 1) [21,29] را به KOA منتقل می کند.
ایمونوفنوتیپ های غالب Th1 و Th2 به ترتیب برای MDD و اسکیزوفرنی بر اساس الگوهای سیتوکین های محیطی به جای CNS پیشنهاد شده اند [52,173]. ما معتقدیم که الگوهای سیتوکین های محیطی نشانگرهای جایگزین غیرقابل اعتمادی هستند که در CNS قرار دارند. در واقع، سطوح سیتوکین محیطی را می توان تحت تأثیر بسیاری از متغیرهای خارج از CNS قرار داد، که به طور مداوم در چندین مطالعه سیتوکین های محیطی کنترل نمی شوند، از جمله: 1) سن، شاخص توده بدن، داروهای روانگردان، سیگار کشیدن، استرس و نوسانات شبانه روزی. 2) تأثیرفعالیت بیماری / وضعیت تولید سنتز سیتوکینهای منتخب [95,173،3]. و 52) اثرات عوامل روانگردان بر تولید سیتوکین ها [181]. نیمه عمر کوتاه و گردش سریع سایتوکاین های سرم [18] (به عنوان مثال ، 182 دقیقه برای TNF-؟ [60] در مقابل 10 دقیقه برای IL-183 [XNUMX]) ، ممکن است قابلیت اطمینان در تفسیر آنها را محدود کند سطح از نمونه گیری تصادفی سرم اندازه گیری شد.
در MDD، توافق نظر وجود دارد که پاسخ ایمونوفنوتیپ Th1 پیش التهابی غالب است (جدول 2) [17,29،53]. سطوح بالای کینولینیک اسید در مغزهای MDD پس از مرگ [1]، نشان دهنده وجود یک پاسخ Th1 تنظیم شده است (شکل 21,29) [184،XNUMX]. اسید کینولینیک CNS بالا میتواند آپوپتوز با واسطه هجوم کلسیم در آستروگلیا انسانی را ترویج کند [XNUMX]، که به طور فرضی ممکن است این بیماری را کاهش دهد.پاسخ Th2 حاصل از Astroglia [29]، توزیع Th1 در مقابل Th2 تعادل مناسبی را به نفع پاسخ میکروگیلال Th1. Hyoserotonergia CNS [29] پشتیبانی بیشتری را به پاسخ اضافی Th1 اضافه می کند که نشان می دهد که سنتز سروتونین CNS [185] را کاهش می دهد و باعث تضعیف آن (شکل 1) [21,29] می شود.
CNS hyperglutamatergia همچنین ممکن است در پاسخ اضافی Th1 در مغز (شکل 2) کمک کند. مطالعات in vitro نشان می دهد که لنفوسیت های ترشحی محیطی به طور متناوب بیانگر گیرنده متولد شده متابوتروپیک گلوتامات 5 (mGluR5) [164] است که اتصال آن به گلوتامات مهار انتشار IL-6 لنفوسیتیک است و در نتیجه آن سلول تکثیر سلولی T-effector [164] را کاهش می دهد. لنفوسیت های T فعال شده، اما لنفوسیت های T در حالت استراحت نمی توانند از BBB [37] عبور کنند.
داده های تجربی نشان می دهد که فعل و انفعال بین گیرنده های سلول T لنفوسیت های T فعال شده و سلول های ارائه دهنده آنتی ژن همزاد آنها می تواند mGluR5 را کم تنظیم کرده و عبارات mGluR1 را القا کند [164]. در مدل های حیوانی ، اتصال گلوتامات اضافی به گیرنده های mGluR1 لنفوسیتی باعث تولید سیتوکین های Th1 ، از جمله IFN-؟ [164]
ما فرض می کنیم که در برخی از بیماران MDD ، به موازات داده های تجربی [164] ، اتصال بیش از حد گلوتامات CNS به گیرنده های mGluR1 لنفوسیتی ناشی از آن ممکن است به یک پاسخ Th1 اضافی ، از جمله IFN- کمک کند؟ (شکل 2). ما حدس می زنیم که IFN-؟ در مقدار کمی ، مشابه اثرات in vitro آن بر میکروگلیا [166] ، ممکن است باعث بیان میکروگلای MHC-II و EAAT2 [163,166،163,164,166] شود ، به میکروگلیا اجازه می دهد تا به عنوان سلولهای ارائه دهنده آنتی ژن مرتبط عمل کند و عملکرد جذب مجدد گلوتامات را فراهم کند [163,166،163,164,166،1] در نتیجه میکروگلیای مضر را به فنوتیپ محافظ نورونی [2،XNUMX] تبدیل می کند که در از بین بردن گلوتامات خارج سلولی اضافی شرکت می کنند [XNUMX،XNUMX،XNUMX]. بنابراین ، ما همچنین فرض می کنیم که پاسخ بیش از حد ThXNUMX در زیرگروه های بیماران MDD یک شمشیر دو لبه است ، التهاب مضر را تقویت می کند و به عنوان مکانیزم ضد نظارتی مفیدی عمل می کند که ممکن است سمیت عصبی مربوط به گلوتامات را محدود کند (شکل XNUMX).
در اسکیزوفرنی، در حالی که برخی از مطالعات سیتوکین محیطی غلبه یک فنوتیپ/پاسخ ایمنی Th2 ضد التهابی را نشان می دهد [52]، برخی دیگر این را رد می کنند [173,174]. با این حال، ما با نویسندگانی که فرض کردند پاسخ Th2 فنوتیپ غالب در اسکیزوفرنی است [52] موافق هستیم. افزایش سطح مغز، CSF و سرمی KYNA [21,52،2] نشان دهنده کاهش IDO و KMO میکروگلیال است که تابعی از پاسخ Th1 است که کاتابولیسم KYN اختر گلیال را به سمت سنتز KYNA تغییر می دهد (شکل 21,52) [73،2]. کاهش فعالیت KMO و بیان mRNA ژن KMO در مغزهای اسکیزوفرنی پس از مرگ [1] با پاسخ Th2 اضافی مطابقت دارد (شکل 21,76). افزایش شیوع ناهنجاری های ایمنی هومورال با واسطه ThXNUMX در زیر گروه های بیماران اسکیزوفرنی که با افزایش تعداد سلول های B مشهود است [XNUMX،XNUMX]، افزایش یافته است.تولید اتوآنتی بادیها از جمله آنتیبادیهای ضد ویروسی [76] و افزایش ایمونوگلوبولین E [52] پشتیبانی بیشتری از فرضیه غالب بودن پاسخ Th2 میافزاید.
التهاب عصبی و بی نظمی گلوتامات CNS
گلوتامات واسطه شناخت و رفتار [186] است. سطح گلوتامات سیناپتیک توسط EAAT های گلیال و عصبی وابسته به سدیم وابسته به سدیم تنظیم می شود، یعنی سیستم XAG مسئول جذب گلوتامات / آزاد سازی آسپارتات (137,164) و سیستم ضد عفونی کننده گلوتامات آستروگلیال / سیستین (Xc-) مسئول انتشار ژلوتامات / سیستین [164] است. Astroglial EAAT1 و EAAT2 بیش از 90 درصد جذب دوباره گلوتامات [79] را فراهم می کنند.
التهاب عصبی می تواند متابولیسم گلوتامات و عملکرد حمل کننده های آن [15,29,187,188] را ایجاد کند، باعث ایجاد اختلالات شناختی، رفتاری و روانی می شود [15,21,29,79,186,188,189]. اختلالات عملکرد / بیان و متابولیسم گلوتامات در MDD، BPD، اسکیزوفرنی و OCD در جدول 2 خلاصه می شود.
در MDD، شواهدی وجود دارد که نشان می دهد hyperglutamatergia قشر (جدول 2). سطوح کلسترول گلوتامات با شدت علائم افسردگی همبستگی مثبت داشت و دوره پنج هفته ای ضد افسردگی ها باعث کاهش غلظت گلوتامات سرم [85,86] شد. یک دوز کتامین، یک آنتاگونیست قوی NMDAR، می تواند MDD مقاوم در برابر حرارت را برای یک هفته [17,21,29,85] تغییر دهد. سطوح بالای گلوتامات CNS می تواند باعث التهاب مزمن عصبی - [163,164,188] شود، از جمله پاسخ Th1 ضد التهاب (شکل 2) [164].
شواهد آزمایشگاهی محدود نشان می دهد که التهاب / سیتوکین های پیش التهابی می توانند از طریق چندین مکانیسم بالقوه ، سطح گلوتامات CNS [188] را در یک چرخه تغذیه جلو افزایش دهند: عملکرد جذب مجدد 1) سیتوکین های پیش التهابی می توانند سنتز اسید کینولینیک میکروگلیا را افزایش دهند [15,17,168] ، که به طور آزمایشی نشان داده شده است برای ترشح گلوتامات سیناپتوزومی [45,137،2،53،15,17,29,190] 3) افزایش COX-2 / PGE-2 و TNF-؟ سطح می تواند هجوم کلسیم ایجاد کند [137] ، که ، بر اساس داده های in vitro ، ممکن است گلوتامات astroglial و ترشح D-serine را افزایش دهد [191]. و 4) میکروگلیا فعال می تواند بیانگر سیستم های اضافی Xc-antiporter باشد که باعث رهاسازی گلوتامات می شوند [164,192،XNUMX].
در اسکیزوفرنی، هیپوگلوتامترژی قشر پیشپیشانی [87,90,193,194،2،5،1] (جدول 28) و کاهش عملکرد NMDAR یافت میشود [647]. متاآنالیز اخیر طیفسنجی تشدید مغناطیسی H608 (MRS) (90 مطالعه، 21,52 اسکیزوفرنی، 2 کنترل) کاهش گلوتامات و افزایش سطح گلوتامین را در قشر فرونتال داخلی تایید کرد [1]. نقش کمک کننده التهاب در هیپوگلوتامترژی ثابت نشده است. افزایش سنتز KYNA در مغزهای اسکیزوفرنی [1،7]، که معمولاً تابعی از پاسخ ThXNUMX است (شکل XNUMX)، می تواند زیرواحد NRXNUMX NMDAR و آلفا XNUMX نیکوتین را مهار کند.گیرنده استیل کولین (؟ 7nAchR) [195] ، منجر به کاهش عملکرد NMDAR و کاهش انتشار گلوتامات با واسطه؟ 7nAchR می شود [195].
در BPD و OCD، داده ها نشان می دهد که hyper-glutamatergia کورتیک CNS در هر دو اختلال (جدول 2) [78,84,88,131]. سهم التهاب (BPD و OCD) و آنتیبادیهای خودکار (OCD) [7,77,84,88,130] در افزایش سطح گلوتامات CNS نیازمند بررسی بیشتر است.
نقش S100B
S100B یک پروتئین 10 کیلو دالتونی متصل به کلسیم است که توسط سلولهای آستروگلیا ، الیگودندروگلیا و شبکه کوروئید اپندیمال تولید می شود [196]. این اثرات خود را بر روی سلولهای عصبی و گلیای اطراف از طریق گیرنده برای محصول نهایی گلیاس پیشرفته واسطه می کند [196]. سطح S100B خارج سلولی نانومولار اثرات نوروتروفیک مفیدی را فراهم می کند ، آسیب عصبی مربوط به استرس را محدود می کند ، میکروگلیال TNF- را مهار می کند؟ ترشح و افزایش جذب گلوتامات استروگلیال [196]. غلظت های میکرومولار S100B که عمدتا توسط آستروگلیا و لنفوسیت های فعال تولید می شوند [196,197،2] ، دارای اثرات مضر منتقل شده توسط گیرنده برای محصول نهایی پیشرفته گلیاس است که شامل آپوپتوز عصبی ، تولید COX-2 / PGE-1 ، IL-21,196,198؟ و گونه های اکسید نیتریک قابل القا ، و تنظیم مجدد یکپارچه / میکروگلیال TNF-؟ ترشح [XNUMX،XNUMX،XNUMX].
سرم و به ویژه سطح CSF و مغز S100B نشانگر فعال سازی گلیال (عمدتا astroglial) [199] است. در MDD و روان درمانی، سطح سرمی S100B با شدت خودکشی، مستقل از تشخیص روانپزشکی [200] رابطه مثبت دارد. تجزیه و تحلیل پس از مرگ S100B سطوح پایین در قشر پیش فونتیال MDD و BPD و سطوح افزایش یافته در قشر پاریتال BPD [196] را کاهش داد.
متاآنالیز (اختلال خلقی 193، کنترلهای سالم 132) سطح بالای سرم و CSF S100B را در اختلالات خلقی، به ویژه در دوره های افسردگی حاد و مانیا [201] تایید کرد.
در اسکیزوفرنی، سطح مغز، CSF و S100B سرم افزایش می یابد [199,202]. متاآنالیز (12 مطالعه، 380 اسکیزوفرنی، 358 فرد سالم) سطوح بالای S100B سرم را در اسکیزوفرنی تایید کرد [203]. در مغز پس از مرگ افراد مبتلا به اسکیزوفرنی، آستروگلیاهای واکنشپذیر S100B در نواحی دخیل در اسکیزوفرنی، از جمله قشر کمربندی قدامی، قشر جلوی پیشانی پشتی جانبی، قشر اوربیتوفرونتال و هیپوکامپی یافت میشوند [154]. سطوح بالا S100B با پارانوئید [154] و روان پریشی منفی [204]، اختلال در شناخت، پاسخ درمانی ضعیف و طول مدت بیماری [202] ارتباط دارد. پلیمورفیسمهای ژنتیکی در S100B [32] و گیرنده ژنهای محصول نهایی گلیکوزیشن پیشرفته در گروههای اسکیزوفرنی (جدول 2) [32,33,205،100،201] نشان میدهند که این ناهنجاریها احتمالاً اولیه/ بیماریزا هستند تا نشانگرهای ثانویه/زیست. در واقع، کاهش سطح سرمی S196B به دنبال درمان با داروهای ضد افسردگی [XNUMX] و داروهای ضد روان پریشی [XNUMX] نشان می دهد.برخی از اهمیت بالینی S100B به پاتوفیزیولوژی اختلالات روانپزشکی.
التهاب عصبی و افزایش استرس اکسیداتیو
استرس اکسیداتیو شرایطی است که بیش از حد اکسیدانها باعث آسیب یا تغییر ماکرومولکول های بیولوژیکی مانند لیپیدها، پروتئین ها و DNA [206-209] می شود. این نتایج بیش از حد از افزایش تولید اکسیدان، کاهش اکسیدان، ضایعات دفاع آنتی اکسیدان یا برخی از ترکیب آنها [206-209] است. مغز به خصوص به استرس اکسیداتیو آسیب پذیر است: 1) مقدار بالای اسیدهای چرب اشباع شده پراکسی زدایی؛ 2) محتوای نسبتا بالا از مواد معدنی ردیابی که باعث پراکسیداسیون لیپید و رادیکال های اکسیژن (به عنوان مثال آهن، مس)؛ 3) مصرف اکسیژن بالا؛ و 3) مکانیسم های ضد اکسیداسیون محدود [206,207].
استرس اکسیداتیوی اضافی در MDD [206]، BPD [206,207]، اسکیزوفرنی [207,209] و OCD [206,208] رخ می دهد. مارکرهای محیطی اختلالات اکسیداتیو شامل افزایش محصولات پراکسیداسیون لیپید (مثلا مالون دی آلدئید و 4-hydroxy-2-nonenal)، افزایش متابولیت های نیتریک اکسید (NO)، کاهش آنتی اکسیدان ها (به عنوان مثال گلوتاتیون) و تغییر آنزیم های آنتی اکسیدان [206,207].
در MDD، تولید آنیون رادیکال سوپر اکسید افزایش یافته است با آپوپتوز نوتروفیل افزایش یافته توسط اکسیداسیون [206]. سطح سرمی آنزیم های آنتی اکسیدان (به عنوان مثال، سوپر اکسید دیسموتاز 1) در حوادث افسردگی حاد افزایش می یابد و پس از درمان [206] مهار کننده های بازجذب سروتونین (SSRIs) نرمال می شود. این نشان می دهد که در MDD سطح آنزیم آنتی اکسیدان سرم یک نشانگر وضعیت است که ممکن است مکانیسم جبران کننده ای را که منجر به افزایش شدید در استرس اکسیداتیو می شود را نشان دهد. [206] در مقابل اسکیزوفرنی، سطح سوپراکسید دیسموتاز-1 محلول در CSF در بیماران مبتلا به اسکیزوفرن زودهنگام نسبت به بیماران اسکیزوفرنی مزمن و افراد سالم کاهش قابل ملاحظهای دارد. این نشان می دهد که کاهش سطح آنزیم آنتی اکسیدان مغزی ممکن است به آسیب اکسیداتیو در اسکیزوفرنی حاد [210] کمک کند، اگر چه مطالعات بیشتری برای تایید این یافته ضروری است.
چندین آزمایش تجربی و مطالعات انسانی به طور دقیق تر مکانیسم های پاتوفیزیولوژی افزایش استرس اکسیداتیو را در اختلالات روان شناختی [206-262] مورد بررسی قرار داد. در مدل های حیوانی افسردگی، سطح مغز گلوتاتیون کاهش می یابد، در حالی که پراکسیداسیون لیپید و سطح NO افزایش می یابد [206,262].
مطالعات Postmortem نشان می دهد که میزان کلسترول گلوتاتیون در MDD، BPD [206] و افراد اسکیزوفرن [206,207] کاهش یافته است. فیبروبلاست های کشت شده از بیماران MDD نشان دهنده افزایش استرس اکسیداتیو ناشی از سطوح گلوتاتیون [262] است، که بر اساس نقش اصلی کاهش تخریب گلوتاتیون به عنوان مکانیسم اصلی استرس اکسیداتیو در افسردگی است.
فعال سازی میکروشکلی ممکن است از طریق تولید سیتوکین های پیش التهابی و NO باعث افزایش استرس اکسیداتیو شود. سیتوکین های پیش التهابی و سطح بالای NO ممکن است باعث تشکیل گونه های اکسیژن واکنش پذیر (ROS) شود ، که به نوبه خود باعث تسریع پراکسیداسیون لیپید ، آسیب رساندن به فسفولیپیدهای غشایی و گیرنده های انتقال دهنده عصبی مونو آمین متصل به غشا and و کاهش آنتی اکسیدان های درون زا می شود. افزایش محصولات ROS می توانند از طریق تحریک NF-؟ B [206] ، فعالیت میکروگلیایی را افزایش داده و تولید پیش التهابی را افزایش دهند ، که به نوبه خود آسیب اکسیداتیو را تداوم می بخشد [209] ، و ایجاد پتانسیل برای یک حلقه بازخورد مثبت پاتولوژیک را در برخی از اختلالات روانپزشکی ایجاد می کند [208-208]. اگرچه التهاب عصبی می تواند سطح گلوتامات مغزی را افزایش دهد [206،209] ، نقش بیش فعالی گلوتاماترژیک به عنوان علت استرس اکسیداتیو بدون دلیل باقی مانده است [85,86].
اختلال عملکرد میتوکندری ممکن است باعث افزایش استرس اکسیداتیو در MDD ، BPD و اسکیزوفرنی شود [206]. مطالعات پس از مرگ در این اختلالات ناهنجاری هایی را در DNA میتوکندری نشان می دهد ، که با شیوع بالای اختلالات روانپزشکی در اختلالات اولیه میتوکندری سازگار است [206]. مطالعات حیوانات در شرایط آزمایشگاهی نشان می دهد که سیتوکین های پیش التهابی مانند TNF-؟ می توانند تراکم میتوکندری را کاهش دهند و متابولیسم اکسیداتیو میتوکندری را مختل کنند [211,212،206,213] و منجر به افزایش تولید ROS [206,213،XNUMX] شود. این یافته های تجربی ممکن است حاکی از پیوند مکانیکی بین التهاب عصبی ، اختلال عملکرد میتوکندری و استرس اکسیداتیو باشد [XNUMX،XNUMX] ، که شایسته بررسی بیشتر این مسیرهای بیماری زای متقاطع در اختلالات روانپزشکی انسان است.
آسیب پذیری بافت عصبی به آسیب اکسیداتیو در بین اختلالات روانپزشکی مختلف بر اساس مسیرهای عصبی، مغز و مولکولی درگیر در اختلال خاص [207] متفاوت است. اثرات درمان نیز ممکن است حیاتی باشد، زیرا شواهد اولیه نشان می دهد که آنتی سایکوتیک ها، SSRI ها و تثبیت کننده های خلق دارای خواص آنتی اکسیدانی هستند [206,207,262]. نقش درمان های آنتی اکسیدان های جانبی (مثلا ویتامین C و E) در اختلال روانپزشکی با تحقیقات بالینی تصادفی بالینی ثابت می شود. N-acetylcysteine بیشترین امیدبخش ترین نتایج را به خود اختصاص داده است، با چندین کارآزمایی کنترل شده به صورت تصادفی کنترل شده با پلاسبو و اثربخشی آن در MDD، BPD و اسکیزوفرنی [207] را نشان می دهد.
اختلال عملکرد سد خونی مغزی
BBB با محدود کردن ورود واسطههای التهابی محیطی، از جمله سیتوکینها و آنتیبادیهایی که میتوانند انتقال عصبی را مختل کنند، وضعیت دارای امتیاز ایمنی مغز را تضمین میکند [214,215]. فرضیه تجزیه BBB و نقش آن در برخی از بیماران روانپزشکی [60,214,216,217] با افزایش شیوع همبودی روانپزشکی در بیماری های مرتبط با اختلال عملکرد آن، از جمله SLE [97]، سکته مغزی [11] سازگار است.صرع [218] و انسفالیتیدهای خودایمنی (جدول 1). افزایش نسبت CSF: آلبومین سرم در بیماران مبتلا به MDD و اسکیزوفرنی نشان دهنده افزایش نفوذپذیری BBB است [214].
در یک مطالعه (افراد 63 در کنترل 4,100)، اختلالات CSF نشان دهنده آسیب BBB در 41٪ از افراد روانپزشکی (14 MDD و BPD، 14 اسکیزوفرنیا)، از جمله سنتز اینتراکتیک IgG، IgM و / یا IgA، تشخیص داده شد. pleocytosis CSF خفیف (5 به 8 سلول در mm3) و حضور تا چهار گروه IgG oligoclonal [216]. یکی از مطالعات فوق تخریبی پس از مرگ در اسکیزوفرنیا، اختلالات فراصوت BBB در قشرهای پیش از افق و بینایی دیده شد که شامل انحطاط کوکلولار سلولهای اندوتلیال، فرآیندهای پایه آستروگلالیال و ضخیم شدن و بی نظمی لامنای پایه [60] بود. با این حال، در این مطالعه، نویسندگان در مورد سهم بالقوه تغییرات پس از قاعدگی در مورد یافته های آنها اظهار نظر نکردند. مطالعه دیگری در مورد ترشحات انسداد سلول های اندوتلیال BBB در مغز اسکیزوفرنیک تفاوت های قابل توجهی را بین ژن هایی که بر عملکرد ایمنی شناختی تأثیر می گذارند و در کنترل [217] شناسایی نشد.
اختلال عملکرد اندوتلیال متشکل از اکسیداسیون ممکن است به پاتوفیزیولوژی اختلال عملکرد BBB در اختلالات روانپزشکی کمک کند. شواهد غیر مستقیم از مطالعات بالینی و تجربی در افسردگی [219] و به میزان کم در اسکیزوفرنی [220] نشان می دهد که افزایش اکسیداسیون ممکن است به اختلال عملکرد اندوتلیال کمک کند. اختلال عملکرد اندوتلیال ممکن است یک مکانیسم به اشتراک گذاشته شده برای ارتباط شناخته شده بین افسردگی و بیماری قلبی عروقی [219,221] باشد که ممکن است مربوط به کاهش میزان وازودیلاتور NO [221-223] باشد. مطالعات تجربی نشان می دهد که کاهش سطح اندوتلیال NO به طور مکانیکی با جدا شدن سنتاز نیتریک اکسید اندوتلیال (eNOS) از ترکیب اصلی آن تتراهیدروبیوپترین (BH4) مرتبط است، انتقال آن از L-آرژنین به اکسیژن [224-226]. eNOS انحصاری ترویج سنتز ROS (به عنوان مثال سوپراکسید) و گونه های واکنش پذیر نیتروژن (RNS) (به عنوان مثال، پراکسینیتریت؛ محصول تعامل سوپر اکسید با NO) [227] به جای NO، منجر به اختلال عملکرد اندوتلیال شده توسط اکسیداسیون [ 224-226].
داده های حیوانی نشان داد که SSRI ها می توانند NO سطح اندوتلیال کم (219) را بازنشانی کنند، که نشان می دهد مکانیسم های ضد اکسایش ممکن است به اثرات ضد افسردگی آنها کمک کند. در انسان، L-methylfolate ممکن است اثرات ضد افسردگی SSRIs [228] را افزایش دهد، با افزایش سطح BH4، که یک سازنده ضروری برای anti-oxidation [229] است که از طریق اتصال مجدد eNOS، و همچنین برای میزان محدود کردن آنزیم های مونوآمین (یعنی سروتونین، نوراپی نفرین، دوپامین) سنتز [228].
در مجموع، هر دو کار اخیر که بر نقش استرس اکسیداتیو ناشی از eNOS در پاتوژنز بیماریهای عروقی تأکید دارند [230,231] و…مطالعات اپیدمیولوژیک که افسردگی را به عنوان یک عامل خطر وابسته به آسیب های عروقی مانند سکته مغزی و بیماری قلبی [219,221] نشان می دهد، حمایت بیشتری را نسبت به اهمیت بالینی آسیب اکسیداتیو اندوتلیال ناشی از انزال در افسردگی به وجود می آورد. علیرغم شواهد فراوانی در مورد اختلالات سیتوکین در بیماری های روانی در انسان و داده های تجربی نشان می دهد که سیتوکین های ضد التهاب می توانند بیان eNOS [212] و افزایش نفوذپذیری BBB [215] را افزایش دهند، شواهد انسانی که ارتباط مستقیم سیتوکین های ضد التهابی را با اختلال عملکرد ENOS و یا اختلال BBB فاقد
تصویربرداری و درمان التهاب در بیماری روانی
تصویربرداری نوروآلومین در ناحیه
از نظر بالینی، تصویربرداری عصبی عصبی میتواند برای شناسایی زیر گروهی از بیماران روانپزشک مبتلا به التهاب عصبی حیاتی باشد که بیشترین احتمال را دارند که به درمانهای ایمنی مؤثر پاسخ دهند. علاوه بر این، چنین تصویربرداری ممکن است اجازه دهد پزشکان برای نظارت بر فعالیت بیماری مرتبط با التهاب عصبی و پاسخ آن به درمان ایمنی در بیماران روانپزشکی اجازه دهند. التهاب تصویربرداری در مغز انسان به طور متناوب متکی به تجربیات MRI یا CT در مقایسه با عوامل ضد انعقاد داخل وریدی است که نشان دهنده شکست موضعی BBB است. گاهی اوقات این اختلال در ناحیه لنفاوی همراه با پردازش عاطفی در بیماران مبتلا به اختلالات روانپزشکی مربوط به آنژیوپلاستی یا سایر آنسفالیتیدها [107,109,113] نشان داده شده است. با این حال، به رغم کارکرد [21,214,232] و اختلالات بلندی فوقانی ساختاری BBB [214,216]، به منظور اطلاع رسانی ما، هرگز در هر نوع اختلال روانپزشکی کلاسیک [60] هیچگونه اختلالی مشاهده نشد.
آیا اختلالات عصبی زیرزمینی در اختلالات روانپزشکی کلاسیک در in vivo تجسم می شود یا خیر، هنوز معلوم نیست. یک روش امیدوارکننده توموگرافی انتشار پوزیترون (PET) با استفاده از رادیوتراپی، مانند C11-PK11195 است که به پروتئین ترجمه کننده، که قبلا به عنوان گیرنده بنزودیازپین محیطی، بیان شده توسط میکروگلوی فعال شده است (233,234)، متصل می شود.
با استفاده از این روش، بیماران مبتلا به اسکیزوفرنیا در طول کورتکس [235] و در هیپوکامپ در حوادث حاد روانی [236] بیشتر فعال میکروگلیال را فعال کردند. یک مطالعه (14 اسکیزوفرنی، کنترل 14) تفاوت معنیداری را بین [11C] DAA1106 اتصال در اسکیزوفرنی در مقایسه با کنترل مشاهده نشد، اما یک همبستگی مستقیم بین اتصال [11C] DAA1106 و شدت علائم مثبت و مدت بیماری در اسکیزوفرنی [236].
محققین موسسه ما از C11-PK11195 PET برای نشان دادن التهاب دو هیپوکامپ در یک بیمار مبتلا به اختلال عملکرد عصبی روانپزشکی، از جمله MDD روان پریشی، صرع، و فراموشی انتروگراد، مرتبط با آنتی بادی های ضد GAD استفاده کردند [237]. با این حال، PK11195 PET داردخواص سیگنال به نویز کم و نیاز به cyclotron در محل.
بر این اساس، تحقیق برای توسعه لیگاند پروتئین های پرولاکتوری برای PET و SPECT اختصاص یافته است. مطالعات آینده بافتهای بافت مغز پس از مرگ با استفاده از کمیت سنجی پروتئین با هدف کشف مسیرهای متابولیکی و التهابی، سیتوکین های CNS و گیرنده های اتصال آنها در اختلالات روانی برای پیشرفت درک ما از پاتوفیزیولوژی اتوایمیون ضروری است.
نقش داروهای ضدالتهاب در اختلالات روانپزشکی
مطالعات متعددی در مورد انسان و حیوانات نشان می دهد که برخی از داروهای ضد التهابی ممکن است نقش مهمی در درمان اختلالات روانی داشته باشند (جدول 3). داروهای رایج داروی مهارکننده سیکلوکوکسیژناز هستند (جدول 3) [238-245]، مینوسیکلین (جدول 3) [240-245]، اسیدهای چرب امگا-3 [246,247]، و عصبهای استروئیدی [248].
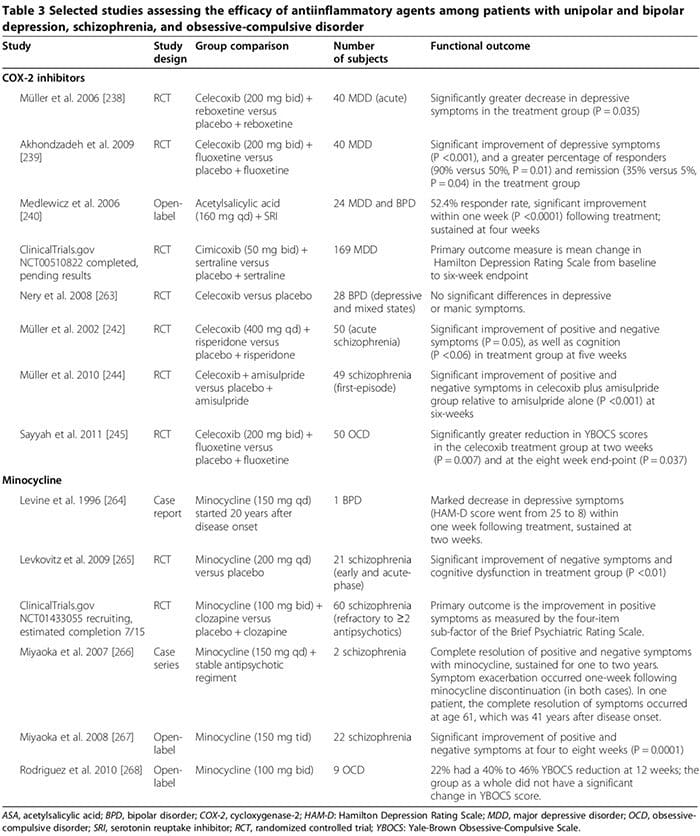 چندین مطالعه انسانی نشان داد که مهار کننده های COX-2 می توانند نشانه های روانپزشکی MDD، BPD، اسکیزوفرنی و OCD (Table 3) [248] را کاهش دهند. در مقابل، درمان کمکی با مهارکننده های غیراستروییدی COX (یعنی داروهای ضدالتهاب غیر استروئیدی (NSAID ها)) ممکن است اثر بخشی SSRI ها [249,250] را کاهش دهد؛ دو آزمایش بزرگ گزارش دادند که قرار گرفتن در معرض NSAID ها (اما نه به عنوان بازدارنده انتخابی COX-2 یا سالیسیلات) با افزایش قابل ملاحظه افسردگی در میان تعدادی از شرکت کنندگان در مطالعه همراه بود [249,250].
چندین مطالعه انسانی نشان داد که مهار کننده های COX-2 می توانند نشانه های روانپزشکی MDD، BPD، اسکیزوفرنی و OCD (Table 3) [248] را کاهش دهند. در مقابل، درمان کمکی با مهارکننده های غیراستروییدی COX (یعنی داروهای ضدالتهاب غیر استروئیدی (NSAID ها)) ممکن است اثر بخشی SSRI ها [249,250] را کاهش دهد؛ دو آزمایش بزرگ گزارش دادند که قرار گرفتن در معرض NSAID ها (اما نه به عنوان بازدارنده انتخابی COX-2 یا سالیسیلات) با افزایش قابل ملاحظه افسردگی در میان تعدادی از شرکت کنندگان در مطالعه همراه بود [249,250].
در اولین آزمایش که شامل بیماران افسرده 1,258 تحت درمان با سیتالوپرام برای هفته های 12 بود، میزان بهبودی به طور قابل توجهی پایین تر از کسانی بود که حداقل یک بار نسبت به کسانی که NSAID ها مصرف کرده بودند (45٪ در مقابل 55٪، OR 0.64، P = 0.0002) [249]. آزمایش دیگری که حاوی موارد 1,545 MDD بود نشان داد که میزان افسردگی مقاوم به درمان در میان کسانی که مصرف NSAID ها (OR 1.55، 95٪ CI 1.21 به 2.00) [231] را مصرف می کنند. بدتر شدن افسردگی در گروه های NSAID ممکن است از نظر مکانیکی به درمان NSAID مرتبط نباشد، اما در عوض به شرایط همیشگی بیماری های مزمن [10,12-18] که نیازمند NSAID های درازمدت است و شناخته شده است به طور مستقل با افزایش خطر مرتبط است افسردگی مقاوم به درمان [249,251]. مطالعات آینده در مورد اثرات NSAID ها در مورد افسردگی و پاسخ به داروهای ضد افسردگی در انسان ضروری است.
در سایر مطالعات تجربی با استفاده از الگوهای استرس حاد برای ایجاد حالت افسردگی در موش، سیتالوپرام TNF-?، IFN-?، و p11 (عامل مولکولی مرتبط با رفتار افسردگی در حیوانات) را در قشر پیشانی افزایش داد، در حالی که ایبوپروفن NSAID را افزایش داد. این مولکول ها را کاهش داد. NSAID ها همچنین اثرات ضد افسردگی SSRI ها را کاهش دادند اما نه سایر داروهای ضد افسردگی [249]. این یافتهها نشان میدهد که سایتوکاینهای پیشالتهابی ممکن است بهطور متناقضی اثرات ضدافسردگی داشته باشند، علیرغم شواهد بسیار زیاد.مطالعات انسانی برعکس (همانطور که در بالا بررسی شد)، که می تواند توسط NSAID ها کاهش یابد [249]. حداقل دو ملاحظه ممکن است برای این پارادوکس ظاهری توضیح دهد: 1) تحت برخی شرایط تجربی، سایتوکاین های پیش التهابی با نقش محافظت کننده عصبی همراه بوده اند، [251; (برایبه عنوان مثال ، IFN-؟ در سطوح پایین می تواند باعث ایجاد میکروگلیا محافظت از نور شود (شکل 2) [163,166,251،2،251]. و XNUMX) اینکه آیا این پاسخ های مشاهده شده در متن یک الگوی استرس حاد در یک مدل حیوانی برای MDD درون زا در انسان قابل استفاده است یا خیر ، هنوز مشخص نیست [XNUMX].
اثرات درمانی مهارکننده های COX-2 در اختلالات روانپزشکی ممکن است شامل تعدیل بیوسنتز پروستاگلاندین های مشتق شده از COX-2 ، از جمله PGE2 پیش التهابی و 15-deoxy-؟ 12,14،2-PGJ15 ضد التهابی (2d- PGJ252,253) باشد [2،2]. مهارکننده های COX-252,253 می توانند التهاب ناشی از PGE15 را کاهش دهند ، که ممکن است در پاتوفیزیولوژی اختلالات روانپزشکی نقش داشته باشد [2،252,253]. آنها همچنین ممکن است سطح XNUMXd-PGJXNUMX و فعالیت گیرنده هسته ای آن را برای گیرنده های هسته ای فعال کننده گیرنده هسته ای پراکسی زوم (PPAR-؟) تغییر دهند [XNUMX،XNUMX].
مطالعات متعدد نشان می دهد که 15d-PGJ2 و گیرنده هسته ای آن PPAR-? می تواند به عنوان نشانگرهای بیولوژیکی برای اسکیزوفرنی عمل کند [253]. در بیماران اسکیزوفرنی، سطح سرمی PGE2 افزایش می یابد، در حالی که سطوح سرمی 15d-PGJ2 کاهش می یابد، همانطور که بیان گیرنده هسته ای آن PPAR-؟ در PBMC [252]. در حالی که مهارکننده های COX-2 ممکن است اثرات ضد التهابی سودمند بالقوه COX-2 وابسته به �15d-PGJ2/PPAR- را محدود کنند؟ ممکن است اثرات مضر آن را کاهش دهند، از جمله 1) افزایش خطر انفارکتوس میوکارد و عفونت های خاص (به عنوان مثال، سیتومگالوویروس و توکسوپلاسما گوندی) در بیماران اسکیزوفرنی [254] و 2) اثرات پیش آپوپتوتیک آن مشاهده شده در بافت سرطانی انسان و حیوان [255]. سایر مکانیسمهای بالقوه اثرات درمانی مهارکنندههای COX-2 ممکن است شامل توانایی آنها در کاهش سطوح سیتوکینهای پیش التهابی [163]، محدود کردن سمیت تحریکپذیری اسید کینولینیک (مانند MDD) و کاهش سطح KYNA (مانند اسکیزوفرنی) باشد [128].
مینوسیکلین می تواند در اختلالات روانپزشکی موثر باشد (جدول 3) [248]. داده های آزمایشگاهی نشان می دهد که مینوسیکلین MAP، ترشح سیتوکین، بیان COX-2/PGE-2 و نیتریک اکسید سنتاز القایی را مهار می کند [256]. مینوسیکلین همچنین ممکن است با انتقال عصبی گلوتاماترژیک و دوپامینرژیک غیرقابل تنظیم مقابله کند [256].
اثربخشی اسید چرب امگا 3 در اختلالات روانپزشکی نامشخص است [248]. در یک متاآنالیز در سال 2011 از 15 کارآزمایی تصادفیسازی و کنترلشده (916 MDD)، مکملهای امگا 3 حاوی ایکوزاپنتانوئیک اسید 60% (محدوده دوز 200 تا 2,200 میلیگرم در روز بیش از دوز دوکوزاهگزانوئیک اسید) به طور قابلتوجهی علائم کاهشدهنده اسید دوکوزاهگزانوئیک را کاهش دادند. درمان کمکی به SRIs (P <0.001) [246]. با این حال، یک متاآنالیز بعدی به این نتیجه رسید که هیچ مزیت قابل توجهی از اسیدهای چرب امگا 3 در افسردگی وجود ندارد و اثربخشی ادعا شده صرفاً نتیجه سوگیری انتشار است [247]. یک متاآنالیز در سال 2012 از 5 کارآزمایی تصادفیسازی و کنترلشده شامل 291 شرکتکننده BPD نشان داد که علائم افسردگی، اما نه شیدایی، در بین افرادی که تصادفیسازی شدهاند به اسیدهای چرب امگا 3 نسبت به افرادی که دارونما مصرف میکنند، به طور قابلتوجهی بهبود یافته است (Hedges g 0.34، P = 0.025). [257]. در یک کارآزمایی تصادفیسازی و کنترلشده از افراد اسکیزوفرنی که تا 12 ماه پیگیری شد، نمرات علائم مثبت و منفی در بین 66 شرکتکننده بهطور تصادفی به امگا 3 با زنجیره بلند (1.2 گرم در روز به مدت 12 هفته؛ 0.02 = P و 0.01) کاهش یافت. به ترتیب) [258]; �نویسندگان نتیجه گرفتند که تقویت امگا-3 در طی دوره اولیه اسکیزوفرنیا همچنین می تواند از عود و پیشرفت بیماری جلوگیری کند [258].
یک متاآنالیز 2012 از هفت کارآزمایی تصادفی کنترل شده با ارزیابی افزایش امگا-3 در بیماران مبتلا به اسکیزوفرن 168 هیچ مزیتی از درمان [259] نداشت. نویسندگان این متاآنالیز به طور خاص اظهار داشتند که هیچ نتیجهای در مورد پیشگیری از عود یا عواقب پیشرفت بیماری [259] وجود ندارد. داده های تجربی نشان می دهد که ایکوزاپنتائوئیک اسید و اسید داکوزاگزنئوئیک اسید باعث کاهش اثرات ضد التهابی می شوند و باعث افزایش سنتز لیزولین ها و محافظین ها می شود که می تواند نفوذ لکوسیت ها را مهار و تولید سیتوکین را کاهش دهد [248].
Neurosteroids، از جمله pregnenolone و متابولیت آن پایین alopregnanolone، ممکن است نقش مهمی در برخی از اختلالات روانپزشکی [248,260] داشته باشد. در MDD چندین مطالعه کاهش سطح آلوپروآننولون پلاسمایی / CSF و ارتباط آن با شدت علامت را نشان دادند، که پس از درمان موفق با داروهای ضد افسردگی خاص (مانند SSRIs) و درمان الکتروشوک (261) نرمال شد. در اسکیزوفرنی، سطح حاملنولون مغز می تواند تغییر کند [248] و سطح آلوپورننولون سرم ممکن است بعد از بعضی از داروهای ضد سایکوتیک (مثلا کلوزاپین و الانزاپین) [260] افزایش یابد. در سه کارآزمايي باليني تصادفي شده (100 اسكيزوفرنيا)، مدت درمان، تقريبا 9 هفته) علائم مثبت، منفي و شناختي و همچنين عوارض جانبي آنتي بيوتيكي عصاره اضافي در يك يا چند آزمايش از جمله موارد تصادفي حاملنولون نسبت به کسانی که دارونما دریافت می کنند [248]. در یک آزمایش، بهبود با درمان طولانی مدت حاملنولون [248] ادامه یافت. Pregnenolone می تواند شناخت و رفتار را با تقویت عملکرد NMDA و گیرنده های GABAA [248] تنظیم کند. علاوه بر این، آلوپرنانیولون ممکن است اثرات ضد عفونی و ضد التهابی [248] را اعمال کند. برای تأیید نقش مفیدی از استروئید های نوروپاتی در ابتدای اختلالات روانی در انسان مورد نیاز است.
ما منتظر نتایج چندین آزمایش بالینی مداوم هستیم که در حال بررسی اثرات درمانی سایر عوامل ضد التهابی هستند ، از جمله سالیسیلات ، یک مهار کننده NF-؟ B (NCT01182727). اسید استیل سالیسیلیک (NCT01320982) ؛ پراواستاتین (NCT1082588) و دکسترومتورفان ، یک آنتاگونیست غیر رقابتی NMDAR که می تواند آسیب عصبی دوپامینرژیک ناشی از التهاب را محدود کند (NCT01189006).
استراتژی های درمان آینده
اگرچه درمان های ایمنی فعلی (به عنوان مثال، IVIG، پلاسمافرزیس، کورتیکواستروئیدها و عوامل سرکوب کننده سیستم ایمنی) اغلب برای درمان انسفالیتیدهای خودایمنی که التهاب حاد، شدید و عمدتاً منشأ انطباقی دارد، مؤثر است، اما اثربخشی آنها در اختلالات روانپزشکی کلاسیک که التهاب مزمن است.بسیار خفیف و عمدتا منشاء ذاتی، محدود است [2]. توسعه درمان های نوین باید با هدف کاهش معکوس کاهش میلین (46,138)، تنظیم مقادیر MAP مضر، در حالی که بهینه سازی رگ های T و محافظت از عصب درونی و MAP سودمند باشد، به جای جلوگیری از بروز التهاب غیرمستقیم، همانطور که با عوامل فعلی سیستم ایمنی تحریک شده است. علاوه بر این، توسعه آنتی اکسیدان های قوی همراه با عوارض جانبی که باعث آسیب اکسیداتیو در اختلالات روانی می شود، مورد نیاز است.
نتیجه گیری
Autoimmunity می تواند یک میزبان از اختلالات روانپزشکی که ممکن است در ابتدا با نشانه های جدا شده روانپزشکی باشد را ایجاد کند. التهاب درونی / autoimmunity ممکن است مربوط به پاتوژنز علائم روانی در یک زیر مجموعه از بیماران مبتلا به اختلالات روانپزشکی کلاسیک باشد. التهاب درونی ممکن است به صورت مکانیکی مرتبط با ناهنجاریهای مونوآمینرژیک و گلوتاماترگیکال سنتی و افزایش آسیب اکسیداتیو گزارش شده در بیماریهای روانپزشکی باشد.
Souhel Najjar1,5 *، دانیل M Pearlman2,5، کنت Alper4، Amanda Najjar3 و Orrin Devinsky1,4,5
اختصارات
3-OH-KYN: 3-هیدروکسی کینورنین. ?7nAchR: گیرنده های آلفا 7 نیکوتین استیل کولین. AMPAR: گیرنده های آمینو-3-هیدروکسی-5-متیل-l-4-ایزوکسازول پروپیونیک اسید. APC: سلول ارائه دهنده آنتی ژن. BBB: سد خونی مغزی؛
BH4: Tetrahydrobiopterin؛ BPD: اختلال دوقطبی؛ CI: فاصله اطمینان؛
CNS: سیستم عصبی مرکزی؛ COX-2: Cyclooxegenase-2؛ CSF: مایع مغزی نخاعی؛ DSM-IV: راهنمای تشخیصی و آماری اختلالات روانی نسخه 4th؛ EAATs: حمل کننده های اسید آمینه تبخیری؛ ENOS: سنتاز اکسید نیتریک اندوتلیال؛ گاباب: اسید بتا گاما آمینو بوتیریک؛ GAD: دکربوکسیلاز اسید گلوتامیک؛ GFAP: پروتئین اسیدی فیبریلاسیون گلایال؛ GLX: گلوتامات قابل تشخیص 1H MRS، گلوتامین، کامپوزیت اسید گاما آمینو بوتیریک؛
IDO: ایندولامین 2,3،1-دیوکسیژناز ؛ Ig: ایمونوگلوبولین ؛ IL: اینترلوکین ؛ IL-1RA: آنتاگونیست گیرنده اینترلوکین XNUMX ؛ IFN-؟: گامای اینترفرون ؛
KAT: Kynurenine aminotransferase؛ KMO: Kynurenine 3-monooxygenase؛ KYN: Kynurenine؛ KYNA: اسید کینورنیک؛ LE: آنسفالیت لنیک؛
LPS: Lipopolysaccharide؛ MAP: فعال سازی و تکثیر Microglial؛
MDD: اختلال افسردگی اساسی ؛ mGluR: گیرنده گلوتامات متابوتروپیک ؛ MHC: II پیچیده سازگاری بافتی عمده کلاس دو ؛ MRI: تصویربرداری تشدید مغناطیسی ؛ MRS: طیف سنجی رزونانس مغناطیسی ؛ NF-؟ B: فاکتور هسته ای کاپا B ؛ NMDAR: گیرنده N-methyl-D-aspartate. NR1: سایت گلیسین؛
OCD: اختلال وسواسی-اجباری؛ OR: نسبت شانس؛ PANDAS: اختلالات خودکار آمیز اطفال روانپزشکی همراه با عفونت استرپتوکوک؛ PBMC: سلول های تک هسته ای خون محیطی؛ PET: توموگرافی انتشار Positron؛ PFC: قشر پیش فرنتال؛ PGE-2: Prostaglandin E2؛ PPAR-
؟: گامای گیرنده هسته ای فعال شده توسط پروکسیزوم QA: اسید کینولینیک ؛ RNS: گونه های نیتروژن واکنش پذیر ؛ ROS: گونه های اکسیژن واکنش پذیر ؛
sIL: اینترلوکین محلول ؛ SLE: لوپوس اریتماتوی سیستمیک ؛ SRI: مهارکننده جذب مجدد سروتونین ؛ TNF- ؟: فاکتور نکروز تومور آلفا ؛ T-regs: سلولهای نظارتی CD4 + CD25 + FOXP3 + T ؛ TDO: تریپتوفان-2,3،XNUMX-دیوکسیژناز ؛ Th: T-helper ؛ VGKC: کانال پتاسیم ولتاژدار XAG-: حمل و نقل گلوتامات آسپارتات ؛ Xc-: گلوتامات آستروگلایال مستقل از سدیم / سیستین
سیستم ضد انفجار
منافع رقابت
نویسندگان اعلام می کنند که آنها منافع رقابتی ندارند.
مشارکت نویسندگان
SN و DMP بررسی ادبی گسترده ای انجام دادند، داده ها را تفسیر کردند، دستنوشته ها، ارقام و جداول را تهیه می کردند. KA بخش مربوط به مکانیزم های اکسیداتیو را تهیه کرد و به اصلاح نسخه های خطی کمک کرد. AN و OD به طور انتقادی تجدید نظر کرده و طراحی و کیفیت این دستنوشته را بهبود بخشید. همه نویسندگان مقاله نهایی را خوانده و تایید کرده اند.
تشکر و قدردانی
سپاسگزاریم. جوزپ دلماو، MD، دکترای، تریسی باتلر، MD، و دیوید Zazag، MD، دکتر، برای ارائه تخصص خود را در encephalitistides autoimmune، تصویربرداری نوروپاتولوژی و نوروپاتولوژی.
جزئیات نویسنده
1 بخش مغز و اعصاب، دانشکده پزشکی دانشگاه نیویورک، خیابان 550 اول، نیویورک، NY 10016، ایالات متحده آمریکا. دانشکده پزشکی 2Geisel در دارتموث، موسسه سیاست های بهداشت و درمان بالینی، 30 Lafayette Street، HB 7252، لبنان، NH 03766، ایالات متحده آمریکا. 3 بخش آسیب شناسی، بخش نوروپاتولوژی، دانشکده پزشکی دانشگاه نیویورک، 550 اول خیابان، نیویورک، NY 10016، ایالات متحده آمریکا. 4Department روانپزشکی، دانشکده پزشکی دانشگاه نیویورک، نیویورک، نیویورک، ایالات متحده آمریکا. دانشگاه 5 نیویورک مرکز جامع صرع، 550 اول خیابان، نیویورک، NY 10016، ایالات متحده آمریکا.
جای خالی
منابع:
1 Kayser MS، Dalmau J: پیوند در حال ظهور بین اختلالات خودایمنی
و بیماری عصبی روانی J Neuropsychiatry Clin Neurosci 2011، 23:90±97.
2 نجار س، پرولمان د، زاگ زاگگگگگگگگگگگگگگگگگگگگگگگگگگسك، گلفينوس ج، دينيسكو O: اسيد گلوتاميك
سندروم خودکار آنتیبادی dearboxylase که به عنوان اسکیزوفرنی معرفی می شود.
متخصص مغز و اعصاب 2012، 18:88 91.
3 Graus F، Saiz A، Dalmau J: آنتی بادی ها و خود ایمنی عصبی
اختلالات CNS J Neurol 2010، 257:509 517.
4 Lennox BR، Coles AJ، وینسنت A: آنسفالیت با آنتی بادی: a
علت قابل درمان اسکیزوفرنی Br J Psychiatry 2012، 200:92-94.
5 زندی MS، ایران SR، لانگ B، واترز پ.، جونز PB، مک کینا P، کالس AJ، وینسنت
A، Lennox BR: آنتیبادی های مرتبط با بیماری در قسمت اول
جنون جوانی. J Neurol 2011، 258:686-688.
6 بتالر ل، کلئوپا KA، وو GF، روسی جی.، رزونفلد، جی دالمائو J:
آنسفالیت لنفاوی اتوایمون در بیماران 39: ایمونوفنوتایپ ها و
نتایج. J Neurol Neurosurg Psychiatry 2007، 78:381-385.
7 Dale RC، Heyman I، Giovannoni G، Church AW: بروز ضد مغز
آنتیبادی ها در کودکان مبتلا به اختلال وسواسی-اجباری. ج ج روانپزشکی
2005 ، 187: 314 319.
8 Kendler KS: ماهیت dappled علل بیماری روانی: جایگزین کردن
دیاگرام آلی-کارکردی / سخت افزار-نرم افزار با تجربی
پلورالیسم مبتنی بر Mol Psychiatry 2012، 17:377±388.
9 Keskin G، Sunter G، Midi I، Tuncer N: Neurosyphilis به عنوان یک علت شناختی
کاهش و نشانه های روان در جوانان. J Neuropsychiatry Clin
Neurosci 2011, 23:E41-E42.
10 Leboyer M، Soreca I، Scott J، Frye M، Henry C، Tamouza R، Kupfer DJ: Can
اختلال دوقطبی به عنوان یک بیماری التهابی چند سیستم دیده می شود؟
J Affect Disord 2012، 141:1:10.
11 Hackett ML، Yapa C، Parag V، Anderson CS: Frequency of depression after
سکته مغزی: مروری سیستماتیک از مطالعات مشاهده ای Stroke 2005, 36:1330~1340.
12 Dantzer R، O'Connor JC، Freund GG، جانسون RW، Kelley KW: از
التهاب بیماری و افسردگی: زمانی که سیستم ایمنی بدن
مغز را مطیع می کند Nat Rev Neurosci 2008، 9:46:56.
13 لیس C، Zank M، Klein R، Stransky E، Batra A، Buchkremer G، Schott K:
واکنش آنتی بادی در سرم بیماران مبتلا به افسردگی عمده،
اسکیزوفرنی و کنترل های سالم Psychiatry Res 2008, 158:83-86.
14 Eisenberger NI، Berkman ET، Inagaki TK، Rameson LT، Mashal NM، Irwin MR:
Anedonia induced by inflammation: اندوتوکسین Striatum شکمی را کاهش می دهد
پاسخ به پاداش Biol Psychiatry 2010، 68:748-754.
15 هارون E، Raison CL، میلر AH: روان یونوئیمونولوژیستی با هم ملاقات می کنند
Neuropsychopharmacology: پیامدهای ترجمه ای از تأثیر
التهاب در رفتار نوروسیکوفارماکولوژی 2012، 37:137-162.
16 Benros ME، Nielsen PR، Nordentoft M، Eaton WW، Dalton SO، Mortensen PB:
بیماری های خود ایمنی و عفونت های شدید به عنوان عوامل خطر برای
اسکیزوفرنی: یک مطالعه ثبت نام مبتنی بر جمعیت 30 سالانه است. ام آی جی روانپزشکی
2011 ، 168: 1303 1310.
17 مكانلی L، Bhagwagar Z، Hannestad J: التهاب، گلوتامات و گلایا
در افسردگی: مروری بر ادبیات. CNS Spectr 2008، 13:501×510.
18 Harrison NA، Brydon L، Walker C، Gray MA، Steptoe A، Critchley HD:
التهاب باعث تغييرات خلق در اثر تغييرات در زيرجلدي مي شود
فعالیت cingulate و اتصال mesolimbic. Biol روانپزشکی 2009،
66:407 414.19. Raison CL، Miller AH: آیا افسردگی یک اختلال التهابی است؟
Curr Psychiatry Rep 2011، 13:467~475.
20 Raison CL، Miller AH: اهمیت تکاملی افسردگی در
دفاع میزبان پاتوژن (PATHOS-D). Mol Psychiatry 2013، 18:15±37.
21 Steiner J، Bogerts B، Sarnyai Z، والتر M، Gos T، Bernstein HG، Myint AM:
برطرف کردن شکاف بین فرضیه های ایمنی و گلوتامات
اسکیزوفرنی و افسردگی عمده: نقش بالقوه NMDA گلیال
تعدیل کننده های گیرنده و اختلال در یکپارچگی سد خونی مغزی. جهانی جی
Biol Psychiatry 2012، 13:482±492.
22 Steiner J، Mawrin C، Ziegeler A، Bielau H، Ullrich O، Bernstein HG، Bogerts B:
توزیع میکروگلایین مثبت HLA-DR-positive در اسکیزوفرنیا منعکس کننده است
اختلال جانبی مغزی Acta Neuropathol 2006، 112:305-316.
23 Papakostas GI، Shelton RC، Kinrys G، Henry ME، Bakow BR، Lipkin SH، Pi B،
تورموند L، Bilello JA: ارزیابی چند آزمون، مبتنی بر سرم
آزمایش تشخیصی بیولوژیکی برای اختلال افسردگی عمده: یک خلبان و
مطالعه تکرار Mol Psychiatry 2013, 18:332±339.
24 Krishnan R: افسردگی یکپارچه در بزرگسالان: اپیدمیولوژی، پاتوژنز، و
عصب شناسی در UpToDate اصلاح شده توسط Basow DS. والتکام، MA: UpToDate؛ 2013
25 Stovall J: اختلال دوقطبی در بزرگسالان: اپیدمیولوژی و تشخیص. که در
به روز. اصلاح شده توسط Basow DS. UpToDate: Waltham؛ 2013
26 فیشر BA، Buchanan RW: اسکیزوفرنی: اپیدمیولوژی و پاتوژنز.
در UpToDate اصلاح شده توسط Basow DS. والتکام، MA: UpToDate؛ 2013
27 Nestadt G، Samuels J، Riddle M، Bienvenu OJ 3rd، Liang KY، LaBuda M،
Walkup J، Grados M، Hoehn-Saric R: مطالعه خانوادگی از وسواس فکری
بی نظمی Arch Gen Psychiatry 2000، 57:358-363.
28 Stefansson H، Ophoff RA، Steinberg S، Andreassen OA، Cichon S، Rujescu D،
Werge T، Pietilainen OP، Mors O، Mortensen PB، Sigurdsson E، Gustafsson O،
Nyegaard M، Tuulio-Henriksson A، Ingason A، Hansen T، Suvisaari J،
Lonnqvist J، Paunio T، Brrglum AD، Hartmann A، Fink-Jensen A، Nordentoft
M، Hougaard D، Norgaard-Pedersen B، Bâttcher Y، Olesen J، Breuer R، Miller
HJ، Giegling I، et al: انواع مختلفی که خطر ابتلا به اسکیزوفرن را به وجود می آورند.
Nature 2009, 460:744×747.
29. مولر ان، شوارتز ام جی: تغییر با واسطه ایمنی سروتونین و
گلوتامات: به سمت یک دید کلی از افسردگی. روانپزشک مول
2007 ، 12: 988 1000.
30 Galecki P، Florkowski A، Bienkiewics M، Szemraj J: پلی مورفیسم عملکردی
از ژن cyclooxygenase-2 (G-765C) در بیماران افسرده.
Neuropsychobiology 2010، 62:116-120.
31 لوینسون DF: ژنتیک افسردگی: یک بررسی. Biol روانپزشکی 2006،
60: 84 92.
32 جی جی، چنگ لی، دونگ ج، شن کی، ژانگ ک، چن م، گائو ل، چن ایکس، وانگ ک،
دنگ X، ژو Z، جی ف، لیو C، لی ج، دونگ Q، چن C: ژن S100B
پلیمورفیسم عملکرد اساسی پیش فونتیال را در هر دو اسکیزوفرنی پیش بینی می کند
بیماران و افراد سالم Schizophr Res 2012، 134:89 94.
33 ژی جی، ژانگ ک، چنگ لی، چن م، وانگ ک، لیو ی، دنگ ایکس، چن X، شان کی،
ژو ز، جی ف.، لیو سی، دونگ کی، چن سی، لی ج: انواع ریسک در ژن S100B،
همراه با سطوح بالا S100B، نیز با آن ارتباط دارد
ناتوانی بینایی فضایی اسکیزوفرنی Behav Brain Res 2011، 217:363-368.
34 Cappi C، Muniz RK، Sampaio AS، Cordeiro Q، Brentani H، Palacios SA،
Marques AH، Vallada H، Miguel EC، Guilherme L، Hounie AG: Association
مطالعه بین پلی مورفیسم های عملکردی در ژن TNF-alpha و
اختلال وسواس فکری عملی. Arq Neuropsiquiatr 2012، 70:87 90.
35 Miguel-Hidalgo JJ، Baucom C، Dilley G، Overholser JC، Meltzer HY،
Stockmeier CA، Rajkowska G: پروتئین اسیدی فیبریلیال Glial
ایمونوئوراکتیویته در کورتکس پیشوفنتال، جوانتر از
سالمندان مبتلا به اختلال افسردگی اساسی Biol Psychiatry 2000، 48:861-873.
36 Altshuler LL، Abulseoud OA، Foland Ross L، Bartzokis G، Chang S، Mintz J،
Hellemann G، Vinters HV: کاهش آستروسیت Amygdala در افراد با
اختلال افسردگی عمده اما اختلال دوقطبی. اختلال دوقطبی 2010،
12: 541 549.
37 Webster MJ، Knable MB، Johnston-Wilson N، Nagata K، Inagaki M، Yolken RH:
محلول ايمونوهيستوشيمي اسيد فيبريلاژي گليال فسفروليت شده
پروتئین در قشر پیش فرنتال و هیپوکامپ از بیماران با
اسکیزوفرنی، اختلال دوقطبی و افسردگی. Brain Behav Immun 2001،
15: 388 400.
38 Doyle C، Deakin JFW: آستروسیتهای کمتر در قشر جلویی اسکیزوفرنی،
افسردگی و اختلال دوقطبی است. اسکیزوفرنی Res 2002، 53: 106.
39 جانستون ویلسون NL، CD سیمز، Hofmann JP، آندرسون L، ساحل AD، Torrey
EF، Yolken RH: تغییرات خاص بیماری در پروتئین مغز قشر جلویی
در اسکیزوفرنیا، اختلال دوقطبی و اختلال افسردگی عمده، The
کنسرسیوم آسیب شناسی عصبی استانلی Mol Psychiatry 2000، 5:142-149.
40 Gosselin RD، Gibney S، O'Malley D، Dinan TG، Cryan JF: منطقه خاص
کاهش در ایمونواسیاکتیو پروتئین فیبریلار اسیدی در مغز
یک مدل موش افسردگی Neuroscience 2009, 159:915×925.
41 Banasr M، Duman RS: از بین رفتن قلب در قشر پیشانی جلوگیری می کند
القای رفتارهای افسردگی مانند Biol Psychiatry 2008، 64:863-870.
42 Cotter D، Hudson L، Landau S: شواهد مربوط به آسيب شناسی ارتوپدي در
اختلال دوقطبی و افسردگی عمده، اما نه در اسکیزوفرنیا.
اختلال دوقطبی 2005، 7:358-369.
43 Brauch RA، Adnan El-Masri M، Parker J Jr، El-Mallakh RS: شماره سلول گلیال
و نسبت سلول های نورونی / گلایال در مغز پس از مغز افراد دوقطبی.
J Affect Disord 2006، 91:87:90.
44 Cotter DR، Pariante CM، Everall IP: ناهنجاری های سلول گلیال در مغز
اختلالات روانی: شواهد و پیامدها. Brain Res Bull 2001،
55: 585 595.
45 Cotter D، Mackay D، Landau S، Kerwin R، Everall I: کاهش تراکم سلول گلیال
و اندازه عضلانی در قشر جلویی قلب در افسردگی عمده
بی نظمی Arch Gen Psychiatry 2001، 58:545-553.
46. Bowley MP, Drevets WC, Ongır D, Price JL: اعداد گلیال پایین در
آمیگدال در اختلال افسردگی اساسی Biol Psychiatry 2002، 52:404-412.
47 Toro CT، Hallak JE، Dunham JS، Deakin JF: پروتئین اسیدی فیبریلیال Glial و
گلوتامین سینتهتاز در ناحیه قشر پیش فرنتال در اسکیزوفرنیا
و اختلال خلقی Neurosci Lett 2006، 404:276-281.
48 Rajkowska G، Miguel-Hidalgo JJ، Makkos Z، Meltzer H، Overholser J،
Stockmeier C: کاهش آلفا واکنش GFAP در لایه خاص در لایه
قشر جلوی مغز پشتی جانبی در اسکیزوفرنی Schizophr Res 2002, 57:127-138.
49 Steffek AE، McCullumsmith RE، Haroutunian V، Meador-Woodruff JH: Cortical
بیان پروتئین اسیدی فیبریالیری glial و سنتتاز گلوتامین است
در اسکیزوفرنی کاهش یافته است. Schizophr Res 2008, 103:71-82.
50 Damadzic R، Bigelow LB، Krimer LS، Goldenson DA، Saunders RC، Kleinman
JE، Herman MM: مطالعات ايمونوهيستوشيمي کمي از آستروسيت ها در
قشر داخل دهان در اسکیزوفرنی، اختلال دوقطبی و عمده
افسردگی: عدم وجود آستروسیتوز قابل توجه. Brain Res Bull 2001، 55:611-618.
51 بنز FM، McSparren J، پرنده ED، SanGiovani JP، Vincent SL: نقص در
اینترنئورون های کوچک در قوزک شکاف پیشانی و پشتی اسکیزوفرنیک
و بیماران اسکیزوافکتیو Arch Gen Psychiatry 1991، 48:996-1001.
52. مولر ان، شوارتز ام جی: سیستم ایمنی و اسکیزوفرنی. Curr Immunol
Rev 2010, 6:213-220.
53 استینر ج، والتر م، گس تی، گیلمین جی جی، برنشتاین هورگان، سارنیای زهرا، مروین سی،
Brisch R، Bielau H، میر زو Schwabedissen L، Bogerts B، Myint AM: شدید
افسردگی همراه با افزایش اسید کینولینیک میکروگیلالی در
زیرمجموعه های قارچ قارچی: قاعده ای برای ایمن سازی
انتقال عصبی glutamatergic؟ J Neuroinflammation 2011، 8: 94.
54 Vostrikov VM، Uranova NA، Orlovskaya DD: کمبود Perineuronal
oligodendrocytes در قشر prefrontal در اسکیزوفرنی و خلق و خوی
اختلالات Schizophr Res 2007, 94:273-280.
55 Rajkowska G، Miguel-Hidalgo JJ: Gliogenesis و آسیب شناسی glial در
افسردگی. CNS Neurol Disord Drug Targets 2007، 6:219-233.
56 Uranova NA، Vostrikov VM، Orlovskaya DD، Rachmanova VI:
تراکم Oligodendroglial در قشر پیش فرنتال در اسکیزوفرنیا و
اختلالات خلقی: یک مطالعه از کنسرسیوم نوروپاتولوژی استنلی.
Schizophr Res 2004, 67:269-275.
57 Uranova N: آسیب و از دست دادن oligodendrocytes در مورد بسیار مهم است
پاتوژنز اسکیزوفرنی و اختلالات خلقی (یافته ها
مطالعات بعد از مداخله) Neuropsychopharmacology 2004، 29: S33.
58 Uranova NA، Orlovskaya DD، Vostrikov VM، Rachmanova VI: کاهش یافته است
تراکم ماهواره های oligodendroglial از نورون های هرمی در لایه III در
قشر پیش مغز در اسکیزوفرنی و اختلالات خلقی. اسکیزوفر رز
2002، 53: 107.
59 Vostrikov VM، Uranova NA، Rakhmanova VI، Orlovskaya DD: کاهش یافته است
تراکم سلول oligodendroglial در قشر پیش فرنتال در اسکیزوفرنیا.
Zh Nevrol Psikhiatr Im SS Korsakova 2004، 104:47º51.
60 Uranova NA، Zimina IS، Vikhreva OV، Krukov NO، Rachmanova VI، Orlovskaya
DD: آسیب ناشی از Ultrastructural مویرگی در neocortex در
جنون جوانی. World J Biol Psychiatry 2010، 11:567-578.
61 Hof PR، Haroutunian V، فریدریش VL Jr، Byne W، Buitron C، Perl DP، Davis KL:
از دست دادن و توزیع فضایی تغییر یافته از oligodendrocytes در برتر است
شکنج پیشانی در اسکیزوفرنی Biol Psychiatry 2003، 53:1075-1085.
62 دیویس KL، استوارت DG، فریدمن JI، Buchsbaum M، هاروی PD، Hof PR،
Buxbaum J، Haroutunian V: ماده سفید تغییر در اسکیزوفرنی:
شواهد برای اختلالات مربوط به میلین. ژن ژنیک روانپزشکی 2003،
60:443×456.63. Flynn SW، Lang DJ، Mackay AL، Goghari V، Vavasour IM، Whittall KP، Smith
GN، Arango V، Man JJ، Dwork AJ، Falkai P، Honer WG: ناهنجاریهای
میلینیناسین در اسکیزوفرنیا با استفاده از MRI و پس از مداخله، در in vivo تشخیص داده شد
با تجزیه و تحلیل پروتئین های oligodendrocyte. روانپزشک مولوي 2003
8: 811 820.
64 Uranova NA، Vostrikov VM، Vikhreva OV، Zimina IS، Kolometets NS، Orlovskaya
DD: نقش آسیب شناسی oligodendrocyte در اسکیزوفرنیا. اینتر ج
Neuropsychopharmacol 2007، 10:537-545.
65 Byne W، Kidkardnee S، Tatusov A، Yiannoulos G، Buchsbaum MS،
هاروتونین V: کاهش اسکیزوفرنی مرتبط با عصب و
الیگودندروسیت در هسته تالامیک قدام اولیه.
Schizophr Res 2006, 85:245-253.
66 Hamidi M، Drevets WC، Price JL: کاهش Glial در amygdala در عمده
اختلال افسردگی به علت الیگودندروسیت ها است. Biol روانپزشکی 2004،
55: 563 569.
67 Bayer TA، Buslei R، Havas L، Falkai P: شواهد برای فعال شدن میکروگلاییا در
بیماران مبتلا به بیماری های روانی Neurosci Lett 1999، 271:126-128.
68 Steiner J، Bielau H، Brisch R، Danos P، Ullrich O، Mawrin C، Bernstein HG،
Bogert B: جنبه های ایمنی در نوروبیولوژی خودکشی:
افزایش تراکم میکروگلالی در اسکیزوفرنی و افسردگی است
مرتبط با خودکشی J Psychiatr Res 2008, 42:151-157.
69 رائو جی. اس.، هری جی جی، رپوپورت SI، کیم هویچ: افزایش سمیت و تحریک پذیری
نشانگرهای ضد التهابی عصبی در قشر پیشانی پس از قاعدگی از دو قطبی
بیماران اختلال Mol Psychiatry 2010, 15:384±392.
70 Bernstein HG، Steiner J، Bogerts B: سلولهای گلیال در اسکیزوفرنی:
اهمیت پاتوفیزیولوژیک و عواقب احتمالی درمان.
Expert Rev Neurother 2009، 9:1059-1071.
71 چن SK، Tvrdik P، Peden E، Cho S، Wu S، Spangrude G، Capecchi MR:
منشا خون ریزی جراحی پاتولوژیک در موشهای جهش Hoxb8.
Cell 2010, 141:775×785.
72 آنتونی جی. م.: از بین بردن و رشد با میکروگلاییا. سیگنال علمی 2010، 3: jc8.
73 Wonodi I، Stine OC، Sathyasaikumar KV، Roberts RC، Mitchell BD، Hong LE،
Kajii Y، Thaker GK، Schwarcz R: کینورینین پایدار 3-
بیان ژن مونواکسيژناز و فعاليت آنزيمی در اسکيزوفرنيا
و ارتباط ژنتیکی با اندوفنوتایپ های اسکیزوفرنی. ژنرال آرچ
Psychiatry 2011, 68:665±674.
74 Rizon CL، Lowry CA، Rook GA: التهاب، بهداشت، و
سر و صدا: از دست دادن تماس با coevulated، tolerogenic
میکروارگانیسم ها و پاتوفیزیولوژی و درمان عمده
افسردگی. Arch Gen Psychiatry 2010، 67:1211-1224.
75 Drexhage RC، Hoogenboezem TH، Versnel MA، Berghout A، Nolen WA،
Drexhage HA: فعال سازی شبکه های سلولی تک سلولی و سلولی T در بیماران
با اختلال دوقطبی Brain Behav Immun 2011، 25:1206-1213.
76 Steiner J، Jacobs R، Panteli B، Brauner M، Schiltz K، Bahn S، Herberth M،
وستفال S، Gos T، والتر M، Bernstein HG، Myint AM، Bogerts B: حاد
اسکیزوفرنی همراه با کاهش T سلول و افزایش سلول B است
مصونیت Eur Arch Psychiatry Clin Neurosci 2010، 260:509-518.
77 رتیج JY، Aouizerate B، Tignol J، Bioulac B، Burbaud P، Guehl D: The
فرضیه ایمنی ژنتیکی مبتنی بر گلوتامات در وسواس فکری
اختلال، روش یکپارچه سازی از ژن ها به علائم.
Neuroscience 2010, 165:408×417.
78. Yâksel C, Ongr D: مطالعات طیف سنجی تشدید مغناطیسی
اختلالات مربوط به گلوتامات در اختلالات خلقی. Biol روانپزشکی 2010،
68: 785 794.
79 رائو JS، Kellom M، Reese EA، Rapoport SI، Kim HW: گلوتامات غلط تنظیم شده
و حامل های دوپامین در قشر پیشانی پس از قاعدگی از دو قطبی تشکیل شده است
و بیماران اسکیزوفرنی J Affect Disord 2012، 136:63×71.
80 Bauer D، Gupta D، Harotunian V، Meador-Woodruff JH، McCullumsmith RE:
بیان غیرطبیعی حمل و نقل و انتقال دهنده گلوتامات
مولكول هاي تعاملي در قشر پيشكره اي در بيماران مسن با
جنون جوانی. Schizophr Res 2008, 104:108-120.
81 Matute C، Melone M، Vallejo-Illarramendi A، Conti F: افزایش بیان
از GLT-1 حمل کننده گلوتامات آستروسیتیک در قشر پیشانی
اسکیزوفرنی ها 2005، 49:451 455.
82 Smith RE، Haroutunian V، Davis KL، Meador-Woodruff JH: بیان از
رونویسی حمل کننده آمینو اسید هیجان انگیز در تالاموس افراد
با اسکیزوفرنی Am J Psychiatry 2001, 158:1393-1399.
83 مک کالومسث RE، میادورودروفت JH: آمینو اسید هیجانی استریاتیک
بیان ترانسفورماتور در اسکیزوفرنی، اختلال دوقطبی،
و اختلال افسردگی عمده. Neuropsychopharmacology 2002،
26: 368 375.
84 Pittenger C، Bloch MH، Williams K: اختلالات گلوتامات در وسواس
اختلال اجباری: نوروبیولوژی، پاتوفیزیولوژی و درمان.
Pharmacol Ther 2011، 132:314×332.
85 Hashimoto K: نقش جدید گلوتامات در پاتوفیزیولوژی
اختلال افسردگی اساسی Brain Res Rev 2009، 61:105-123.
86 Hashimoto K، Sawa A، Iyo M: افزایش سطح گلوتامات در مغز از
بیماران مبتلا به اختلالات خلقی Biol Psychiatry 2007، 62:1310-1316.
87 Burbaeva G، Boksha IS، Turishcheva MS، Vorobyeva EA، Savushkina OK،
ترشكینا EB: سنتتاز گلوتامین و گلوتامات دهيدروژناز در
قشر پیش مغلوب بیماران مبتلا به اسکیزوفرنیا. پروگ
Neuropsychopharmacol Biol Psychiatry 2003، 27:675-680.
88 Bhattacharyya S، Khanna S، Chakrabarty K، Mahadevan A، کریستوفر R،
Shankar SK: آنتیبادی های ضد مغز و تحریک کننده
انتقال دهنده های عصبی در اختلال وسواسی-اجباری.
نوروسایکوفارماکولوژی 2009، 34:2489-2496.
89 Sanacora G، Gueorguieva R، Epperson CN، Wu YT، Appel M، Rothman DL،
Krystal JH، Mason GF: تغییرات خاصی از زیرمجموعه گامایامینی توبولی
اسید و گلوتامات در بیماران مبتلا به افسردگی عمده.
Arch Gen Psychiatry 2004، 61:705-713.
90 مارشن، مؤسسه ون دین Heuvel MP، Klomp DW، Kahn RS، Luijten PR، Hulshoff
پلی استر: گلوتامات در اسکیزوفرنی: یک مرور متمرکز و متا آنالیز
از مطالعات 1H-MRS. Schizophr Bull 2013، 39:120-129.
91 لیو ی، هو RC، مك A: اینترلوكین (IL) -6، فاكتور نكروز تومور آلفا
(TNF-alpha) و گیرنده های اینترلوکین-2 محلول (sIL-2R) در
بیماران مبتلا به اختلال افسردگی عمده: یک متاآنالیز و متاثر کننده.
J Affect Disord 2012، 139:230:239.
92 Brietzke E، Stabellini R، Grassis-Oliveira R، Lafer B: سیتوکین ها در دو قطبی
اختلال: یافته های اخیر، اثرات زیان آور اما وعده برای آینده
درمان CNS Spectr 2011. www.cnsspectrums.com/aspx/
articledetail.aspx؟ articleid = 3596.
93 دنیس د، Fluitman S، Kavelaars A، Heijnen C، Westenberg H: کاهش یافته است
فعالیت TNF-alpha و NK در اختلال وسواسی-اجباری.
Psychoneuroendocrinology 2004، 29:945-952.
94 Brambilla F، Perna G، Bellodi L، Arancio C، Bertani A، Perini G، Carraro C، Gava
F: غلظت بتا اینترلوکین-1 پلاسما و غلظت فاکتور نکروز تومور در
اختلالات وسواسی جبری Biol Psychiatry 1997, 42:976-981.
95 Fluitman S، Denys D، Vulink N، Schutters S، Heijnen C، Westenberg H:
تولید سیتوکین ناشی از Lipopolysaccharide در ناخوشایندی وسواسی
اختلال و اختلال اضطراب اجتماعی عمومی. روانپزشکی
Res 2010, 178:313-316.
96 Janelidze S، Mattei D، Westrin A، Traskman-Bendz L، Brundin L: Cytokine
سطوح در خون ممکن است اقدامات خودکشی را از افسردگی تشخیص دهد
بیماران. Brain Behav Immun 2011، 25:335-339.
97 پستی M، Costallat LT، Appenzeller S: علائم عصبشناسی در
لوپوس سیستمیک لوژوس اریتماتوز: اپیدمیولوژی، پاتوفیزیولوژی و
مدیریت. CNS Drugs 2011، 25:721-736.
98 Kozora E، Hanly JG، Lapteva L، Filley CM: اختلال شناختی در
لوپوس سیستمیک لوژوییک: گذشته، حال و آینده.
آرتریت روم 2008، 58:3286-3298.
99 Lancaster E، Martinez-Hernandez E، Dalmau J: انسفالیت و آنتی بادی های آن
پروتئین های سطح سلول های سیناپسی و عصبی عصب شناسی 2011، 77:179-189.
100 Dalmau J، Lancaster E، Martinez-Hernandez E، Rosenfeld MR، Balice-Gordon
R: تجربه بالینی و تحقیقات آزمایشگاهی در بیماران مبتلا به antiNMDAR
آنسفالیت Lancet Neurol 2011، 10:63-74.
101 لای M، Huijbers MG، Lancaster E، Graus F، بتالر L، Balice-Gordon R، Cowell
JK، Dalmau J: بررسی LGI1 به عنوان آنتی ژن در آنسفالیت لنبی
قبلا به کانال های پتاسیم نسبت داده شده است: یک سری موارد. لانست نورل
2010 ، 9: 776 785.
102 Lancaster E، Huijbers MG، Bar V، Boronat A، Wong A، Martinez-Hernandez E،
ویلسون سی، جاکوبز د، لای م، واکر RW، Graus F، بتالر L، ایللا I، مارک س، استراوس
KA، Peles E، Scherer SS، Dalmau J: تحقیقات در مورد caspr2، یک آنتی ژن خودکار
آنسفالیت و نورومیوتونی. آن نورول 2011، 69:303 311.
103 لنکستر E، لای م، پنگ X، هیوز E، Constantinescu R، Raizer J، فریدمن
D، Skeen MB، Grisold W، Kimura A، Ohta K، Iizuka T، Guzman M، Graus F،
Moss SJ، Balice-Gordon R، Dalmau J: آنتی بادی گیرنده GABA (B) در
آنسفالیت لنفی با تشنج: سری موارد و مشخصه های آن
آنتی ژن Lancet Neurol 2010، 9:67:76.
104 لنکستر E، مارتینز-هرناندز E، تیتولر MJ، Boulos M، Weaver S، Antoine
JC، Liebers E، Kornblum C، Bien CG، Honnorat J، Wong S، Xu J، Contractor A،
Balice-Gordon R، Dalmau J: آنتی بادی گلوتات متابوتروپیک
گیرنده 5 در سندرم افلیا Neurology 2011, 77:1698-1701.105. Ances BM، Vitaliani R، Taylor RA، Liebeskind DS، Voloschin A، Houghton DJ،
Galetta SL، Dichter M، Alavi A، Rosenfeld MR، Dalmau J: Responsive Treatment
آنسفالیت لنبی با شناسایی آنتی بادی های نوروپیل: MRI و
PET همبستگی دارد. Brain 2005, 128:1764-1777.
106 Tofaris GK، ایران SR، Cheeran BJ، Baker IW، Cader ZM، وینسنت A:
کروی پاسخ دهنده ایمونوتراپی به عنوان ویژگی ارائه دهنده LGI1-
آنسفالیت آنتی بادی عصب شناسی 2012، 79:195-196.
107 نجار S، پرولمان د، نجار A، غیاثیان V، زاگزاق د، دیوینسکی O:
آنسفالیت اتوایمیون Extralimbic مرتبط با اسید گلوتامیک
آنتی بادی های دكربكسلاز: يك نهاد تشخيص ناقص صرع بوهو
2011 ، 21: 306 313.
108 تیتولر MJ، McCracken L، Gabilondo I، Armangue T، Glaser C، Iizuka T، Honig
LS، Benseler SM، Kawachi I، مارتینز هرناندز E، Aguilar E، Gresa-Arribas N،
رایان-فلورانس N، تورنتز A، سیز آ، رزنفلد MR، Balice-Gordon R، Graus F،
Dalmau J: درمان و عوامل پیش آگهی برای نتایج درازمدت در
بیماران مبتلا به آنسفالیت های گیرنده anti-NMDA: یک گروه کوهورت مشاهده شده
مطالعه. Lancet Neurol 2013، 12:157×165.
109 Dalmau J، Gleichman AJ، Hughes EG، Rossi JE، Peng X، Lai M، Dessain SK،
Rosenfeld MR، Balice-Gordon R، Lynch DR: گیرنده anti-NMDA
آنسفالیت: مجموعه مورد و تجزیه و تحلیل اثرات آنتی بادی.
Lancet Neurol 2008، 7:1091-1098.
110 Graus F، Boronat A، Xifro X، Boix M، Svigelj V، Garcia A، Palomino A، Sabater
L، Alberch J، Saiz A: مشخصات بالینی پیشرفته گیرنده anti-AMPA
آنسفالیت Neurology 2010, 74:857~859.
111 لا M، هیوز EG، پنگ X، ژو L، Gleichman AJ، Shu H، Mata S، Kremens
D، Vitaliani R، Geschwind MD، Bataller L، Kalb RG، Davis R، Graus F، Lynch DR،
Balice-Gordon R، Dalmau J: آنتی بادی گیرنده AMPA در لنفیک
انسفالیت مکان گیرنده سیناپسی را تغییر می دهد. آن نورول 2009، 65:424 434.
112 نجار س، پیرلمان د، دهینسکی ع، نجار آ، نادخانی س، باتلر ت، زاگ زاگ دی:
آنسفالیت اتوایمیون نوروپسیتیک با پیچیدگی VGKC منفی
NMDAR و آنتیبادی های GAD: گزارش مورد و بررسی ادبیات،
آینده Cogn Behav Neurol. در مطبوعات.
113 نجار S، Pearlman D، Zagzag D، Devinsky O: خود به خود حل و فصل
آنسفالیت لنفاوی autoimmune seronegative. Cogn Behav Neurol 2011،
24: 99 105.
114 Gabilondo I، Saiz A، Galan L، Gonzalez V، Jadraque R، Sabater L، Sans A،
Sempere A، Vela A، Villalobos F، Viâals M، Villoslada P، Graus F: تجزیه و تحلیل
عود در آنسفالیت ضد NMDAR. عصب شناسی 2011، 77:996 999.
115 بری هار، هاردیمان O، هیلی DG، Keogan M، Moroney J، Molnar PP، Cotter
DR، مورفی KC: آنسفالیت گیرنده anti-NMDA: مهم است
تشخیص افتراقی در روان پریشی Br J Psychiatry 2011، 199:508-509.
116 Dickerson F، Stallings C، Vaughan C، Origoni A، Khushalani S، Yolken R:
آنتیبادیها به گیرنده گلوتامات در مانیا. اختلال دوقطبی 2012،
14: 547 553.
117 O'Loughlin K، Ruge P، McCauley M: انسفالیت و اسکیزوفرنی: یک
موضوع کلمات ج J روانپزشکی 2012، 201: 74.
118 Parratt KL، Allan M، Lewis SJ، Dalmau J، Halmagyi GM، Spies JM: حاد
بیماری روانی در یک زن جوان: شکل غیر معمول آنسفالیت.
Med J Aust 2009، 191:284-286.
119 Suzuki Y، Kurita T، Sakurai K، Takeda Y، Koyama T: گزارش موردی از ضد NMDA
آنسفالیت گیرنده مشکوک به اسکیزوفرنیا. Seishin Shinkeigaku
Zasshi 2009, 111:1479-1484.
120 Tsutsuki K، Kanbayashi T، Tanaka K، Boku S، Ito W، Tokunaga J، Mori A،
Hishikawa Y، Shimizu T، Nishino S: آنتی بادی گیرنده anti-NMDA شناسایی شده است
در آنسفالیت، اسکیزوفرنی، و نارکولپسی با ویژگی های روانی.
BMC روانپزشکی 2012، 12: 37.
121 ون پوتن WK، Hachimi-Idrissi S، Jansen A، Van Gorp V، Huyghens L:
علت غیر معمول رفتار روان پریشی در یک دختر 9 ساله: یک پرونده
گزارش. گزارش مورد Med 2012، 2012: 358520.
122 Masdeu JC، Gonzalez-Pinto A، Matute C، Ruiz De Azua S، Palomino A، De
Leon J، Berman KF، Dalmau J: آنتی بادی IgG سرم در برابر NR1
زیربخش گیرنده NMDA در اسکیزوفرنیا تشخیص داده نشده است. ام جی
Psychiatry 2012, 169:1120±1121.
123 Kirvan CA، Swedo SE، Kurahara D، Cunningham MW: تقلید استریپتوكك
و سیگنالینگ سلولی متصل به آنتی بادی در پاتوژنز
کریه سیدنهام. خودایمنی 2006، 39:21:29.
124 Swedo SE: عفونت استرپتوکوکال، سندرم تورات و OCD: وجود دارد
یک ارتباط؟ پانداها: اسب یا گورخر؟ Neurology 2010, 74:1397–1398.
125 Morer A، Lazaro L، Sabater L، Massana J، Castro J، Graus F: Antineuronal
آنتیبادی ها در یک گروه از کودکان مبتلا به اختلال وسواسی-اجباری
و سندرم تورت J Psychiatr Res 2008، 42:64-68.
126 Pavone P، Bianchini R، Parano E، Incorpora G، Rizzo R، Mazzone L، Trifiletti RR:
آنتیبادیهای ضد مغز در PANDAS و استرپتوکوک بدون عارضه
عفونت Pediatr Neurol 2004، 30:107-110.
127 مینا G، آلبرت U، Bogetto F، Borghese C، Berro AC، Mutani R، روسی F،
Vigliani MC: آنتیبادیهای ضد مغز در بزرگسالان مبتلا به وسواس فکری
بی نظمی J Affect Disord 2009، 116:192-200.
128 Brimberg L، Benhar I، Mascaro-Blanco A، Alvarez K، Lotan D، Winter C، Klein J،
موس AE، Somnier FE، Leckman JF، Swedo SE، Cunningham MW، Joel D:
تغييرات رفتاري، دارويي و ايمونولوژي پس از
قرار گرفتن در معرض استرپتوكوك: یک مدل جدید موش سیدنام chorea و
اختلالات روانپزشکی مرتبط است. Neuropsychopharmacology 2012،
37: 2076 2087.
129 دیل رادیو، کاندلر PM، کلیسای AJ، منتظر R، Pocock JM، Giovannoni G:
آنزیمهای سطح گلوکولیت سطح نورون اهداف خودکارآنتیتیگن در
بیماری CNS پس از استرپتوکوک است. J Neuroimmunol 2006،
172: 187 197.
130 نیکلسون TR، فردیناندو S، کریشناای RB، Anhoury S، Lennox BR، MataixCols
D، Cleare A، DM Veale، Drummond LM، Fineberg NA، کلیسای AJ،
Giovannoni G، Heyman I: شيوع آنتيبادي هاي ضد انقباضي گانگليا در
اختلال وسواسی- اجباری بالغ: مطالعه مقطعی. ج ج روانپزشکی
2012 ، 200: 381 386.
131 وو ک، هانا GL، رزنبرگ DR، آرنولد PD: نقش گلوتامات
سیگنالینگ در پاتوژنز و درمان وسواسی-اجباری است
بی نظمی Pharmacol Biochem Behav 2012، 100:726-735.
132 Perlmutter SJ، Leitman SF، Garvey MA، Hamburger S، Feldman E، Leonard
HL، Swedo SE: تبادل پلاسما درمانی و تزریق داخل وریدی
ایمونوگلوبولین برای اختلال وسواسی-اجباری و اختلالات تیک در
دوران کودکی. Lancet 1999، 354:1153-1158.
133 Pereira A Jr، Furlan FA: Astrocytes و شناخت انسان: مدل سازی
ادغام اطلاعات و مدولاسیون فعالیت های عصبی.
Prog Neurobiol 2010، 92:405×420.
134 Barres BA: رمز و راز و سحر و جادو glia: چشم انداز نقش خود را در
سلامتی و بیماری Neuron 2008، 60:430×440.
135 Verkhratsky A، Parpura V، Rodriguez جی جی جی جی: جایی که افکار در آن زندگی می کنند:
فیزیولوژی "شبکه عصبی منتشر شده" عصبی-گلیال ". Brain Res Rev 2011،
66: 133 151.
136 Sofroniew MV: تشخیص مولکولی آسترولیوز واکنشی و زخم گلیال
تشکیل. Trends Neurosci 2009، 32:638-647.
137 همیلتون NB، Attwell D: آیا آستروسیت واقعا انتقال دهنده های عصبی را از بین می برد؟
Nat Rev Neurosci 2010، 11:227-238.
138 Rajkowska G: مطالعات پس از مداخله در اختلالات خلقی تغییر یافته است
تعداد نورون ها و سلول های گلیال Biol Psychiatry 2000، 48:766-777.
139 کوپلند نیوجرسی، اوجیویوی CJ، هگادورن KM، سریز P، هانستاک CC، آلن PS:
Myo-inositol prefrontal در اختلال افسردگی عمده کاهش یافته است.
Biol Psychiatry 2005، 57:1526±1534.
140 میگوئل هیدالگو جی جی، یورو هورزر، جی جی جی جی، مولتگر هی، دیتر لی، کنیک ل،
Stockmeier CA، Rajkowska G: ایمنی فعال عروقی و عروقی
برای مولکول چسبندگی بین سلولی 1 در قشر اوربیتولین
افراد دارای افسردگی عمده: تغییرات وابسته به سن. J اختلال را تحت تاثیر قرار می دهد
2011 ، 132: 422 431.
141 میگوئل هیدالگو جی جی، وای جی آر ای، اندرو م، یورو هلر جی. سی.، جوریس گ.، Stockmeier
CA، Rajkowska G: پاتولوژی Glia در قشر پیشانی در الکل
وابستگی به علائم افسردگی و بدون آن. Biol روانپزشکی 2002،
52: 1121 1133.
142 Stockmeier CA، Mahajan GJ، Konick LC، Overholser JC، Jurjus GJ، Meltzer HY،
Uylings HB، Friedman L، Rajkowska G: تغییرات سلولی در پس از سانحه
هیپوکامپ در افسردگی اساسی Biol Psychiatry 2004، 56:640~650.
143. Ongðr D, Drevets WC, Price JL: کاهش گلیال در قسمت زیرجنسی پری فرونتال
قشر در اختلالات خلقی Proc Natl Acad Sci USA 1998، 95:13290-13295.
144 Gittins RA، Harrison PJ: مطالعه مرفومتری گلایا و نورون در
قشر کورتکس قدامي قدامي در اختلال خلقي. J اختلال در عملکرد 2011،
133: 328 332.
145 Cotter D، Mackay D، Beasley C، Kerwin R، Everall I: کاهش چگالی گلی
و حجم عضلانی در اختلال افسردگی عمده و اسکیزوفرنیا در
قشر مفصل کورتکس [انتزاعی]. اسکیزوفرنی Res 2000، 41: 106.
146 Si X، Miguel-Hidalgo JJ، Rajkowska G: بیان GFAP در
قشر پیشانی غدد درون رحم در افسردگی. در انجمن علوم اعصاب؛ 2003
نشست Neuroscience Planne: نیواورلئان؛ 2003
147 Legutko B، Mahajan G، Stockmeier CA، Rajkowska G: ماده سفید آستروسیت
در افسردگی کاهش می یابد. در انجمن علوم اعصاب. نشست عصبشناسی
برنامه ریزان: واشنگتن دی سی؛ 2011.148 Edgar N، Sibille E: نقش عملکردي احتمالی اليگودندروسيت ها در
مقررات خلق و خوی ترجمه روانپزشکی 2012، 2: e109.
149 Rajkowska G، Halaris A، سلیمون LD: کاهش در نورونال و گلیال
چگالی ستون فقرات دو طرفه در دو قطبی را مشخص می کند
بی نظمی Biol Psychiatry 2001، 49:741-752.
150 Cotter D، Mackay D، Chana G، Beasley C، Landau S، Everall IP: کاهش یافته است
اندازه عضلانی و چگالی سلول گلیال در ناحیه 9 دوردولا
قشر پیش مغز در افراد مبتلا به اختلال افسردگی عمده. Cereb قشر
2002 ، 12: 386 394.
151 Stark AK، Uylings HB، Sanz-Arigita E، Pakkenberg B: از دست دادن سلول گلیال در
قشر مفصلی قدامي قدامي، زيرمجموعه قشر پيشاني، در
افراد مبتلا به اسکیزوفرنی Am J Psychiatry 2004، 161:882-888.
152 Konopaske GT، Dorph-Petersen KA، Sweet RA، Pierry JN، Zhang W، Sampson
AR، لوئیس DA: اثر قرار گرفتن در معرض آنتیس سیستوتی مزمن بر آستروسیت و
الیگودندروسیت ها در میمون های ماکائو. Biol روانپزشکی 2008،
63: 759 765.
153 Selemon LD، Lidow MS، Goldman-Rakic PS: افزایش حجم و گلیال
تراکم در قارچ پیش فونتیال اولترات همراه با مزمن
قرار گرفتن در معرض داروهای آنتی سایکوتیک Biol Psychiatry 1999، 46:161-172.
154 استینر جی، برنشتاین هورگان، بیلو هار، فورکاس ن، زمستان ج، دابروولنی ه، بریسچ ر،
Gos T، Mawrin C، Myint AM، Bogert B: GIIA S100B-immunopositive
در مقایسه با اسکیزوفرنی باقی مانده در پارانوئید افزایش یافته است: a
مطالعه مورفومتریک J Psychiatr Res 2008, 42:868-876.
155 کارتر CJ: زنده ماندن eIF2B و oligodendrocyte: جایی که طبیعت و پرورش است
اختلال دوقطبی و اسکیزوفرنیا را ببینید؟ Schizophr Bull 2007،
33: 1343 1353.
156 هیاشی ی، نیهونماسو-کیکوچی نان، هیشاناگا س، یو جی جی، تاتبیاشی ی:
شباهت های نوروپاتولوژیک و تفاوت بین اسکیزوفرنیا
و اختلال دوقطبی: یک مطالعه مغناطیسی پس از سانحه جریان سیاتومتری.
PLoS یک 2012، 7: e33019.
157 Uranova NA، Vikhreva OV، Rachmanova VI، Orlovskaya DD: Ultrastructure
تغییرات فیبرهای میلینین و الیگودندروسیت ها در پیش فرنتن
قشر در اسکیزوفرنی: یک مطالعه ی مورفومتری بعد از قاعدگی.
درمان اسکیزوفر درمان 2011، 2011: 325789.
158 Torres-Platas SG، Hercher C، Davoli MA، Maussion G، Labonte B، Turecki
G، Mehhwar N: هیپرتروفی آستروسیتیک در سینگوی سفید قدام
موضوع خودکشی افسرده. Neuropsychopharmacology 2011،
36: 2650 2658.
159 Pereira A Jr، Furlan FA: در نقش هماهنگی برای نورون-آستروسیت
تعاملات و پردازش آگاهانه ادراکی. J Biol Phys 2009،
35: 465 480.
160 Kettenmann H، Hanisch UK، Noda M، Verkhratsky A: فیزیولوژی
میکروگلیا Physiol Rev 2011، 91:461 553.
161 Tremblay ME، Stevens B، Sierra A، Wake H، Bessis A، Nimmerjahn A: نقش
میکروگلیا در مغز سالم J Neurosci 2011، 31:16064-16069.
162 Kaindl AM، Degos V، Peineau S، Gouadon E، Chhor V، Loron G، Le
Charpentier T، Josserand J، Ali C، Vivien D، Collingridge GL، Lombet A، Issa L،
رنه F، Loeffler JP، Kavelaars A، Verney C، Mantz J، Gressens P: فعال سازی
گیرنده های N-methyl-D-aspartate microglial باعث التهاب و
مرگ سلول های عصبی در مغز در حال توسعه و بالغ. ان Neurol
2012 ، 72: 536 549.
163 Schwartz M، Shaked I، فیشر جی، Mizrahi T، Schori H: محافظ
خود ایمنی علیه دشمن در درون: مبارزه با مسمومیت گلوتامات.
Trends Neurosci 2003، 26:297-302.
164 Pacheco R، Gallart T، Lluis C، Franco R: نقش گلوتامات در سلول T
مصونیت واسطه J Neuroimmunol 2007، 185:9-19.
165 نجار س، پرولمان د، میلر دكتر، دویینسك O: صرع مقاوم در برابر جراحی
با فعال سازی میکروگلیال متخصص مغز و اعصاب 2011، 17:249 254.
166 Schwartz M، Butovsky O، Bruck W، Hanisch UK: فنوتیپ Microglial: این است
تعهد برگشت پذیر؟ Trends Neurosci 2006، 29:68-74.
167 وانگ F، Wu H، Xu S، Guo X، Yang J، Shen X: مهاجرت ماکروفاژ
مهارکننده پروتئین E2 سیکلوکوکسیژناز 2-prostaglandin را در کشت فعال می کند
میکروگلیای ستون فقرات Neurosci Res 2011، 71:210-218.
168 ژانگ XY، Xiu MH، آهنگ C، Chenda C، Wu GY، Haile CN، Kosten TA، Kosten
TR: افزایش سطح سرمی S100B در داروهای بدون درمان و دارویی
بیماران اسکیزوفرنی J Psychiatr Res 2010, 44:1236-1240.
169 Kawasaki Y، Zhang L، Cheng JK، Ji RR: مکانیزم های سیتوکین مرکزی
حساسیت: نقش متمایز و همپوشانی اینترلوکین-1beta،
اینترلوکین-6 و عامل ناباروری تومور آلفا در تنظیم سیناپسی و
فعالیت نورونی در نخاع سطحی. J Neurosci 2008،
28: 5189 5194.
170. Müller N, Schwarz MJ: اساس ایمونولوژیک گلوتاماترژیک
اختلال در اسکیزوفرنی: به سوی دیدگاه یکپارچه. J عصبی
Transm Suppl 2007، 72:269×280.
171 Hestad KA، Tonseth S، Stoen CD، Ueland T، Aukrust P: افزایش سطح پلاسما
فاکتور ناباروری تومور آلفا در بیماران مبتلا به افسردگی: عادی سازی
در طول درمان با تشنج الکتریکی J ECT 2003، 19:183-188.
172 Kubera M، Kenis G، Bosman E، Zieba A، Dudek D، Nowak G، Maes M:
سطوح پلاسمای اینترلوکین-6، اینترلوکین-10 و گیرنده اینترلوکین-1
آنتاگونیست در افسردگی: مقایسه بین حالت حاد و پس از آن
بهبودی Pol J Pharmacol 2000، 52:237-241.
173 میلر BJ، باکلی P، Seabolt W، Mellor A، Kirkpatrick B: متاآنالیز از
تغییرات سیتوکین در اسکیزوفرنی: وضعیت بالینی و آنتی سایکوتیک
اثرات Biol Psychiatry 2011، 70:663-671.
174 پوتین S، Stip E، سپری AA، Gendron A، Bah R، Kouassi E: التهاب
تغییرات سیتوکین در اسکیزوفرنی: یک بررسی کمی سیستماتیک.
Biol Psychiatry 2008، 63:801±808.
175 Reale M، Patruno A، De Lutiis MA، Pesce M، Felaco M، Di Giannantonio M، Di
نیکولا م، Grilli A: اختلال در تنظیم تولید شیمیایی سیتوکین در
بیماران اسکیزوفرنیک در مقایسه با کنترل های سالم. BMC Neurosci 2011، 12: 13.
176 Fluitman SB، Denys DA، Heijnen CJ، Westenberg HG: انزجار بر TNFalpha اثر می گذارد،
سطح IL-6 و نورآدرنالین در بیماران مبتلا به وسواس فکری
بی نظمی Psychoneuroendocrinology 2010، 35:906-911.
177 Konuk N، Tekin IO، Ozturk U، Atik L، Atasoy N، Bektas S، Erdogan A: پلاسما
سطوح فاکتور نكروز تومور-آلفا و اینترلوكین-6 در وسواس
اختلال اجباری واسطه التهاب 2007، 2007: 65704.
178 Monteleone P، Catapano F، Fabrazzo M، Tortorella A، Maj M: کاهش یافته است
سطح خون فاکتور نکروز تومور در بیماران مبتلا به وسواس فکری
بی نظمی Neuropsychobiology 1998، 37:182-185.
179 Marazziti D، Presta S، Pfanner C، Gemignani A، Rossi A، Sbrana S، Rocchi V،
Ambrogi F، Cassano GB: تغییرات ایمنی در بزرگسالان وسواس فکری
بی نظمی Biol Psychiatry 1999، 46:810-814.
180 Zai G، Arnold PD، Burroughs E، Richter MA، کندی JL: نکروز تومور
ژن factor-alpha با اختلال وسواس فکری همراه نیست.
روانپریشی ژن 2006، 16: 43.
181. رودروگز AD، Gonzolez PA، Garcâ MJ، de la Rosa A، Vargas M، Marrero F:
تغییرات دوره ای در غلظت سیتوکین های ضد التهابی در حاد
انفارکتوس میوکارد Rev Esp Cardiol 2003، 56:555×560.
182 الیور جی. سی.، باند لا، اتینگر CW، آردینو MJ، McAllister SK، Aguero SM،
Favero MS: سینتیک سیتوکین در یک مدل خون کامل درون آزمایشگاهی زیر است
چالش اندوتوکسین Lymphokine Cytokine Res 1993، 12:115-120.
183 Le T، Leung L، Carroll WL، Schibler KR: تنظیم ژن اینترلوکین-10
بیان: مکانیزم های احتمالی که برای اصلاح آن و برای
اختلاف بلوغ بیان آن با سلول های تک هسته ای خون.
Blood 1997, 89:4112~4119.
184 لی MC، Ting KK، آدامز S، Brew BJ، Chung R، Guillemin GJ:
تشخیص بیان گیرنده های NMDA در انسان
آستروسیت ها PLoS یک 2010، 5: e14123.
185 Myint AM، Kim YK، Verkerk R، Scharpe S، Steinbusch H، Leonard B:
مسیر Kynurenine در افسردگی عمده: شواهدی از اختلال
محافظت عصبی J Affect Disord 2007، 98:143-151.
186 Sanacora G، Treccani G، Popoli M: به سوی یک فرضیه گلوتامات
افسردگی: مرز ظهور نوروپسیکوفارکولوژی برای
اختلالات خلقی نوروفارماکولوژی 2012، 62:63 77.
187 صالح A، شرودر م، جانكاننس C، هارتونگ HP، مودر U، Jander S: در
MRI Vivo التهاب مغزی در سکته مغزی ایسکمیک انسانی. مغز 2004،
127: 1670 1677.
188 Tilleux S، Hermans E: التهاب عصبی و تنظیم glutamate glial
جذب در اختلالات عصبی J Neurosci Res 2007، 85:2059-2070.
189 هلمز HC، Madelung R، Waagepetersen HS، Nielsen CU، Brodin B: در آزمایشگاهی
شواهد برای فرضیه خروج گلوتامات مغز: اندوتلیال مغزی
سلول هایی که با آستروسیت های cocultured شده اند یک مغز به قطر قطبی دارند
انتقال گلوتامات 2012، 60:882 893.
190 لئونارد بی: مفهوم افسردگی به عنوان اختلال در عملکرد سیستم ایمنی
سیستم. Curr Immunol Rev 2010، 6:205-212.
191 Labrie V، Wong AH، Roder JC: مقالات مسیر D-serine به
جنون جوانی. نوروفارماکولوژی 2012، 62:1484-1503.
192 Gras G، Samah B، Hubert A، Leone C، Porcheray F، Rimaniol AC: EAAT
بیان ماکروفاژها و میکروگلاییا: پرسشهای بیشتر از
پاسخ می دهد. اسیدهای آمینه 2012، 42:221×229.
193 لیوینگستون PD، دیکینسون JA، Srinivasan J، Kew JN، Wonnacott S:
تداخل گلوتامات دوپامین در قشر پرهفرونتال موش صحرایی توسط گیرنده های nicotinic Alpha7 و PNU-120596 تقویت می شود. ج مول
Neurosci 2010، 40:172 176.194. Kondziella D، Brenner E، Eyjolfsson EM، Sonnewald U: چگونه glialneuronal
تعاملات مطابق با فرضیه های انتقال دهنده عصبی جریان است
جنون جوانی؟ Neurochem Int 2007، 50:291×301.
195 Huawei Wu، Pereira EF، Bruno JP، Pellicciari R، Albuquerque EX، Schwarcz R: The
اسید کینورینیک آنتاگونیست گیرنده nicotinic alpha7 حاصل از استروسیت
سطوح گلوتامات خارج سلولی را در قشر پرفرانتال کنترل می کند. ج مول
Neurosci 2010، 40:204-210.
196 Steiner J، Bogerts B، Schroeter ML، Bernstein HG: پروتئین S100B در
اختلالات نورودژنراتیو Clin Chem Lab Med 2011، 49:409×424.
197 استینر ج، مارکاردت نیل، پائولس اول، شیلتز ک، رحمان هان، بان س، بوگرت ب
Schmidt RE، Jacobs R: انسان CD8 (+) سلول های T و سلول های NK بیان و
به محض تحریک، S100B ترشح می کند. Brain Behav Immun 2011، 25:1233-1241.
198 Shanmugam N، Kim YS، Lanting L، Natarajan R: مقررات
بیان سیكل اکسیداناز-2 در مونوسیت ها با لیگاسیون گیرنده
برای محصولات نهایی گلیکاسیون پیشرفته J Biol Chem 2003، 278:34834-34844.
199 Rothermundt M، Ohrmann P، Abel S، Siegmund A، Pedersen A، Ponath G،
Suslow T، Peters M، Kaestner F، Heindel W، Arolt V، Pfleiderer B: سلول گلیال
فعال سازی در یک زیر گروه از بیماران مبتلا به اسکیزوفرنیا نشان داده شده توسط
افزایش غلظت سرمی S100B و بالا رفتن myo-inositol.
Prog Neuropsychopharmacol Biol Psychiatry 2007، 31:361-364.
200 Falcone T، فازی V، لی C، سیمون B، فرانکو K، مارسی N، Janigro D: سرم
S100B: یک نشانگر بالقوه برای خودکشی در نوجوانان؟ PLoS یکی
2010، 5: e11089.
201 شروهتل ML، عبدالخالق H، Krebs M، Diefenbacher A، Blasig IE: سرم
نشانگرها از آسیب شناسی گلیال خاصی در افسردگی اصلی حمایت می کنند.
J Affect Disord 2008، 111:271:280.
202 Rothermundt M، Ahn JN، Jorgens S: S100B در اسکیزوفرنی: به روز رسانی.
Gen Physiol Biophys 2009، 28 Spec No Focus: F76-F81.
203 شروهتل ML، عبدالخالق H، Krebs M، Diefenbacher A، Blasig IE: Neuronspecific
enolase تغییر نکرده است در حالیکه S100B در سرم بالا است
بیماران مبتلا به اسکیزوفرنی تحقیقات اولیه و متاآنالیز.
Psychiatry Res 2009, 167:66-72.
204 Rothermundt M، Missler U، Arolt V، Peters M، Leadbeiter J، Wiesmann M،
Rudolf S، Wandinger KP، Kirchner H: افزایش سطح S100B در خون
با بیماران اسکیزوفرنی درمان نشده و درمان شده با آن ارتباط دارند
علائم منفی Mol Psychiatry 2001، 6:445±449.
205 Suchankova P، Klang J، Cavanna C، Holm G، Nilsson S، Jonsson EG، Ekman A:
آیا پلی مورفیسم Gly82Ser در ژن RAGE مربوط به
اسکیزوفرنی و روان گرایی صفات شخصیتی؟ J روانپزشکی Neurosci
2012 ، 37: 122 128.
206 Scapagnini G، Davinelli S، Drago F، De Lorenzo A، Oriani G: آنتی اکسیدان ها به عنوان
داروهای ضد افسردگی: واقعیت یا خیال؟ CNS Drugs 2012، 26:477×490.
207 Ng F، Berk M، Dean O، Bush AI: استرس اکسیداتیو در اختلالات روانپزشکی:
شواهد و پیامدهای درمانی. Int J Neuropsychopharmacol
2008 ، 11: 851 876.
208 سلیم س.، چگو گ، اصغر M: التهاب در اضطراب. محتویات پروتئین شیمی
Struct Biol 2012، 88:1:25.
209 Anderson G، Berk M، Dodd S، Bechter K، Altamura AC، دلسو B، Kanba S،
مونجی ا، فاطمی SH، باکلی پی، دبنات ام، داس UN، مایر یو، مولر ن،
Kanchanatawan B، Maes M: ايمنی التهابی، اکسيداتيو و نيتروژن
استرس و مسیرهای عصبی پیشرفته در علت، البته و درمان
از اسکیزوفرنی Prog Neuropsychopharmacol Biol Psychiatry 2013، 42:1:42.
210 کوهلین جی. م.، ایزیزاكا ك، كانوی SI، ادوارد جی، سیف الدین فاطمه، شیمانو م.،
Daley EL و همکاران: کاهش معنی دار سوپر اکسید دیسموتاز-1 محلول
(SOD1) در مایع مغزی نخاعی بیماران مبتلا به اخیر
جنون جوانی. Mol Psychiatry 2012، 18:10±11.
211 Bombaci M، Grifantini R، Mora M، Reguzzi V، Petracca R، Meoni E، Balloni S،
Zingaretti C، Falugi F، Manetti AG، Margarit I، Musser JM، Cardona F، Orefici
G، Grandi G، Bensi G: پروفايل پروتئيني سرم بيماران مکرر نشان مي دهد
واکنش شدید و واکنش ایمنی نسبت به گروه A
آنتی ژنهای استرپتوکوک PLoS یک 2009، 4: e6332.
212 والریو A، Cardile A، Cozzi V، Bracale R، Tedesco L، Pisconti A، Palomba L،
Cantoni O، Clementi E، Moncada S، Carruba MO، Nisoli E: TNF-alpha
بيان ژن ENOS و بيوگنوز ميتوکندريال در چربي را کاهش ميدهد
و عضله جوندگان چاق J Clin Invest 2006، 116:2791×2798.
213 Ott M، Gogvadze V، Orrenius S، Zhivotovsky B: Mitohondria، اکسیداتیو
استرس و مرگ سلولی آپوپتوز 2007، 12:913-922.
214. Shalev H، Serlin Y، Friedman A: شکستن سد خونی مغزی به عنوان دروازه
به اختلال روانپزشکی روانپزشکی Cardiovasc Neurol 2009، 2009: 278531.
215 Abbott NJ، Ronnback L، Hansson E: تعاملات اندوتلیوم آستروسیت در
سد خونی مغزی Nat Rev Neurosci 2006، 7:41:53.
216 Bechter K، Reiber H، Herzog S، Fuchs D، Tumani H، Maxeiner HG:
آنالیز مایع مغزی نخاعی در طیف عاطفی و اسکیزوفرنی
اختلالات: شناسایی زیر گروه ها با پاسخ های ایمنی و
اختلال عملکرد سد خونی-CSF J Psychiatr Res 2010، 44:321-330.
217 هریس LW، Wayland M، Lan M، رایان M، Giger T، Lockstone H، Woethrich I،
Mimmack M، Wang L، Kotter M، Craddock R، Bahn S: مغزی
microvasculature در اسکیزوفرنی: مطالعه لیزر میکروسیستم.
PLoS یک 2008، 3: e3964.
218 لین JJ، مولا M، هرمان BP: کشف عصبی عصبی
بیماری های همراه صرع در طول عمر Lancet 2012، 380:1180-1192.
219 Isingrini E، Belzung C، Freslon JL، Machet MC، Camus V: اثر فلووکستین بر روی
آستیگماتیک اکسید نیتریک وابسته به اکسید در غیر قابل پیش بینی
مدل تنش خفیف مزمن افسردگی در موش. Psychosom Med 2012،
74: 63 72.
220 ژانگ XY، ژو DF، کائو LY، ژانگ PY، WU GY، Shen YC: اثر
درمان ریسپریدون در سوپراکسید دیسموتاز در اسکیزوفرنیا. جی کلین
Psychopharmacol 2003، 23:128-131.
221 Lavoie KL، Pelletier R، Arsenault A، Dupuis J، Bacon SL: انجمن بین
افسردگی بالینی و عملکرد اندوتلیال توسط سمعک اندازه گیری می شود
واکنش هیپرمی Psychosom Med 2010، 72:20-26.
222 Chrapko W، Jurasz P، Radomski MW، Archer SL، Newman SC، Baker G، Lara N،
Le Melledo JM: تغییر متابولیت های پلاسما NO و
پلاکت NO فعالیت سنتاز توسط پاروکستین در بیماران افسرده.
نوروسایکوفارماکولوژی 2006، 31:1286-1293.
223 Chrapko WE، Jurasz P، Radomski MW، Lara N، Archer SL، Le Melledo JM:
کاهش فعالیت پلاکتی سنتاز نیتریک اکسید و اکسید نیتریک پلاسما
متابولیت ها در اختلال افسردگی اساسی Biol Psychiatry 2004، 56:129-134.
224 Stuehr DJ، Santolini J، Wang ZQ، Wei CC، Adak S: به روز رسانی در مکانیزم
و تنظیم کاتالیزوری در NO synthases. J Biol Chem 2004،
279: 36167 36170.
225 چن W، Druhan LJ، Chen CA، Hemann C، Chen YR، Berka V، Tsai AL، Zweier
JL: پراکسینیتریت باعث تخریب تتراهیدروبیوپترین و
هما در سنتاز اکسید نیتریک اندوتلیال: انتقال از برگشت پذیر به
مهار غیر قابل برگشت آنزیم Biochemistry 2010, 49:3129×3137.
226 چن CA، Wang TY، Varadharaj S، Reyes LA، Hemann C، Talukder MA، چن
YR، Druhan LJ، Zweier JL: S-glutathionylation جدا کردن eNOS و
عملکرد سلولی و عروقی آن را تنظیم می کند. Nature 2010، 468:1115-1118.
227 شابو C، Ischiropoulos H، Radi R: Peroxynitrite: بیوشیمی،
پاتوفیزیولوژی و توسعه درمان. Nat Rev Drug Discov
2007 ، 6: 662 680.
228 GI Papakostas، RC Shelton، Zajecka JM، اعتماد B، Rickels K، Clain A، Baer L،
دالتون ED، Sacco GR، Schoenfeld D، Pencina M، Meisner A، Bottiglieri T،
نلسون E، Mischoulon D، Alpert JE، Barbie JG، Zisook S، Fava M: Lmethylfolate
به عنوان درمان اضافی برای افسردگی عمده مقاوم در برابر SSRI:
نتایج دو آزمایش تصادفی، دو سو کور، موازی-ترتیبی. ام جی
Psychiatry 2012, 169:1267±1274.
229 Antoniades C، Shirodaria C، Warrick N، Cai S، de Bono J، Lee J، Leeson P،
Neubauer S، Ratnatunga C، Pillai R، Refsum H، Channon KM: 5-
متیل تتراهیدروفولات به سرعت عملکرد اندوتلیال را بهبود می بخشد و
تولید سوپر اکسید در عروق انسانی کاهش می یابد: اثرات روی عروق
در دسترس بودن tetrahydrobiopterin و سنتاز اکسید نیتریک اندوتلیال
جفت. تیراژ 2006، 114:1193-1201.
230 Masano T، Kawashima S، Toh R، Satomi-Kobayashi S، Shinohara M، Takaya T،
Sasaki N، Takeda M، Tawa H، Yamashita T، Yokoyama M، Hirata K: سودمند
اثرات تتراهیدروبیوپترین خارجی بر روی بازسازی بطن چپ
پس از انفارکتوس میوکارد در موش صحرایی: نقش احتمالی استرس اکسیداتیو
ایجاد شده توسط سنتز اکسید نیتریک اندوتلیال جدا شده است. Circ J 2008
72: 1512 1519.
231 Alp NJ، کانون KM: تنظیم سنتاز اکسید نیتریک اندوتلیال توسط
تتراهیدروبیوپترین در بیماری عروقی. Arterioscler Thromb Vasc Biol 2004،
24: 413 420.
232 شیمنسکی س، مینا آشتی، زیتو ج، گریت گریفی، بوگرت ب، لیبرمن ج:
گادولینیم-DTPA اسکن شکاف مغناطیسی مغناطیسی افزایش یافته در
اولین قسمت از روان درمانی و بیماران اسکیزوفرنی مزمن.
Psychiatry Res 1991, 40:203-207.
233 Butler T، Weisholtz D، Isenberg N، Harding E، Epstein J، Stern E، Silbersweig
D: تصویربرداری عصبی از اختلال لمبی جلدی در اسکیزوفرنیا و
روانپزشکی مرتبط با صرع: به سوی یک نوروبیولوژی همگرا.
Epilepsy Behav 2012، 23:113±122.234. باتلر تی، مائوز آ، والابهاجوسولا اس، مولر جی، ایچیسه ام، پرش کی، پرویز اف،
فریدمن D، گلدسمیث S، نجار S، آزبورن J، سولنز L، وانگ X، J فرانسه،
Thesen T، Devinsky O، Kuzniecky R، Stern E، Silbersweig D: تصویربرداری
التهاب در بیمار مبتلا به صرع مرتبط با آنتی بادی به
گلوتامیک اسید دکربوکسیلاز [abstract]. درمجموعه های انجمن صرع،
جلد 2 بالتیمور: انجمن صرع آمریکایی؛ 2011: 191.
235 ون Berckel BN، Bossong MG، Boellard R، Kloet R، Schuitemaker A، Caspers
E، Luurtsema G، Windhorst AD، Cahn W، Lammertsma AA، Kahn RS:
فعال شدن میکروگلاییا در ابتلا به اسکیزوفرنی اخیر: کمی (R) -
[11C] مطالعه توموگرافی انتشار پاترون از PK11195. Biol روانپزشکی 2008،
64: 820 822.
236 Doorduin J، de Vries EF، Willemsen AT، de Groot JC، Dierckx RA، Klein HC:
عصب خونی در روانپریشی مرتبط با اسکیزوفرنی: مطالعه PET.
J Nucl Med 2009، 50:1801-1807.
237 Takano A، Arakawa R، Ito H، Tateno A، Takahashi H، Matsumoto R، Okubo Y،
سحارا T: گیرنده های بنزودیازپین محیطی در بیماران مبتلا به مزمن
اسکیزوفرنی: مطالعه PET با [11C] DAA1106. اینتر ج
Neuropsychopharmacol 2010، 13:943-950.
238. مولر ان، شوارتز ام جی، دِنینگ اس، دوهه آ، سرووِسکی آ، گلدشتاین-مولر بی،
Spellmann I، Hetzel G، Maino K، Kleindienst N، Miller HJ، Arolt V، Riedel M:
سلکوکسیب مهار کننده cyclooxygenase-2 اثرات درمانی دارد
افسردگی عمده: نتایج یک دوز کور، تصادفی، پلاسبو
کنترل، تکمیل مطالعه خلبان به reboxetine. روانپزشک مولوي 2006
11: 680 684.
239 سید احمد زاده، جعفری س، فیلیپسی، ناصحی AA، قریشی A، صالحی ب، محبی رشا
S، مولانا رضاخان، کامالي پور A: آزمايش بالينی سلکوکسيب مؤثر
درمان در بیماران مبتلا به افسردگی عمده: دو سوکور و
کارآزمایی کنترل شده با دارونما اضطراب افسردگی 2009، 26:607-611.
240 مندلوویچ جی، کریوین پ.، اسوالد پ.، سوری د، آلبونی س.، برونلو ن:
شروع کاهش فعالیت ضد افسردگی در افسردگی شدید با استفاده از
افزایش استیل های سلیسیلیک اسید: یک مطالعه آزمایشی آزمایشی. کلین اینتر
Psychopharmacol 2006، 21:227-231.
241 Uher R، Carver S، Power RA، Mors O، Maier W، Rietshel M، Hauser J،
Dernovsek MZ، Henigsberg N، Sourery D، Placentino A، Farmer A، McGuffin P:
داروهای ضد التهابی غیر استروئیدی و اثر ضد افسردگی در
اختلال افسردگی اساسی Psychol Med 2012، 42:2027-2035.
242. مولر ان، ریدل ام، شپاخ سی، برندستاتر بی، سوکولو اس، کرامپه کی،
Ulmschneider M، Engel RR، Moller HJ، Schwarz MJ: آنتی سایکوتی سودمند
اثرات درمان افزودنی سلکوکسیب نسبت به ریسپریدون به تنهایی در
جنون جوانی. Am J Psychiatry 2002، 159:1029-1034.
243. Miller N، Riedel M، Schwarz MJ، Engel RR: اثرات بالینی COX-2
مهار کننده های شناخت در اسکیزوفرنیا. Clin Neurosci روانپزشکی ارو
2005 ، 255: 149 151.
244. Miller N، Krause D، Dehning S، Musil R، Schennach-Wolff R، Obermeier M،
Moller HJ، Klauss V، Schwarz MJ، Riedel M: درمان سلکوکسیب در اوایل
مرحله اسکیزوفرنی: نتایج یک تصادفی، دو سو کور، کنترل شده به صورت موضعی
محاکمه افزایش سلکوکسیب درمان amisulpride.
Schizophr Res 2010, 121:118-124.
245 Sayyah M، Boostani H، Pakseresht S، Malayeri A: مقدماتی تصادفی
آزمایش بالینی دو سو کور بر اثربخشی سلکوکسیب به عنوان یک مکمل در
درمان اختلال وسواسی-اجباری. روانپزشکی Res 2011
189: 403 406.
246 Sublette ME، Ellis SP، Geant AL، Man JJ: متاآنالیز اثرات
Eicosapentaenoic acid (EPA) در آزمایشات بالینی در افسردگی. جی کلین
Psychiatry 2011, 72:1577±1584.
247 Bloch MH، Hannestad J: اسیدهای چرب امگا-3 برای درمان
افسردگی: بررسی سیستماتیک و متاآنالیز. روانپزشک مولوي 2012
17: 1272 1282.
248 Keller WR، Kum LM، Wehring HJ، Koola MM، Buchanan RW، کلی DL: A
بررسی عوامل ضد التهابی برای علائم اسکیزوفرنیا.
J Psychopharmacol
249 وارنر اشمیت JL، Vanover KE، چن EY، مارشال JJ، Greengard P:
اثرات ضد افسردگی بازدارنده های انتخابی بازدارنده سروتونین (SSRIs)
با داروهای ضد التهابی در موش و انسان از بین می روند. Proc Natl
Acad Sci USA 2011، 108:9262-9267.
250 گالاگر PJ، کاسترو V، فوا م، Weilburg JB، مورفی SN، Gainer VS، چرچیل
SE، Kohane IS، Iosifescu DV، Smoller JW، Perlis RH: پاسخ های ضد افسردگی
در بیماران مبتلا به افسردگی عمده در معرض NSAIDs: a
مطالعه داروسازی Am J Psychiatry 2012، 169:1065-1072.
251 Shelton RC: آیا استفاده همزمان از NSAID ها اثربخشی را کاهش می دهد
داروهای ضد افسردگی؟ Am J Psychiatry 2012، 169:1012-1015.
252 مارتینز گروس I، پرز نیواس BG، گارسیا بوئنو B، مادیرال ال جی، آندرس استبان
E، رودریگز-جیمیز R، Hoenicka J، Palomo T، Rubio G، Leza JC:
پروستاگلاندین ضد التهابی 15d-PGJ2 و گیرنده هسته ای آن
PPARgamma در اسکیزوفرنی کاهش می یابد. اسکیزوفر رز 2011
128: 15 22.
253 گارسیا بوئنو B، پرز نیواس BG، لیزا JC: آیا نقش هسته ای وجود دارد؟
گیرنده PPARgamma در بیماری های عصبی-روانپزشکی؟ اینتر ج
Neuropsychopharmacol 2010، 13:1411-1429.
254 Meyer U: سیگنال ضد التهابی در اسکیزوفرنی. مغز بهوان
Immun 2011، 25:1507-1518.
255 Ramer R، Heinemann K، Merkord J، Rohde H، Salamon A، Linnebacher M،
هینز B: COX-2 و PPAR-gamma از آپوپتوز ناشی از کانابیدیول
سلول های سرطان ریه انسان Mol Cancer Ther 2013، 12:69×82.
256 هنری CJ، هوانگ ی، وین A، Hanke M، Himler J، Bailey MT، Sheridan JF،
Godbout JP: Minocycline باعث کاهش لیپوپلی ساکارید (LPS) می شود
التهاب عصبی، رفتار بیماری و اندونیا.
J Neuroinflammation 2008، 5: 15.
257 ساریس ج، Mischoulon D، Schweitzer I: امگا 3 برای اختلال دوقطبی: متانالیس
استفاده در مانیا و افسردگی دو قطبی. J Clin روانپزشکی 2012،
73: 81 86.
258 Amminger GP، Schafer MR، Papageorgiou K، Klier CM، Cotton SM، Harrigan
SM، Mackinnon A، McGorry PD، Berger GE: اسیدهای چرب امگا-3 طولانی مدت
برای پیشگیری از اختلالات روانپریشی مشخص شده: تصادفی، کنترل شده به صورت موضعی
آزمایش. Arch Gen Psychiatry 2010، 67:146-154.
259 Fusar-Poli P، Berger G: مداخلات اسید ایکوساپنتانوئیک در
اسکیزوفرنی: متاآنالیز مطالعات تصادفی و کنترل شده با پلاسبو.
J Clin Psychopharmacol 2012، 32:179-185.
260 Zorumski CF، Paul SM، Izumi Y، Covey DF، Mennerick S: Neurosteroids،
استرس و افسردگی: فرصت های بالقوه درمانی.
Neurosci Biobehav Rev 2013، 37:109-122.
261 Uhde TW، Singareddy R: تحقیقات بیولوژیک در اختلالات اضطرابی. که در
روانپزشکی به عنوان علوم اعصاب. ویرایش توسط خوان چی لی، ولفگانگ G، ماری م،
نورمن اس. چیچستر: جان وایلی و پسران، با مسئولیت محدود. 2002: 237~286.
262 گیبسون SA، Korado Z، شلتون RC: استرس اکسیداتیو گلوتاتیون
پاسخ در فرهنگ های بافت از افراد دارای افسردگی عمده.
J Psychiatr Res 2012، 46:1326-1332.
263 Nery FG، Monkul ES، Hatch JP، Fonseca M، Zunta-Soares GB، Frey BN،
Bowden CL، Soares JC: Celecoxib به عنوان مکمل در درمان
اختلال افسردگی یا مخلوط اختلال دوقطبی: دو سوکور،
مطالعه تصادفی، کنترل شده با دارونما. 2008، 23:87 94.
264 Levine J، Cholestoy A، Zimmerman J: اثر ضد افسردگی ممکن است
مینوسیکلین 1996، 153: 582.
265 Levkovitz Y، Mendlovich S، Riwkes S، Braw Y، Levkovitch-Verbin H، Gal G،
Fennig S، Treves I، Kron S: مطالعه دوسوکور، تصادفی از
Minocycline برای درمان علائم منفی و شناختی در
اسکیزوپرنی فاز اولیه J Clin Psychiatry 2010، 71:138-149.
266 Miyaoka T، Yasukawa R، Yasuda H، Hayashida M، Inagaki T، Horiguchi J:
ممکن است اثر آنتی سایکوتیک منوسیکلین در بیماران با
جنون جوانی. Prog Neuropsychopharmacol Biol Psychiatry 2007، 31:304-307.
267 Miyaoka J، Yasukawa R، Yasuda H، Hayashida M، Inagaki T، Horiguchi J:
Minocycline به عنوان درمان کمکی برای اسکیزوفرنی: یک داروی باز
مطالعه. 2008، 31:287 292.
268 Rodriguez CI، Bender J Jr، Marcus SM، Snape M، Ryn M، Simpson HB:
تقویت مینوسیکلین در زمینه داروسازی در وسواس فکری
اختلال: یک کارآزمایی با برچسب باز. 2010، 71:1247-1249.
doi:10.1186/1742-2094-10-43
این مقاله را به عنوان: نجار و همکاران، عنوان کرد: عصب خونی و روانپزشکی
بیماری. مجله اپی نفرین 2013 10: 43.
بستن آکاردئون
اطلاعات اینجا در "عصب خونی و بیماری روانی"در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من