همه ما به عنوان کودکان یاد گرفتیم که حواس های 5 وجود دارد: دید، طعم، صدا، بوی و لمس. چهار حس اول از ارگان های واضح و متمایز مانند چشم ها، جوانه های طعم، گوش ها و بینی استفاده می کنند، اما دقیقا چطور حس بدن را لمس می کنید؟ لمس روی تمام بدن، در داخل و خارج از بدن تجربه می شود. یک ارگان مجزا وجود ندارد که مسئول حس لمس است. در عوض، گیرنده های کوچک، یا انتهای عصبی، در سراسر بدن وجود دارد که حس لمس آن را می گیرد و سیگنال های مغز را با اطلاعات مربوط به نوع لمسی که رخ داده است، می فرستد. به عنوان جوانه طعم دهنده در زبان عطر و طعم تشخیص، mechanoreceptors غده در داخل پوست و سایر اندام ها است که احساس لمس را تشخیص. آنها به عنوان شناخته می شوند مکانیسم پذیرش زیرا آنها طراحی شده اند تا احساسات مکانیکی یا تفاوت های فشار را تشخیص دهند.
فهرست
نقش مکانیسم گیرنده ها
فرد متوجه می شود که وقتی احساس مسئولیت برای کشف این حس خاص پیامی را به مغز ارسال می کند احساس حس می کنند که یک عضو اصلی است که تمام اطلاعات را پردازش می کند و مرتب می کند. پیام ها از طریق تمام سیم های مغز به مغز ارسال می شوند. هزاران نورون کوچک وجود دارد که به تمام نقاط بدن انسان متصل هستند و در انتهای بسیاری از این نورون ها مکانیس گیر هستند. برای نشان دادن آنچه اتفاق می افتد هنگامی که یک جسم را لمس می کنید، از مثال استفاده خواهیم کرد.
پیش بینی یک زمین پشه در بازوی شما. فشار این حشره، به طوری که نور، مکانیس گیرنده ها را در آن منطقه خاص بازوی تحریک می کند. این مکانیس گیرها پیامی را در امتداد نورون که به آن وصل شده اند ارسال می کنند. نورون تمام راه را به مغز متصل می کند، که پیامی را دریافت می کند که چیزی در بدن شما در محل دقیق مکانیسم گیرنده خاصی که پیام را ارسال می کند، لمس می شود. مغز با این توصیه عمل می کند. شاید به چشمان خود نگاه کند تا ناحیه بازوی که امضای را تشخیص دهد نگاه کند. و هنگامی که چشم ها به مغز می گویند که یک پشه بر روی بازوی وجود دارد، مغز ممکن است دست به سرعت آن را بچرخاند. این کار چگونه کار می کند. هدف مقاله زیر نشان دادن و همچنین به طور مفصل در مورد سازماندهی عملکردی و مولکولی مولکولی مکانیسم گیرنده ها بحث می کند.
حس حساس: سازمان عملکردی و مولکولی تعیین کننده گیرنده های مکانیزه حساس
چکیده
Mechanoreceptors های پوستی در لایه های مختلف پوست قرار دارند که در آنها طیف گسترده ای از محرک های مکانیکی را شامل می شود، از جمله برس، کشش، ارتعاش و فشار مضر. این انواع محرک ها با مجموعه ای متنوع از mehran-receptors های تخصصی است که به شیوه ای خاص به تغییر شکل پوستی پاسخ می دهند و این محرک ها را به ساختارهای مغز بالا می برند. مطالعات در سراسر مكانورزپتورها و انتهای عصب حسی ژنتیکی قابل تشخیص هستند كه مكانیزم لمس احساس را پیدا می كنند. کار در این زمینه، محققان را با درک کامل تر از سازمان مدار که بر پایه درک لمس است، ارائه می دهد. کانال های یون های نوین به عنوان کاندیداهای مولکول های انتقال تبدیل شده اند و خواص جریان های مجهز به مکانیکی، درک ما از مکانیزم های سازگاری با محرک های لمسی را بهبود بخشید. این بررسی پیشرفت هایی را در تعیین ویژگی های عملکردی مکانیسم های گیرنده در پوست های مضر و چشمی و کانال های یونی نشان می دهد که ورودی های مکانیکی را شکل می دهند و سازگاری مکانیس گیر را شکل می دهند.
کلید واژه ها: مکانیسم گیرنده، کانال ممانعت کننده، درد، پوست، سیستم سموتوسنسوری، لمس
معرفی
لمس تشخیص محرک مکانیکی بر روی پوست، از جمله محرک های مکانیکی بی ضرر و مضر است. این یک ضرورت حیاتی برای بقا و توسعه پستانداران و انسان است. تماس با اشیاء جامد و مایعات با پوست اطلاعات لازم را به سیستم عصبی مرکزی می دهد که اجازه می دهد اکتشاف و شناسایی محیط زیست و شروع حرکات حرکتی و حرکت برنامه ریزی شود. لمس نیز برای کارآموزی، ارتباطات اجتماعی و جنسیت بسیار مهم است. حس لمس حس کمترین آسیب پذیر است، اگرچه می توان آن را در بسیاری از شرایط پاتولوژیک (هیپرتانسی، هیپوستزی) تحریف کرد. 1-3
پاسخ های لمسی شامل کدگذاری دقیق اطلاعات مکانیکی است. گیرنده های مکانیکی پوستی در لایه های مختلف پوست محلی هستند که طیف وسیعی از محرک های مکانیکی از جمله برس سبک ، کشش ، لرزش ، انحراف مو و فشار مضر را تشخیص می دهند. این محرک های متنوع با آرایه متنوعی از گیرنده های مکانیکی تخصصی مطابقت دارد که به شکل خاصی به تغییر شکل پوستی پاسخ می دهند و این محرک ها را به ساختارهای بالاتر مغز منتقل می کنند. نورون های حسی حسی پوست به دو گروه تقسیم می شوند: گیرنده های مکانیکی آستانه کم (LTMR) که به فشار خوش خیم واکنش نشان می دهند و گیرنده های مکانیکی آستانه بالا (HTMR) که به تحریک مکانیکی مضر پاسخ می دهند. بدن سلولهای LTMR و HTMR در گانگلیونهای ریشه پشتی (DRG) و گانگلیونهای حسی جمجمه (گانگلیون سه قلو) قرار دارند. الیاف عصبی مرتبط با LTMR ها و HTMR ها بر اساس سرعت هدایت عملکرد بالقوه آنها به عنوان الیاف A - - A ، A - یا C طبقه بندی می شوند. الیاف C فاقد میلین هستند و کمترین سرعت رسانایی را دارند (m 2 m / s) ، در حالی که A؟ و الف؟ الیاف به آرامی و به شدت میلین می شوند ، به ترتیب سرعت هدایت متوسط (~ 12 m / s) و سریع (20 ~ m / s) دارند. LTMR ها نیز با توجه به میزان سازگاری آنها با محرک مکانیکی پایدار ، به عنوان پاسخ های آهسته یا سریع سازگار (SA- و RA-LTMR) طبقه بندی می شوند. آنها بیشتر با اندامهای انتهایی پوستی که عصب می دهند و محرکهای ترجیحی آنها متمایز می شوند.
توانایی مکانیسپتورها برای شناسایی نشانه های مکانیکی به حضور کانال های یون مکانیکی تبدیل می شود که به سرعت نیروهای مکانیکی را به سیگنال های الکتریکی تبدیل می کند و زمینه گیرنده را حذف می کند. این تخریب موضعی، به نام پتانسیل گیرنده، می تواند پتانسیل های عملیاتی را که به سیستم عصبی مرکزی نفوذ می کند تولید کند. با این حال، خواص مولکول هایی که مکانیک انتقال و سازگاری با نیروهای مکانیکی را متمایز می کنند هنوز مشخص نیست.
در این بررسی ، ما مروری داریم بر خواص گیرنده مکانیکی پستانداران در لمس بی ضرر و مضر در پوست مودار و براق. ما همچنین دانش اخیر در مورد خصوصیات جریان مکانیکی دروازه را در تلاش برای توضیح مکانیزم سازگاری گیرنده مکانیکی در نظر می گیریم. سرانجام ، ما پیشرفت های اخیر در شناسایی کانال های یونی و پروتئین های مرتبط مسئول تولید جریان های مکانیکی را بررسی می کنیم.
لمس بی امان
فولیکول مو مرتبط با LTMRs
فولیکول های مو نشان دهنده اندام های کوچک تولید کننده شفت مو است که لمس نور را تشخیص می دهند. الیاف مرتبط با فولیکول های مو به حرکت مو و جهت آن با شلیک قطارهای پتانسیل عمل در هنگام شروع و حذف محرک ها پاسخ می دهند. آنها گیرنده ها را به سرعت در حال انطباق می کنند.
گربه و خرگوش در کت گربه و خرگوش ، فولیکول های مو را می توان به سه نوع فولیکول مو ، داون مو ، محافظ مو و تیلوتریش تقسیم کرد. موهای داون (زیر مو ، پشم ، ولوس) 4 پرشمارترین ، کوتاهترین و مرغوب ترین موهای کت هستند. آنها موج دار ، بی رنگ هستند و در گروه های دو تا چهار تار مو از سوراخ مشترک پوست ظاهر می شوند. موهای گارد (مونوتریش ، شنیدن بیش از حد ، موهای زائد) 4 کمی خمیده ، رنگی یا غیر رنگی هستند و به تنهایی از دهان فولیکول های آنها بیرون می آیند. تیلوتریش ها کمترین ، طولانی ترین و ضخیم ترین موها هستند. 5,6،7 آنها رنگدانه یا غیر رنگی هستند ، گاهی اوقات هر دو هستند و به طور جداگانه از یک فولیکول خارج می شوند که توسط حلقه ای از رگ های خونی مویرگی احاطه شده است. فیبرهای حسی تأمین کننده پیاز مو در زیر غده چربی قرار دارند و به A؟ نسبت داده می شوند؟ یا A؟ -LTMR الیاف .XNUMX
در محدوده نزدیک به پایین شانه مو، درست زیر سطح غدد سباسه حلقه انتهایی لانتانولات پلو - Ruffini است. این انتهای حسی عصبی در یک دوره مارپیچ در اطراف شفت مو درون بافت همبند تشکیل می شود که فولیکول مو دارد. در داخل فولیکول مو، همچنین انتهای عصبی آزاد وجود دارد، بعضی از آنها مکانیسم گیرنده را تشکیل می دهند. اغلب، ذره های لمس (نگاه کنید به پوست خشن) اطراف منطقه گردن فولیکول tylotrich اطراف.
خواص انتهای عصب میلین شده در پوست مودار گربه و خرگوش به طور فزاینده ای در دوره 1930-1970 مورد بررسی قرار گرفته است. و خرگوش ، پاسخ های طبقه بندی شده در سه نوع گیرنده مربوط به حرکات موهای داون (گیرنده های نوع D) ، موهای محافظ (گیرنده های نوع G) و موهای تیلوتریش (گیرنده های نوع T) دارند. 1995 همه پاسخ های فیبر عصبی آوران با هم جمع شده اند در گیرنده Adaply Adapting از نوع I (RA I) با مخالفت با گیرنده Pacinian به نام RA II. گیرنده های مکانیکی RA I سرعت محرک مکانیکی را تشخیص می دهند و دارای مرز تیز هستند. آنها تغییرات حرارتی را تشخیص نمی دهند. Burgess و همکاران همچنین یک گیرنده درست به سرعت سازگار را توصیف می کند که به نوازش پوست یا حرکت چندین مو پاسخ بهینه می دهد ، که به تحریک انتهای پیلو-روفینی نسبت داده می شود. هیچ یک از پاسخهای فولیکول مو به فعالیت فیبر C نسبت داده نشد
موش. در پشتی پوست مودار موش، سه نوع عمده از فولیکول های مو شرح داده شده است: کج و معوج (حدود 72٪)، درفش / auchene (حدود 23٪) و گارد یا tylotrich (حدود 5٪) 11-14 زیگزاگ و درفش / فولیکول موهای آچنه موهای شکننده و کوتاهتر مو را تولید می کند و با یک غدد سباسه همراه است. موهای گارد یا تیلوتریچی بلندترین نوع فولیکول مو هستند. آنها با یک لامپ موی بزرگ همراه با دو غده چربی مشخص می شوند. موها محافظ و awl / auchene در یک الگوی تکراری و به طور منظم فاصله قرار می گیرند در حالی که موهای زنجیلی به شدت مناطق پوستی اطراف دو نوع فولیکول موی بزرگ را پر می کنند. 1 (A1، A2 و A3)].
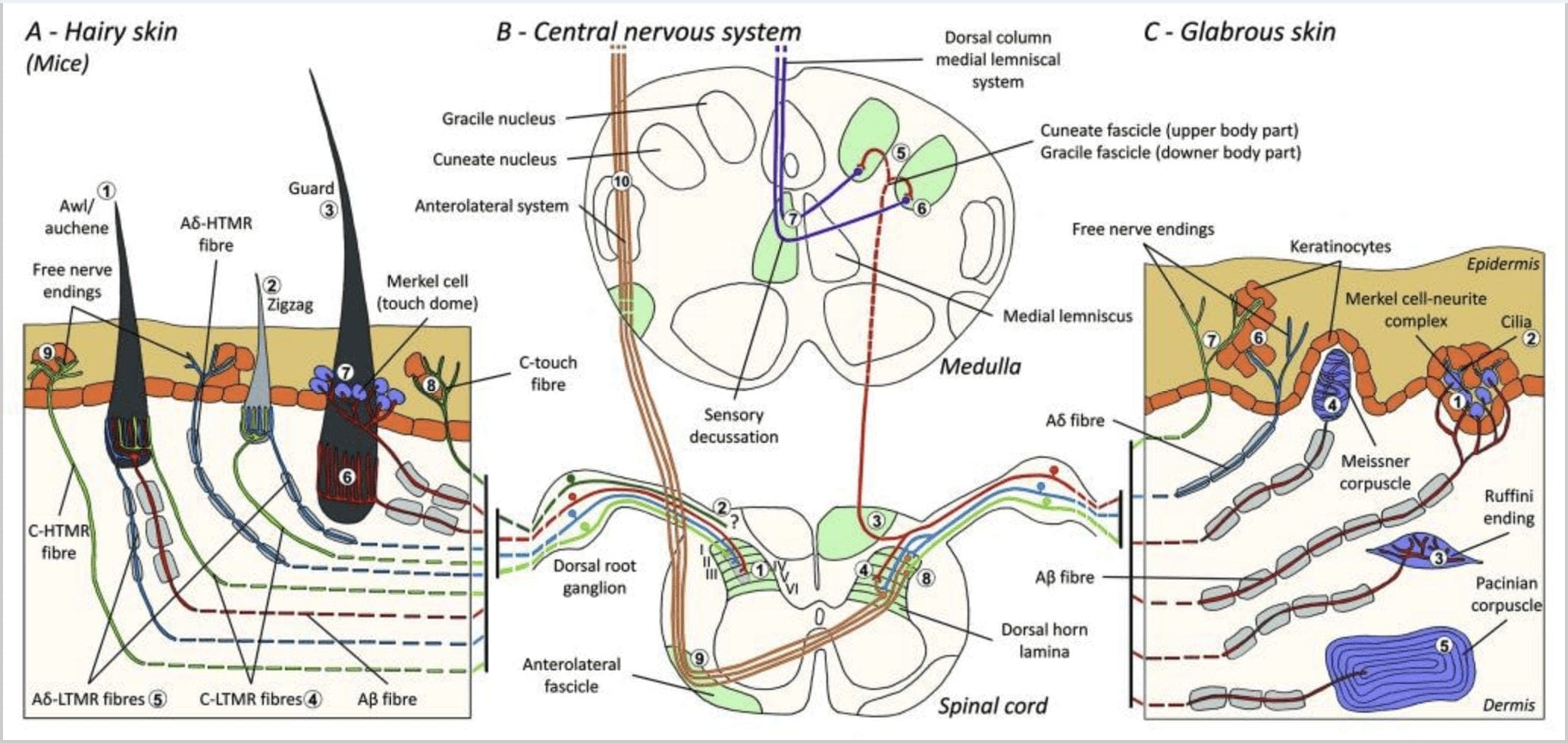
شکل 1. سازماندهی و پیش بینی های مکانیس گیرنده های پوستی. در پوست مودار، برس و لمس نور به طور عمده توسط غشاء اطراف فولیکول های مو تشخیص داده می شود: awl / auchenne (A1)، zigzag (A2) و گارد (A3). موهای شول / اوچن توسط انتهای لانسیلات C-LTMR (A4) ، A؟ -LTMR و A؟ سه بار عصب کشی می شوند به سرعت سازگار-LTMR (A6). فولیکول های مو زیگزاگ شاخه های کوتاه مو هستند و توسط C-LTMR (A4) و A عصب می شوند؟ -LTMR انتهای لانسولات (A5). طولانی ترین فولیکول های محافظ مو توسط A عصب می شوند؟ به سرعت با انتهای لانسیلات طولی-LTMR سازگار می شوند (A6) و با A ارتباط دارند؟ به آهستگی سازگار-LTMR انتهای گنبد لمسی (A7). پیش بینی های مرکزی همه این الیاف در لایه های مجزا ، اما تا حدی همپوشانی شاخ پشتی نخاع خاتمه می یابد (C-LTMR در لایه II ، Aβ -LTMR در لایه III و Aβ -LTMR در لایه IV و V). پیش بینی های LTMR که فولیکول های مو یا موازی مجاور دارند، به شکل یک ستون باریک در شاخ پشتی نخاعی (B1 در خاکستری) تراز می شوند. فقط در پوست مودار، زیرمجموعه ای از الیاف آزاد C به پایان می رسد اپیدرم را مهار می کند و به لمس لذت بخش پاسخ می دهد (A8). این الیاف C-touch به لمس مضر پاسخ نمی دهند و مسیر حرکت آنها هنوز مشخص نیست (B2). با استفاده از چهار نوع LTMR، در پوست چرب، تماس بی ضرر است. مجتمع سلول نوریت مرکل در لایه پایه اپیدرمی (C1) قرار دارد. این گیرنده مکانیکی از یک آرایش بین بسیاری از سلولهای مرکل و یک پایانه عصبی بزرگ شده از یک A تشکیل شده است؟ فیبر سلول های مرکل، مانند فرآیندهای تماس با کراتینوسیت ها (C2)، انگشت خود را نشان می دهند. پایان Ruffini در dermas محلی است. این یک انتهای حسی کپسوله شده باریک شکل سیگار است که به A متصل است فیبر (C3). پیکره مایسنر به A متصل شده است؟ انتهای عصب و در پاپیلهای پوستی واقع شده است. این مکانیسم گیرنده کپسوله شده از سلولهای حمایت کننده بسته بندی شده که به صورت لامال افقی احاطه شده با بافت همبند (C4) تشکیل شده است، تشکیل شده است. Corpuscular Pacinian مکانیسم گیرنده عمیق تر است. یک تک A؟ انتهای عصب فاقد میلین در مرکز این پیکره بزرگ تخم مرغ ساخته شده از لاماهای متحدالمرکز خاتمه می یابد. پیش بینی این الیاف A؟ -LTMR در نخاع به دو شاخه تقسیم می شود. شاخه مرکزی اصلی (B3) در طناب نخاعی در سوناتا یا اسکیزوفرنی (B5) تشکیل می شود که در آن عضلات اولیه اولین سیناپس خود را ایجاد می کنند (B6). نورونهای ثانویه یک قطعه حساسیتی (B7) را ایجاد می کنند تا یک لننوسوس مدیایی ایجاد کنند که از طریق مغز به میانرشت، بویژه در تالاموس، صعود می کند. شعاع ثانویه LTMR در شاخ عقب در لامینا II، IV، V متوقف می شود و با انتقال درد (B4) مواجه می شود. لمس مزاحم توسط پایان عصب آزاد در اپیدرم هر دو مو (A9) و پوست خشن (C7) تشخیص داده می شود. این گیرنده های مکانیکی انتهای A؟ -HTMR و C-HTMR در تماس نزدیک با کراتینوسیت های همسایه (C6) هستند. A؟ -hTMR در لایه I و V ختم می شود. C-HTMR در لایه I و II (B8) خاتمه می یابد. در سطح شاخ پشتی نخاعی، HTMR های اولیه، سیناپس ها را با نورون های ثانویه ایجاد می کنند که از خط میانی عبور می کنند و به ساختار مغز بالاتر در فاکتوریل پیشانی (B9، B10) صعود می کنند.
اخیراً ، جینتی و همکارانش از ترکیبی از برچسب گذاری ژنتیکی مولکولی و رویکرد ردیابی رتروگراد سوماتوتوپی برای تجسم سازماندهی انتهای آکسونی محیطی و مرکزی LTMR ها در موشها استفاده کردند. توسط سه نوع فولیکول مو استخراج شده و از طریق فعالیت های ترکیبات منحصر به فرد فیبرهای A؟ - ، A؟ - و C به شاخ پشت منتقل می شود.
آنها نشان دادند که برچسب گذاری ژنتیکی سلولهای عصبی تیروزین هیدروکسیلاز مثبت (TH +) DRG جمعیتی از سلولهای عصبی حسی غیرپپتیدرژیک و قطر کوچک را مشخص می کند و امکان تجسم انتهای محیطی C-LTMR را در پوست فراهم می کند. با کمال تعجب ، شاخه های آکسونئال C-LTMR های جداگانه پیدا شده و به انتهای طناب های طولی شکل می گیرند که از نزدیک با زیگزاگ (80 end انتهای) و سول / آوشن (20 of انتهای) همراه است ، اما فولیکول های موی تیلوتریش نیست. 1 (A4)]. مدت ها تصور می شد که انتهای لانسولات طولی منحصراً به A؟ -LTMR تعلق دارد و بنابراین غیر منتظره بود که انتهای C-LTMR انتهای لنگول طولی را تشکیل دهند .15 این C-LTMR ها در مقایسه با آهسته و سریع سازگار یک سازگاری متوسط دارند گیرنده های مکانیکی میلین شده [شکل. 2 (C1)].
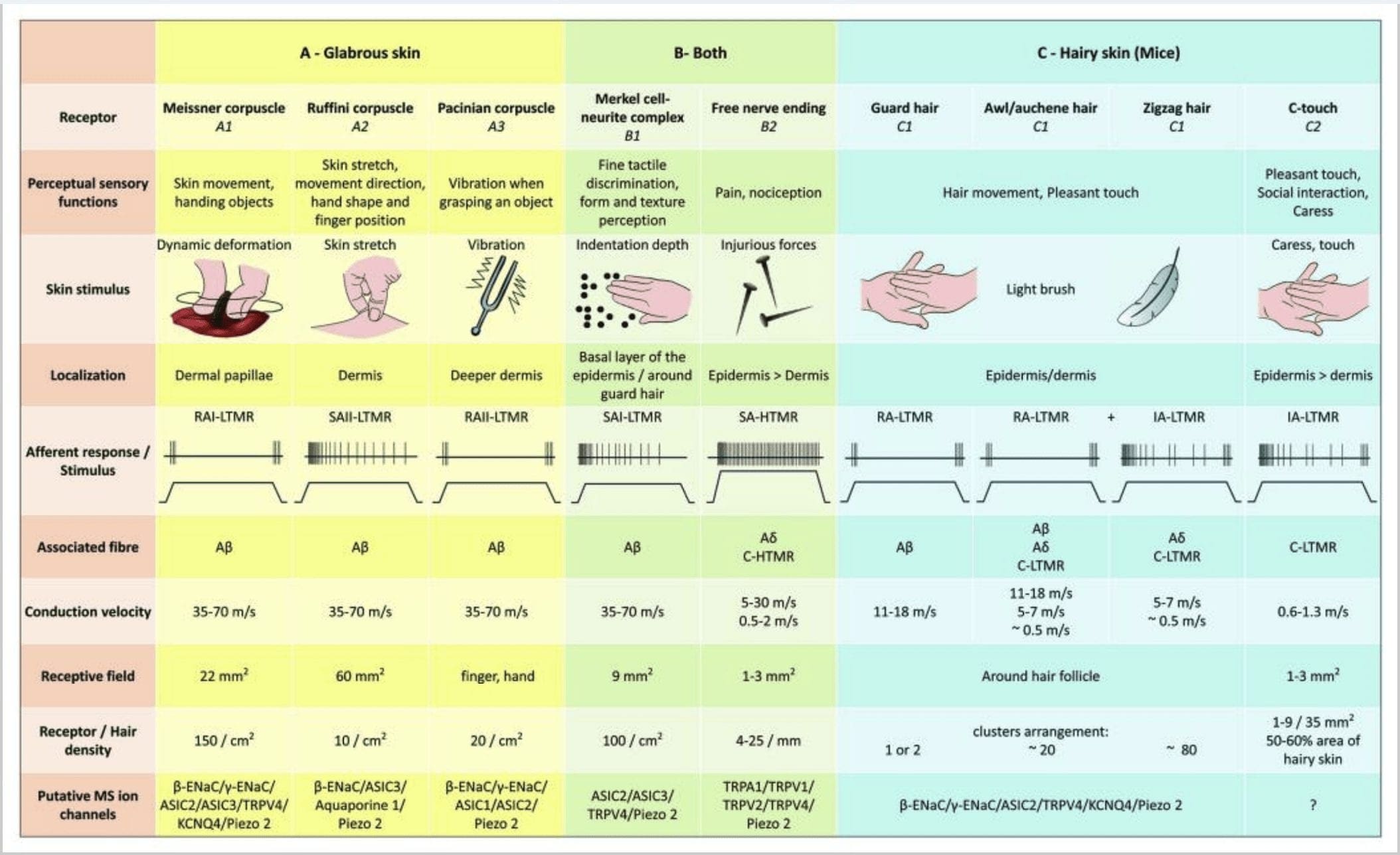
شکل 2. گیرنده های لمسی در پستانداران: گیرنده های لمسی جلدی به لمس بی ضرر پشتیبانی شده توسط گیرنده های متعدد با آستانه مکانیکی کم (LTMRs) در پوست بدون کرک و مودار و لمس مضر توسط گیرنده آستانه مکانیکی بالا (HTMR) متمایز می شوند. آنها انتهای بدون اعصاب را تشکیل می دهند که به طور عمده در اپیدرم ختم می شوند. (الف) پوست بدون کرک. A1: اجسام مایسنر حرکت پوست و لیز خوردن شی object در دست را تشخیص می دهند. آنها برای تحویل شی و مهارت بسیار مهم هستند. گیرنده ها به سرعت با محرک سازگار می شوند ، به A متصل می شوند؟ الیاف و به ندرت به الیاف C تبدیل می شوند و دارای میدان گیرنده زیادی هستند. A2: اجسام روفینی کشش پوست را تشخیص می دهند و برای تشخیص موقعیت انگشت و تحویل اشیا مهم هستند. گیرنده به آرامی با محرک سازگار می شود و تا زمانی که محرک اعمال شود ، فعالیت را حفظ می کند. گیرنده ها به A متصل هستند؟ الیاف و میدان پذیرایی زیادی دارند. A3: پیکرهای پاکیین در درم عمیق تر هستند و ارتعاش را تشخیص می دهند. گیرنده ها به A متصل هستند؟ الیاف آنها به سرعت با محرک سازگار می شوند و بزرگترین میدان پذیرایی را دارند. (B) پوست کامل. B1: کمپلکسهای سلول مرکل هم در پوست بدون کدر و هم در اطراف مو وجود دارد. آنها به صورت متراکم در دست بیان می شوند و برای درک بافت و بهترین تبعیض بین دو نقطه مهم هستند. آنها مسئول دقت انگشت هستند. گیرنده ها به A متصل هستند؟ الیاف آنها به آرامی با محرک سازگار می شوند و زمینه پذیرایی کوتاهی دارند. B2: HTMR های لمسی مضر با سازگاری بسیار کند با محرک ، یعنی تا زمانی که محرک درد اعمال شود ، فعال هستند. آنها با انتهای عصب آزاد A تشکیل می شوند؟ و فیبرهای C مرتبط با کراتینوسیت ها. (ج) پوست مو دار. C1: فولیکول های مو با انواع مختلف مو ارتباط دارند. در موش موهای محافظ بلندتر و کم بیان شده است ، سول / آوشن اندازه متوسط و زیگزاگ کوچکترین و متراکم ترین مو است. آنها به A متصل هستند؟ الیاف بلکه به A؟ و الیاف C-LTMR برای موهای سولفات / آوشن و زیزاگ. آنها حرکت مو از جمله لمس دلپذیر هنگام نوازش را تشخیص می دهند. آنها به سرعت یا با جنبشی متوسط به محرک سازگار می شوند. C2: انتهای عصب C-touch با یک نوع فرعی از انتهای رشته های C با انتهای آزاد مطابقت دارد که با آستانه مکانیکی کم مشخص می شود. آنها قرار است رمزگذاری کنند برای یک احساس خوشایند ناشی از نوازش. آنها به طور متوسط با محرک سازگار می شوند و زمینه پذیرایی کوتاهی دارند. کانالهای یونی مکانیکی حساس قلمداد شده (MS) بیان شده در گیرنده های مختلف لمسی مطابق با داده های اولیه نشان داده شده و فرضیه موجود تحت ارزیابی را خلاصه می کند.
دومین جمعیت اصلی مشخص شده مربوط به انتهای A؟ -LTMR در فولیکول های Awl / Auchenne و zigzag است تا با فولیکول مو داون که به طور گسترده در گربه و خرگوش مورد مطالعه قرار گرفته مقایسه شود. جینتی و همکارانش نشان دادند که TrkB در زیر مجموعه ای از نورون های DRG با قطر متوسط در سطوح بالا بیان می شود. ضبط های داخل سلولی با استفاده از آماده سازی ex-vivo پوست و عصب الیاف دارای برچسب نشان می دهد که آنها ویژگی های فیزیولوژیکی الیاف قبلاً مورد بررسی در گربه و خرگوش را نشان می دهند: حساسیت مکانیکی نفیس (آستانه Von Frey <0.07 mN) ، پاسخ سریع به محرک های فوق آستانه ، هدایت میانی سرعت (5.8/0.9 15 1/5 متر بر ثانیه) و خوشه های سوما غیر انعطاف پذیر باریک است .XNUMX این A؟ -LTMR ها انتهای طولی لانسولات را تشکیل می دهند که تقریباً با هر پیاز موی زیگزاگ و شول / اوچن تنه مرتبط است [شکل. XNUMX (AXNUMX)].
سرانجام ، آنها نشان دادند که پایان های پیرامونی سازگاری سریع A؟ LTMR ها انتهای طولی متصل به طناب را تشکیل می دهند که با محافظ (یا تیلوتریش) و فولیکول های موی سولف / اوشن مرتبط هستند [شکل 1 (A6)] .15 علاوه بر این ، موهای محافظ نیز با یک مجموعه سلول مرکل در ارتباط هستند که یک گنبد لمسی متصل به A را تشکیل می دهد؟ به آرامی با LTMR سازگار می شود [شکل. 1 (A7)].
به طور خلاصه ، تقریباً تمام فولیکول های موی زیگزاگ توسط هر دو انتهای حلقوی C-LTMR و A؟ -LTMR عصب کشی می شوند. موهای اولی / اوچن توسط A عصب سه برابر می شوند؟ به سرعت با پایان دادن به لانسولات LTMR ، A؟ -LTMR و C-LTMR سازگار می شوند. فولیکول های مو محافظ توسط A عصب می شوند؟ به سرعت با پایان های لانسی طولی-LTMR سازگار می شود و با A تعامل دارد؟ به آهستگی سازگار-LTMR از انتهای گنبد لمسی. بنابراین ، هر فولیکول موی موش ترکیبی منحصر به فرد و ثابت از انتهای LTMR مربوط به اندام های انتهایی مکانیوسحسی مغز و اعصاب متمایز دریافت می کند. با توجه به آرایش تکراری این سه نوع مو ، جینتی و همکارانش پیشنهاد می کنند که پوست مو شامل تکرار تکراری واحد محیطی حاوی ، (1) یک یا دو مو محافظ واقع در مرکز ، (2) ~ 20 surrounding موهای شول / اوشن اطراف و (3 ) ~ 80 موی زیگزاگ متقاطع [شکل. 2 (C1)].
رونده طناب نخاعی. پیش بینی های مرکزی A؟ به سرعت سازگار-LTMR ها ، A؟ -LTMR ها و C-LTMR ها در لایه های متمایز ، اما تا حدودی همپوشانی (II ، III ، IV) شاخ پشتی نخاع ختم می شوند. علاوه بر این ، پایانه های مرکزی LTMR که فولیکول های موی یکسان یا مجاور را در یک واحد LTMR محیطی عصب کشی می کنند ، در یک راستا قرار گرفته و یک ستون باریک LTMR در شاخ پشتی نخاع تشکیل می دهند [شکل. 1 (B1)]. بنابراین ، به نظر می رسد که یک گوه ، یا ستونی از انتهای آوران حسی اولیه حرکتی سازمان یافته در شاخ پشتی نشان دهنده ترازبینی پیش بینی های مرکزی A؟ - ، A؟ - و C-LTMR است که همان واحد محیطی را عصب می دهد و مکانیکی را تشخیص می دهد محرک هایی که بر همان گروه کوچک فولیکول های مو تأثیر می گذارند. بر اساس تعداد موهای محافظ ، شول / اوچن و زیگزاگ تنه و اندام ها و تعداد هر زیرگروه LTMR ، جینتی و همکاران تخمین می زنند که شاخ پشتی ماوس شامل 2,000 تا 4,000 ستون LTMR باشد ، که مطابق با تقریبی تعداد محیط های اطراف است. واحدهای LTMR .15
علاوه بر این ، آکسون های زیرگروه LTMR از نزدیک با یکدیگر در ارتباط هستند ، دارای پیش بینی های درهم تنیده و انتهای لانسولات یکپارچه شده که همان فولیکول مو را عصبی می کند. علاوه بر این ، از آنجا که سه نوع فولیکول مو اشکال ، اندازه ها و ترکیبات سلولی مختلفی از خود نشان می دهند ، احتمالاً دارای خواص تنظیم انحراف یا تنظیم ارتعاشی متفاوتی هستند. این یافته ها با اندازه گیری های کلاسیک مغز و اعصاب فیزیکی در گربه و خرگوش مطابقت دارد که نشان می دهد A؟ RA-LTMR ها و A--LTMR ها می توانند با تغییر شکل انواع مختلف فولیکول مو فعال شوند. 16,17،XNUMX
به این ترتیب، در پوست مودار لمس ترکیبی از (1) تعداد نسبی، توزیع فضایی منحصر به فرد و ویژگی های متمایز مورفولوژیک و انحراف از سه نوع فولیکول های مو است؛ (2) ترکیبی منحصر به فرد از انتهای زیرمطمئن LTMR در ارتباط با هر یک از سه نوع فولیکول مو؛ و (3) حساسیت های متمایز، سرعت هدایت، الگوهای قطار سنبله و خواص سازگاری چهار طبقه اصلی از LTMR مرتبط با فولیکول های مو است که سیستم مکانیسنسوری پوست مو را قادر می سازد استخراج و انتقال به ترکیبات پیچیده از ویژگی های که یک دست زدن به.
LTMRs End-of-Free عصبی
به طور کلی ، انتهای آزاد فیبرهای C در پوست HTMR است ، اما یک زیر جمعیت از الیاف C به لمس مضر پاسخ نمی دهد. این زیرمجموع آوران لمسی فیبر C (CT) نشان دهنده نوع متمایزی از واحدهای گیرنده مکانیکی بدون میلین و آستانه کم است که در پوست مودار اما بدون براق انسان و پستانداران وجود دارد [شکل. 1 (A8)]. 18,19،20,21 CT به طور کلی با درک تحریک لمسی دلپذیر در تماس با بدن مرتبط است. XNUMX،XNUMX
آوران CT به نیروهای تورفتگی در محدوده 0.3 2.5 mN پاسخ می دهند و بنابراین به اندازه بسیاری از A به تغییر شکل پوست حساس هستند؟ آوران ها .19 ویژگی های سازگاری آوران CT در مقایسه با گیرنده های مکانیزه میلین به آرامی و به سرعت سازگار است. زمینه های پذیرای آوران CT انسان تقریباً گرد یا بیضی شکل است. این میدان شامل یك تا نه لكه پاسخگو كوچك است كه در یك منطقه تا 35 mm2.22 توزیع شده است. 50 گیرنده های همولوگ موش در الگویی از وصله های ناپیوسته سازمان یافته اند كه حدود 60-2٪ از ناحیه پوست مو را پوشش می دهد 2 (C23)]. XNUMX
شواهد موجود در مورد بیماران مبتلا به کم خونی ناشی از میلینین نشان می دهد که سیگنالینگ در فیبرهای CT موجب تقویت قشر ساحلی می شود. از آنجا که این سیستم را پشتیبانی می کند فقیر در جنبه های افتراقی لمس است، اما به خوبی مناسب برای رمزگذاری آهسته، لمس ملایم است، CT الیاف در پوست مودار ممکن است بخشی از یک سیستم برای پردازش جنبه های لذت بخش و اجتماعی مربوط به فعال سازی فیبر touch.24 CT همچنین ممکن است نقش مهمی در درد ایفا می کند و اخیرا پیش بینی شده است که التهاب یا تروما ممکن است احساسات انتقال LTMR های C-fiber را از لمس دلپذیر به درد تغییر دهد. 25,26
کدام مسیر سفرهای CT-afferents هنوز شناخته نشده است [شکل. 1 (B2)]، اما کم آستانه لمسی ورودی به سلول های طرح ریزی spinothalamic مستند شده است، 27 وام اعتبار به گزارش از ظریف، کسری مقابل از تشخیص لمسی در بیماران انسانی زیر تخریب این مسیر پس از chordotomy procedures.28
LTMRs در پوست گلی
مجتمع سلول نوریت مرکل و گنبد لمسی. مرکل (1875) اولین کسی بود که توصیف بافتی خوشه های سلولهای اپیدرمی را با هسته های بزرگ لوبوله ای ارائه داد و با فیبرهای عصبی آوران فرضی تماس برقرار کرد. وی تصور كرد كه آنها با لمس كردن آنها Tastzellen (سلولهای لمسی) حس لامسه را تسخیر می كنند. در انسان ، مجتمع های سلول نئوریت مرکل در مناطق حساس به لمس پوست غنی می شوند ، آنها در لایه پایه اپیدرم در انگشتان ، لب ها و اندام های تناسلی یافت می شوند. آنها همچنین در پوست مودار با تراکم کمتری وجود دارند. مجتمع سلول نئوریت مرکل از یک سلول مرکل در موقعیت نزدیک به یک ترمینال عصب بزرگ شده از یک A میلین شده واحد تشکیل شده است. فیبر [شکل 1 (C1)] (مروری در Halata و همكاران) .29 در قسمت اپیدرمی سلول مرکل فرایندهای انگشت مانند گسترش یافته بین كراتینوسیت های همسایه را نشان می دهد [شکل. 1 (C2)]. سلولهای مرکل سلولهای اپیدرمی مشتق شده از کراتینوسیت هستند. 30,31،150 اصطلاح گنبد لمسی برای نامگذاری غلظت زیادی از کمپلکسهای سلول مرکل در پوست مودار قسمت جلوی پنجه گربه معرفی شد. یک گنبد لمسی می تواند حداکثر 32 سلول مرکل داشته باشد که توسط یک A-فیبر و در انسان علاوه بر الیاف A؟ -A ، A؟ و الیاف C نیز به طور منظم وجود داشت. 34-XNUMX
تحریک مجتمع های سلول نئوریت مرکل در پاسخ های نوع I (SA I) با آهستگی سازگار می شود ، که از میدان های پذیرای با مرزهای تیز سرچشمه می گیرند. هیچ تخلیه خود به خودی وجود ندارد. این مجموعه ها به عمق فرورفتگی پوست پاسخ می دهند و بیشترین تفکیک مکانی (0.5 میلی متر) گیرنده های مکانیکی پوست را دارند. آنها تصویر مکانی دقیق از محرکهای لمسی را منتقل می کنند و پیشنهاد می شود مسئول تبعیض شکل و بافت باشند [شکل. 2 (B1)]. موش های فاقد سلول های مرکل در حالی که این کار را با استفاده از سبیل های خود انجام می دهند ، نمی توانند سطوح بافت را با پا تشخیص دهند
این که سلول مرکل ، نورون حسی یا هر دو مکان انتقال مکانیکی هستند هنوز محل بحث است. در موشهای صحرایی ، تخریب سمیت سلولی سلولهای مرکل پاسخ SA I را از بین می برد .36 در موشهایی که سلولهای تحت فشار ژنتیکی سرکوب شده ژنتیکی دارند ، پاسخ SA I که در آماده سازی پوست / عصب در داخل بدن ثبت شده است کاملا ناپدید شد ، نشان می دهد که سلولهای مرکل برای کدگذاری مناسب مرکل مورد نیاز هستند پاسخهای گیرنده .37 با این حال ، تحریک مکانیکی سلولهای مرکل جدا شده در فرهنگ توسط فشار موتور حرکتی جریان مکانیکی را ایجاد نمی کند. 38,39،XNUMX کراتینوسیت ها ممکن است نقش مهمی در عملکرد طبیعی مجموعه سلولهای مغز و اعصاب مرکل داشته باشند. فرآیندهای انگشت مانند سلول مرکل می توانند با تغییر شکل پوست و حرکت سلول اپیدرم حرکت کنند و این ممکن است اولین گام انتقال مکانیکی باشد. واضح است که هنوز شرایط لازم برای مطالعه حساسیت مکانیکی سلولهای مرکل مشخص نشده است.
انتهای Ruffini انتهای روفینی انتهای حسی کپسوله ای نازک سیگار برگ هستند که به A متصل هستند؟ انتهای عصبی انتهای روفینی سیلندرهای بافت همبند کوچکی است که در امتداد رشته های کلاژن پوستی قرار گرفته اند و توسط یک تا سه رشته عصبی میلین شده به قطر 4 6 متر تهیه می شوند. ممکن است حداکثر سه استوانه با جهت گیری متفاوت درم ادغام شده و یک گیرنده ایجاد شود [شکل. 1 (C3)]. از نظر ساختار ، انتهای روفینی شبیه اندام تاندون گلژی است. آنها به طور گسترده در درم بیان می شوند و به عنوان گیرنده های مکانیکی پوستی نوع II (SA II) که به آرامی سازگار هستند ، شناسایی شده اند. در برابر فعالیت عصبی خود به خود ، تخلیه منظم آهسته سازگار با نیروی کم عمود و محرک مکانیکی حفظ می شود یا به طور م effectivelyثرتری توسط کشش پوستی ایجاد می شود. پاسخ SA II از زمینه های بزرگ پذیرایی با مرزهای مبهم نشات می گیرد. گیرنده های روفینی به درک جهت حرکت جسم از طریق الگوی کشش پوست کمک می کنند [شکل. 2 (A2)].
در موش، پاسخ های SA I و SA II را می توان از طریق الکتروفیزیولوژیکی در آماده سازی پوست عصبی ex vivo جدا کرد. 40 Nandasena و همکاران ایمونولوکالیزه کردن آکوپورین 1 (AQP1) در انتهای پریودنتال Ruffini موش های موش صحرایی نشان می دهند که AQP1 درگیر حفظ تعادل اسمزی دندانی لازم برای مکانیک انتقال. 41 پایان دوره پریودنتال Ruffini همچنین بیان کانال ion کانون احتمالی ASIC3.42
مرض مايسنر پیکره های مایسنر در پاپیلاهای پوستی بدون پوست ، به طور عمده در کف دست و کف پا بلکه در لب ها ، در زبان ، در صورت ، در نوک سینه ها و در اندام های تناسلی قرار دارند. از نظر آناتومیک ، آنها از یک انتهای عصبی کپسول دار تشکیل شده اند ، کپسول از سلول های حمایت کننده مسطح ساخته شده است که به صورت لاملهای افقی جاسازی شده در بافت همبند ساخته شده اند. تنها یک فیبر عصبی A وجود دارد؟ آوران هایی که به ازای هر پیکره متصل می شوند [شکل. 1 (C4)]. هر تغییر شکل فیزیکی در پیکره بدن باعث ایجاد یک پتانسیل بالقوه عمل می شود که به سرعت متوقف می شود ، یعنی آنها سریعاً گیرنده ها را سازگار می کنند. وقتی محرک برداشته می شود ، پیکره شکل خود را پیدا می کند و در حین انجام این کار ، پتانسیل های بالقوه دیگری از عمل ایجاد می کند. به دلیل قرارگیری سطحی در درم ، این اجساد به طور انتخابی به حرکت پوست ، تشخیص لمسی و لرزش (20-40 هرتز) پاسخ می دهند. آنها به پوست پویا حساس هستند - به عنوان مثال ، بین پوست و جسمی که تحت آن کار می شود [شکل. 2 (A1)].
قرصهای Pacinian. پیکرهای پاکیین گیرنده های مکانیکی عمیق پوست هستند و حساس ترین گیرنده های پوستی کپسوله شده حرکت پوست هستند. این پیکره های بزرگ تخمک (به طول 1 میلی متر) ساخته شده از لاملا متحدالمرکز از بافت پیوندی رشته ای و فیبروبلاست های پوشیده شده توسط سلول های شوان اصلاح شده تخت در درم عمیق بیان می شوند. 43 در مرکز بدن ، در حفره ای پر از مایع به نام لامپ داخلی ، یک تک A خاتمه می یابد؟ انتهای عصب غیر میلین آور آوران [شکل. 1 (C5)]. آنها دارای یک میدان پذیرایی بزرگ در سطح پوست با یک مرکز حساس هستند. توسعه و عملکرد چندین نوع گیرنده مکانیکی سازگار با سرعت در موشهای جهش یافته c-Maf مختل می شود. به طور خاص ، اجساد پاکیین به شدت آتروفی می شوند
پیکرهای پاکیین در پاسخ به فرورفتگی پوست ، ترشحات عصبی II (RA II) که به سرعت سازگار هستند و قادر به پیروی از فرکانس بالای محرک های ارتعاشی هستند ، سازگاری بسیار سریعی نشان می دهند و از طریق ارتعاشات منتقل شده امکان درک وقایع دور را دارند. آوران ها با شروع فعالیت و تحریک محرک به تورفتگی پایدار با فعالیت گذرا پاسخ می دهند. به آنها آشکارسازهای شتاب نیز گفته می شود زیرا می توانند تغییرات قدرت محرک را تشخیص دهند و اگر سرعت تغییر در محرک تغییر کند (همانطور که در ارتعاشات اتفاق می افتد) ، پاسخ آنها متناسب با این تغییر می شود. پیکره های پاکیین تغییرات فشار فاحش و بیشتر از همه ارتعاشات (45-150 هرتز) را احساس می کنند ، که می توانند حتی سانتی متر از آن را تشخیص دهند [شکل. 300 (A2)].
واکنش تونیک در کپسول دیکاپسولین Pacinian دیده می شود. 46 علاوه بر این، Corpuscles Pacinian بدون عارضه در طول تحرک های دائمی ثابت، بدون تغییر آستانه های مکانیکی یا فرکانس پاسخ، زمانی که سیگنالینگ بین GABA بین glamia lamellate و پایان عصب مسدود می شود. بنابراین، اجزای غیر عصبی مصنوعی Pacinian ممکن است نقش دوگانه در فیلتر کردن محرک مکانیکی و همچنین در تعدیل خواص واکنش نورون حسی داشته باشند.
پیش بینی های طناب نخاعی پیش بینی های A؟ -LTMR در نخاع به دو شاخه تقسیم می شود. شاخه مرکزی اصلی در نخاع در ستون های پشتی یک طرفه به سطح گردن رحم صعود می کند [شکل. 1 (B3)]. شاخه های ثانویه در شاخ پشت در لایه های IV ختم می شوند و به عنوان مثال در انتقال درد اختلال ایجاد می کنند. این ممکن است درد را به عنوان بخشی از کنترل گیت کاهش دهد [شکل. 1 (B4)]. 48
در سطوح رحم، آکسون شاخه اصلی در دو بخش جداگانه می باشد: بخش میانی خطاطی از اطلاعات نیمه پایین بدن (پاها و تنه) حاوی اطلاعات فیزیولوژیکی شکلی است و بخش بیرونی حاوی اطلاعات انتقال تراشه از نیمه بالایی از بدن (بازوی و تنه) [شکل. 1 (B5)].
آوران های لمسی اولیه اولین سیناپس خود را با سلولهای عصبی مرتبه دوم در مدولا ایجاد می کنند ، جایی که فیبرهای هر دستگاه در هسته ای به همین نام سیناپس می شوند: آکسونهای gracile fasciculus در هسته گرانشی و آکسونهای مهره سیناپس در هسته میخ سیناپس می شوند [شکل. 1 (B6)]. سلولهای عصبی دریافت کننده سیناپس ، آورانهای ثانویه را فراهم می کنند و بلافاصله از خط میانی عبور می کنند و یک تراکت در طرف مقابل ساقه مغز ایجاد می کنند. لمنیسکوس داخلی که از طریق ساقه مغز به ایستگاه رله بعدی در مغز میانی ، به ویژه در تالاموس صعود می کند. . 1 (B7)].
مشخصات مولکولی LTMRs. مکانیسم های مولکولی کنترل تنوع اولیه LTMR اخیراً تا حدی روشن شده است. Bourane و همکارانش نشان داده اند که جمعیتهای عصبی بیان کننده گیرنده تیروزین کیناز Ret (Ret) و گیرنده مشترک آن GFR؟ 2 در موشهای جنینی E11 13 DRG به طور انتخابی فاکتور رونویسی Mafa را بیان می کنند. 49,50،2 این نویسندگان نشان می دهند که Mafa / سلولهای عصبی Ret / GFR؟ 1 که قرار است در بدو تولد به سه نوع خاص از LTRM تبدیل شوند: سلولهای عصبی SA51 باعث تحریک مجتمع های سلول مرکل می شوند ، سلولهای عصبی که به سرعت سازگار می شوند و اجسام Meissner را خنثی می کنند و آوران هایی که به سرعت سازگار می شوند (RA I) انتهای لانسولات را در اطراف فولیکول های مو تشکیل می دهند. Ginty و همكارانش همچنین گزارش كردند كه نورونهای DRG كه زود Ret را بیان می كنند به سرعت در حال سازگاری گیرنده های مكانیكی از پیكرهای Meissner ، پیكرهای پاكینین و انتهای لانسولات در اطراف فولیكول های مو هستند. XNUMX آنها مناطق هدف گسسته را در هسته های دانه ای و دانه ای عصب بندی می كنند ، و الگوی خاصی از مكان حسی را نشان می دهند پیش بینی های آکسون نورون در ساقه مغز.
کشف مکانیسم گیرنده های پوست انسان. تکنیک "میکرونوروگرافی" توصیف شده توسط هاگبارت و والبو در سال 1968 برای مطالعه رفتار تخلیه انتهای مکانیکی حساس انسان تأمین کننده عضله ، مفصل و پوست استفاده شده است (برای بررسی Macefield ، 2005 مراجعه کنید). 52,53،20 اکثر میکروارونروگرافی پوست انسان مطالعات فیزیولوژی آوران لمسی در پوست براق دست را مشخص کرده است. ضبط های میکروالکترود از اعصاب میانی و اولنار در افراد انسانی ، احساس لمس ایجاد شده توسط چهار گروه LTMR را نشان داده است: آوران مایسنر به ویژه نسبت به سکته های سبک در پوست حساس هستند و به نیروهای برشی محلی و لغزش های اولیه یا واضح در قسمت پذیرایی واکنش نشان می دهند. آورانهای پسیینی به موقتهای مکانیکی سریع حساس هستند. آورندگان با شدت به دمیدن بیش از میدان پذیرش پاسخ می دهند. یک پیکر پاکین واقع در یک رقم معمولاً به ضربه زدن روی میز پشتیبانی کننده بازو پاسخ می دهد. آوران مرکل به طور مشخص دارای حساسیت دینامیکی بالایی به محرک های تورفتگی اعمال شده در یک منطقه گسسته است و اغلب هنگام تخلیه با تخلیه تخلیه پاسخ می دهد. اگرچه آوران های روفینی به نیروهایی که به طور عادی به پوست وارد می شوند پاسخ می دهند ، اما ویژگی منحصر به فرد آوران های SA II توانایی آنها در پاسخ به کشش جانبی پوست است. سرانجام ، واحدهای موی بازو دارای زمینه های بزرگ تخمدانی یا نامنظم هستند که از چندین لکه حساس تشکیل شده اند و با موهای جداگانه مطابقت دارند (هر آورنده XNUMX ~ مو تأمین می کند).
حساسیت مکانیکی کراتینوسیت ها
هر محرک مکانیکی بر روی پوست باید از طریق کراتینوسیت هایی که اپیدرم را تشکیل می دهند، انتقال یابد. این سلول های همه جا ممکن است علاوه بر نقش های حمایتی یا محافظتی آنها را نیز انجام دهد. به عنوان مثال، کراتینوسیتها ATP، یک مولکول سیگنالینگ حسی حساسیتی را در پاسخ به محرک مکانیکی و اسموتیک ترشح می کنند. 54,55 انتشار ATP باعث افزایش میزان کلسیم داخل سلولی توسط تحریک اتوکرین از گیرنده های پورینرژیک می شود. 55 علاوه بر این، شواهدی وجود دارد که هیپوتونیکیت Rho-kinase مسیر سیگنالینگ و شکل گیری فیبرهای تنش بعدی F-actin نشان می دهد که تغییر شکل مکانیکی کراتینوسیت ها می تواند به صورت مکانیکی با سلول های همسایه مانند سلول های مرجک برای لکه های بی خطر و پایان انتهایی آزاد C به لمس زخم نفوذ کند. 1 (C6)] 56,57
لمسی مضر
گیرنده های مکانیکی آستانه بالا (HTMR) C- و A اپیدرمی هستند؟ انتهای عصبی رایگان آنها با ساختارهای خاصی همراه نیستند و در هر دو پوست مو مشاهده می شوند [شکل. 1 (A9)] و پوست بدون براق [شکل. 1 (C7)]. با این حال ، اصطلاح انتهای عصب آزاد باید محتاطانه در نظر گرفته شود زیرا انتهای عصب همیشه با سلولهای کراتینوسیت یا سلول لانگرانس یا ملانوسیت ها در موقعیت نزدیک قرار دارند. تجزیه و تحلیل فراساختاری انتهای عصب وجود شبکه آندوپلاسمی خشن ، میتوکندری فراوان و وزیکول هسته متراکم را نشان می دهد. غشاهای مجاور سلولهای اپیدرم ضخیم شده و شبیه غشای پس سیناپسی در بافتهای عصبی است. توجه داشته باشید که فعل و انفعالات بین انتهای عصب و سلولهای اپیدرمی ممکن است دو طرفه باشد زیرا سلولهای اپیدرمی ممکن است واسطه هایی را به عنوان ATP ، اینترلوکین (IL6 ، IL10) و برادی کینین آزاد کنند و بالعکس انتهای عصب پپتیدرژیک می تواند پپتیدهایی مانند CGRP یا ماده P را که بر سلولهای اپیدمی تأثیر می گذارد آزاد کند. HTMR ها شامل گیرنده های مکانیکی-مکانیکی هستند که فقط توسط محرک های مکانیکی مضر و گیرنده های چند مدلی تحریک می شوند که همچنین به گرمای مضر و مواد شیمیایی برونزا پاسخ می دهند [شکل. 2 (B2)]. 58
الیاف آوران HTMR در سلولهای عصبی فرافکن در شاخ پشتی نخاع خاتمه می یابند. A -HTMR ها غالباً در لایه های I و V با سلول های عصبی مرتبه دوم تماس می گیرند ، در حالیکه C-HTMR در لایه II خاتمه می یابد [شکل. 1 (B8)]. سلولهای عصبی درد مرتبه دوم به طرف متقابل نخاع منتقل می شوند و در ماده سفید صعود می کنند و سیستم قدامی استخوان را تشکیل می دهند. این نورون ها عمدتا در تالاموس ختم می شوند [شکل. 1 (B9 و B10)].
مکانیسم جریان در نورونهای Somatosensory
مکانیزم های سازگاری آهسته یا سریع مکانیسم های گیرنده هنوز مشخص نشده است. مشخص نیست که تا چه اندازه سازگاری مکانیسپتورها توسط محیط سلولی انتهای عصبی حسی، خصوصیات ذاتی کانال های مکانیکی و خواص کانال های یونی ولتاژ متصل به نورون های حساس (شکل 2) ارائه شده است. با این حال، پیشرفت های اخیر در توصیف جریان های مکانیکی نشان داده است که کلاس های مختلف کانال های حساس مکانیکی در نورون های DRG وجود دارد و ممکن است بعضی از جنبه های سازگاری مکانیزه های گیرنده را توضیح دهد.
ضبط در شرایط آزمایشگاهی در جوندگان نشان داده است که سوما نورونهای DRG ذاتاً مکانیکی و حساس است و بیانگر جریان مکانیکی درب کاتیونی است. 59-64 گادولینیوم و روتنیوم قرمز جریانهای مکانیکی را کاملاً مسدود می کنند ، در حالی که کلسیم و منیزیم خارجی در غلظتهای فیزیولوژیکی و همچنین آمیلورید و بنزامیل ، باعث انسداد جزئی می شود. 60,62,63،1،43 FM1-43 به عنوان یک مسدود کننده ماندگار عمل می کند ، و تزریق FM65-XNUMX به پنجه عقب موش باعث کاهش حساسیت به درد در آزمایش Randall Selitto و افزایش آستانه برداشتن پنجه می شود. XNUMX. موهای فون فری
در پاسخ به تحریک مکانیکی پایدار ، جریانهای حساس به مکانی از طریق بسته شدن کاهش می یابند. بر اساس ثابت های زمان پوسیدگی جریان ، چهار نوع جریان حساس مکانیکی متمایز شده است: جریان های سریع تطبیق پذیر ( 3 6 میلی ثانیه) ، جریان های تطبیقی سریع (15 30 میلی ثانیه،) ، جریان های آهسته سازگار (200 ms 300 میلی ثانیه) ) و جریانهای بسیار آهسته سازگار ((1000 میلی ثانیه) .64 همه این جریانات با بروز متغیری در سلولهای عصبی DRG موش صحرایی وجود دارند که باعث پوسته شدن پوست براق لگن می شود. 64
حساسیت مکانیکی جریانهای حساس به مکانیک را می توان با استفاده از یک سری محرکهای مکانیکی افزایشی تعیین کرد ، که امکان تجزیه و تحلیل جریان تحریک نسبتاً دقیق را فراهم می کند. 66 رابطه جریان تحریک به طور معمول سیگموئید است و حداکثر دامنه جریان با توجه به تعداد کانالهایی که به طور همزمان باز هستند .64,67،63,65 جالب توجه است ، گزارش شده است که جریان مکانیکی حساس به سرعت در حال نمایش آستانه مکانیکی کم و نقطه میانی نیمه فعال است در مقایسه با جریان مکانیکی بسیار آهسته سازگار. XNUMX،XNUMX
نورون های حسینی با فنوتیپ های غیر اختصاصی غیرفعال، به ترتیب به سرعت در حال تطبیق جریان های مکانی حساسیت با آستانه مکانیکی پایین تر بیان می کنند. 60,61,63,64,68 در عوض، به آرامی و بسیار آهسته تطبیق جریان های مکانیزه حساس در بعضی سلول های غیر تصادفی غیر قابل تشخیص گزارش می شود. 64,68 این پیشنهاد را پیشنهاد می کند که این جریان ها ممکن است به آستانه های مکانیکی مختلف در LTMRs و HTMR in vivo دیده می شود. اگرچه این آزمایشات درون آزمایشگاهی باید با احتیاط انجام شود، حمایت از وجود سم در نورونهای DRG مکانیزم های کم و آستانه مکانیکی نیز با تحریک مبتنی بر کشش مبتنی بر کشش نورون های حسی حساس موش صحرایی ارائه شده است. 69 این پارادایم دو جمعیت اصلی نورونهای حساس کششی، که به دامنه کم تحرک پاسخ می دهد و یکی دیگر از آنها که به طور انتخابی به دامنه محرک بالا پاسخ می دهد.
این نتایج پیامدهای مهمی در عین حال احتمالی و مکانیستی دارد: آستانه مکانیسمی از نورونهای حساس ممکن است کمی با سازمان سلولی مکانیسم گیرنده ارتباط داشته باشد، اما ممکن است در خواص کانال های یونی مکانیکی نگه داشته شود.
سازوکارهایی که زمینه ساز حساسیت زدایی جریانهای کاتیونی حساس به مکانیسم در سلول های عصبی DRG موش صحرایی است به تازگی باز شده است. 64,67،70 این مکانیسم از دو مکانیسم همزمان حاصل شده که بر خصوصیات کانال تأثیر می گذارد: سازگاری و غیرفعال سازی. سازگاری برای اولین بار در مطالعات سلول شنوایی مو گزارش شد. می توان آن را از نظر عملیاتی به عنوان ترجمه ای ساده از منحنی فعال سازی کانال مبدل در امتداد محور محرک مکانیکی توصیف کرد. 72-64,67 سازگاری به گیرنده های حسی اجازه می دهد تا حساسیت خود را نسبت به محرک های جدید در حضور محرک موجود حفظ کنند. با این حال ، بخش قابل توجهی از جریانهای حساس به مکانیک در سلولهای عصبی DRG نمی تواند پس از تحریک مکانیکی تهویه مجدداً فعال شود ، که نشان دهنده غیرفعال شدن برخی کانالهای مبدل است. این دو مکانیزم برای کلیه جریانهای حساس به مکانیک شناسایی شده در سلولهای عصبی DRG موش مشترک هستند ، حاکی از آن است که عناصر فیزیکوشیمیایی مرتبط ، سینتیک این کانالها را تعیین می کنند.
در نتیجه ، تعیین خصوصیات جریانهای حساس به درون مکانیکی درون محیطی در تلاش برای شناسایی مکانیزم های انتقال در سطح مولکولی بسیار مهم است. تنوع مشاهده شده در آستانه مکانیکی و سینتیک سازگار جریانهای مکانیکی مختلف در سلولهای عصبی DRG نشان می دهد که ویژگیهای ذاتی کانالهای یونی ممکن است حداقل در بخشی ، آستانه مکانیکی و سینتیک سازگاری گیرنده های مکانیکی توصیف شده در دهه های 1960 را توضیح دهد 80 با استفاده از آماده سازی ex vivo.
پروتئین های ممانعت کننده متضاد
در مقابل، نورونهای somatosensory مونوسانس حساس هستند، اما در مورد هویت مولکول هایی که مکانیک انتقال در پستانداران دارند، کم است. صفحه های ژنتیکی در Drosophila و C. elegans مولکول های مکانیکی انتقال دهنده را شناسایی کرده اند، از جمله خانواده های TRP و Degenerin / Epithelial Na + (Deg / ENaC). 73 تلاش های اخیر برای کشف مبنای مولکولی مکانیک انتقال در پستانداران عمدتا بر همولوگ های این نامزدها متمرکز شده است . علاوه بر این، بسیاری از این نامزدها در مکانیسم گیرنده های پوستی و نورون های سومیوزنسوری حضور دارند (شکل 2).
اسیدهای حساس کانال های یونی
ASIC ها به یک زیرگروه پروتون دار از خانواده کانال Na + degenerin epithelial تعلق دارند .74 سه عضو از خانواده ASIC (ASIC1 ، ASIC2 و ASIC3) در گیرنده های مکانیکی و گیرنده های قلب بیان می شوند. نقش کانالهای ASIC در مطالعات رفتاری با استفاده از موشهایی با حذف هدفمند ژنهای کانال ASIC بررسی شده است. حذف ASIC1 عملکرد گیرنده های مکانیکی پوستی را تغییر نمی دهد بلکه باعث افزایش حساسیت مکانیکی جوندگان می شود. روده را تحت تأثیر قرار می دهد. اختلال ASIC75 باعث کاهش حساسیت مکانیکی آوران احشایی و کاهش پاسخ HTMR های پوستی به محرک های مضر می شود. 2
کانال گیرنده گذرا
خانواده پرستاری TRP به شش زیرفرانسه در پستانداران تقسیم شده است. 78 تقریبا تمام زیرپارامترهای TRP دارای اعضای متصل به مکانیزاسیون در انواع سیستم های سلولی هستند. 79 در نورون های حسی پستانداران، کانال های TRP برای شناخت اطلاعات حرارتی و میانجی گری کردن التهاب نوروژنیک، و تنها دو کانال TRP، TRPV4 و TRPA1، در واکنش لمسی دخالت دارند. اختلال در بیان TRPV4 در موش فقط اثرات منفی بر آستانه های مکانیسونورزی حاد دارد، اما به شدت حساسیت به محرک های مکانیکی مضر را کاهش می دهد. 80,81 TRPV4 یک عامل تعیین کننده در شکل دادن پاسخ نورون های غوطه ور به استرس اسمز و هیپرآلژزیای مکانیکی در طی التهاب است. به نظر می رسد 82,83 TRPA1 نقش مهمی در هیپرالژیزای مكانیك دارد. موشهای کمبود TRPA1 دارای حساسیت به درد هستند. TRPA1 به تحرک محرک های مکانیکی، سرد و شیمیایی در نورون های حسی حساس کمک می کند اما به نظر می رسد که برای انتقال سلول های موی ضروری نیست. 84,85
شواهدی روشن نیست که نشان می دهد کانال های TRP و کانال های ASIC که در پستانداران بیان شده اند از نظر مکانیکی از بین رفته اند. هیچ کدام از این کانال ها به طور heterologous ابراز امید الکتریکی جریان های مکانی حساسیت مشاهده شده در محیط محلی خود را خلاصه نمی کنند. این امر امکان پذیر نیست که کانالهای ASIC و TRP مکانیکاتورها هستند، زیرا عدم اطمینان بودن اینکه آیا یک کانال مکانیکی انتقال ممکن است خارج از بستر سلولی آن عمل کند (بخش را در SLP3 مشاهده کنید).
پروتئین های پیزو
پروتئینهای پیزو که اخیرا به عنوان کاندیدای امیدوارکننده برای پروتئین های مکانیسنسسی توسط کست و همکاران شناخته شده اند. ستون فقرات 86,87 دارای دو عضو پیزو، Piezo 1 و Piezo 2، که قبلا به نام FAM38A و FAM38B شناخته می شوند، که به خوبی در سراسر یوکاریوت چند سلولی محافظت می شوند. Piezo 2 در DRG فراوان است، در حالی که Piezo 1 به سختی قابل تشخیص است. 4 بیان پیزو 88 یا پیزو 1 در سیستم های heterologous ایجاد جریان های مکانیزه حساس، سینتیک غیر فعال شدن Current جی پی یو 2 سریع تر است از Piezo 2 جریانهای وابسته به پیزو مشابه جریانهای مکانی حساس درون درونی، دارای پتانسیل برگشت پذیری در اطراف 1 mV هستند و کاتیونی انتخابی نیستند، با Na +، K +، Ca0 + و Mg2 + همه نفوذ کانال زیر را دارند. به همین ترتیب، جریان وابسته به پیزو توسط پتانسیل غشا تنظیم می شود، با کاهش شدید سینتیک فعلی در پتانسیل های دپولاریزه. 2
پروتئین های پیزو بدون شک پروتئین های مکانیسنزینگ هستند و بسیاری از ویژگی های جریان های مکانی حس حساس را در نورون های حسی به اشتراک می گذارند. درمان از سلول های عصبی DRG کشت مسافرتی المنت دار 2 کوتاه تداخل RNA نسبت از سلول های عصبی با سرعت در حال تطبیق فعلی کاهش یافته و کاهش درصد mechanosensitive حوزه neurones.86 گذرنده در سراسر پروتئین مسافرتی المنت دار واقع اما هیچ نقوش منافذ حاوی آشکار و یا امضا کانال یونی شده شناخته شده است. با این حال، پروتئین Pyzo 1 ماوس پاک شده و به دوشاخه های لیپید نامتقارن تبدیل می شود و لیپوزوم ها کانال های یونی حساس به قرمز روتنیم را تشکیل می دهند. 87 یک گام اساسی در اعتبار دادن مکانیزم انتقال از طریق کانال های پیزو، استفاده از روش های in vivo برای تعیین اهمیت کاربردی در سیگنالینگ لمسی است. اطلاعات در Drosophila که در آن حذف یک عضو پیزو صرفه جویی در واکنش مکانیکی به محرک های خطرناک، بدون تاثیری بر لمس طبیعی، داده شد. 89 اگر چه ساختار آنها هنوز تعیین می شود، این خانواده جدید از پروتئین های مکانیزم حساس، یک موضوع امیدوار کننده برای تحقیقات آینده، فراتر از مرز است احساس لمس برای مثال، یک مطالعه اخیر در مورد بیماران مبتلا به کم خونی (xerocytosis ارثی) نقش پیزو 1 را در حفظ هومیوستاز حجم اریتروسیت نشان می دهد. 90
ترانزیستور کانال مانند (TMC)
یک مطالعه اخیر نشان می دهد که دو پروتئین، TMC1 و TMC2، برای سلول های مویی mechanotransduction.91 ارثی ناشنوایی لازم است با توجه به جهش در ژن TMC1 در انسان و mice.92,93 حضور گزارش شد از این کانال هنوز در سیستم حسی نشان داده شده است نشده است، اما به نظر می رسد که منجر به تحقیق شود.
پروتئین 3 (SLP3) مانند پروتئین Stomatin
علاوه بر کانال های انتقال، برخی از پروتئین های جانبی مرتبط با کانال نیز نقش مهمی در حساسیت لمسی دارند. SLP3 در نورونهای DRG پستانداران بیان شده است. مطالعاتی که با استفاده از موش های جهش بدون SLP3 انجام شد تغییر در مکانیزاسیون و جریان های مکانیکی نشان داده شده است. عملکرد دقیق 94,95 SLP3 هنوز معلوم نیست. ممکن است یک لینک دهنده بین کانال مکانی حساس و میکروتوبولهای زیرزمینی باشد، همانطور که برای C elegans homolog MEC2.96 به تازگی GR پیشنهاد شده است. آزمایشگاه لویون پیشنهاد کرده است که یک تست توسط نورونهای حسی حسگر DRG سنتز شده و کانال یون های مكان حساس را به ماتریس خارج سلولی مرتبط می كند. 97 قطع ارتباط این موج را رفع كننده جریان مكان حساس RA نشان می دهد كه برخی از کانال های یونی تنها حساس به مكان حساس هستند. جریان های مکانیک حساس RA همچنین توسط لامینین-332، یک پروتئین ماتریکس تولید شده توسط کراتینوسیت ها، مهار می شوند، تقویت فرضیه مدولاسیون جریان مکانی حساس با پروتئین های خارج سلولی. 98
زیرشاخه K + کانال
به موازات جریانهای مکانی حساس کاتولیک زدایی کاتالیزور، حضور جریانهای K + مکانی حساس بازتابی می شود. کانال های K + در سلول های ممانعت کننده می توانند در تعادل فعلی گام بردارند و در تعیین آستانه مکانیکی و زمان سازگاری مکانیسم های گیرنده کمک می کنند.
اعضای KCNK متعلق به خانواده کانال K + کانال K2P هستند. 99,100 K2P یک دامنه قابل توجهی از تنظیمات سلولی، فیزیکی و دارویی دارد، از جمله تغییرات pH، گرما، کشش و تغییر شکل غشا. این K2P در پتانسیل غشای استراحت فعال هستند. چندین واحد از KCNK در نورونهای somatosensory ابراز می شوند. کانال های 101 KCNK2 (TREK-1)، KCNK4 (TRAAK) و TREK-2 از کانال های چندگانه است که برای آنها گیتار مکانیکی مستقیم توسط کشش غشاء نشان داده شده است. 102,103
موشهایی که دارای ژن مختل شده KCNK2 هستند ، حساسیت بیشتری نسبت به گرما و محرکهای مکانیکی ملایم نشان می دهند اما یک آستانه طبیعی خروج از فشار مکانیکی مضر را که با استفاده از آزمون Randall Selitto به قسمت عقب وارد می شود ، نشان می دهند. 104 موش کمبود KCNK2 همچنین افزایش بیش فعالی حرارتی و مکانیکی در التهاب را نشان می دهد شرایط موش های ناک اوت KCNK4 نسبت به تحریکات مکانیکی ملایم حساس بودند و این حساسیت بیش از حد با غیرفعال سازی اضافی KCNK2.105 افزایش یافت. افزایش حساسیت مکانیکی این موشک های ناک اوت می تواند بدین معنی باشد که کشش به طور هماهنگ جریان های حساس به مکانیزاسیون و قطبش را به صورت هماهنگ فعال می کند ، همانند عدم تعادل جریانهای دردار ولتاژ دپولاریزه و قطبش مجدد.
KCNK18 (TRESK) یکی از عوامل اصلی در هدایت پس زمینه K + است که پتانسیل غشای استراحت سلولهای عصبی حسی حسی را تنظیم می کند .106 اگرچه مشخص نیست که KCNK18 مستقیماً به تحریک مکانیکی حساس است ، اما ممکن است در واسطه پاسخ به لمس نور نقش داشته باشد ، و همچنین محرکهای مکانیکی دردناک. پیشنهاد می شود KCNK18 و به میزان کمتری KCNK3 هدف مولکولی هیدروکسی -؟ - سانشول باشد ، ترکیبی که در دانه های فلفل Schezuan یافت می شود و گیرنده های لمسی را فعال می کند و احساس سوزن سوزن شدن را در انسان ایجاد می کند. 107,108،XNUMX
KCNQ4 KV کانال K + (Kv7.4) برای تعیین اولویت سرعت و فرکانس زیرمجموعه مکانیسپسپتورهای سریع سازگار در هر دو موش و انسان بسیار مهم است. جهش KCNQ4 در ابتدا با یک شکل ناشنوائی ارثی همراه بود. جالب توجه است که یک مطالعه اخیر، KCNQ4 را در انتهای عصب محیطی از فولیکول مو و مویسنر کولورکتال به سرعت در حال تغذیه پوست قرار می دهد. بر این اساس، از دست دادن عملکرد KCNQ4 منجر به افزایش انتخاب حساسیت مكانورزپتور به لرزش با فركانس پایین می شود. به طور مشخص، افرادی که دچار افت شنوایی دیررس ناشی از جهش های غالب ژن KCNQ4 هستند، عملکرد پیشرفته ای را در تشخیص دامنه های کوچک و لرزش کم نشان می دهند. 109

دکتر الکس جیمنز Insight
لمس به عنوان یکی از پیچیده ترین حواس در بدن انسان محسوب می شود، به ویژه به این دلیل که هیچ ارگان خاصی مسئول آن نیست. در عوض، حس لمس از طریق گیرنده های حسی، به نام mechanoreceptors شناخته می شود که در سراسر پوست یافت می شوند و به فشار مکانیکی یا تحریف می رسند. چهار نوع اصلی از مکانیسپسپتورها در پوست بدون پهن و بدون پوست، پستانداران وجود دارد: سلولهای لایه ای، بافت های لایه ای، انتهای عصب مرکل و سلول های لگن. Mechanoreceptors به منظور تشخیص لمس، به منظور نظارت بر موقعیت عضلات، استخوان ها و مفاصل شناخته شده به عنوان proprioception، و حتی برای تشخیص صداها و حرکت بدن عمل می کند. شناخت مکانیزم های ساختار و عملکرد این مکانیس گیرنده ها، یک عنصر اساسی در استفاده از درمان ها و درمان های درمانی است.
نتیجه
لمس یک حس پیچیده است زیرا نشان دهنده کیفیت های لمسی متفاوت است، یعنی ارتعاش، شکل، بافت، لذت و درد، با عملکرد های مختلف تبعیض آمیز. تا به حال، مکاتبات بین یک عضو لمسی و حس روانشناختی همبستگی و نشانگرهای مولکولی خاص کلاس فقط در حال ظهور است. توسعه تست های جوندگان متناسب با تنوع رفتار لمسی در حال حاضر برای تسهیل شناسایی ژنوم در آینده لازم است. استفاده از موش هایی که دارای زیرمجموعه های خاصی از انواع حساسیت های حساس نیستند، شناسایی گیرنده های مکانیکی و فیبرهای حساس حساس را با روش خاص لمس مشخص می کند. جالب توجه است که یک مقاله اخیر، مسئله مهمی از ژنتیک ویژگی های مکانیسنسوری در انسان را باز می کند و نشان می دهد که جهش تک ژنی می تواند حساسیت لمسی را تحت تأثیر قرار دهد. 110 این امر را تأکید می کند که پاتوفیزیولوژی کسری لمسی انسان در بخش بزرگی ناشناخته است و مطمئنا پیشرفت را با شناسایی دقیق زیر مجموعه نورون های حسی مرتبط با یک روش لمس یا کمبود لمسی.
در عوض، پیشرفت در تعریف خواص بیوفیزیکی جریانهای مکانیکی صورت گرفته است. 64 توسعه تکنیک های جدید در سال های اخیر، اجازه نظارت بر تغییرات تنش غشایی، در حالی که ضبط مکانیکی جریان، روش تجربی ارزشمند برای توصیف جریان های مکانیزه حساس با سازگاری سریع، متوسط و آهسته (بررسی شده در Delmas و همکاران) .66,111 آینده خواهد بود که تعیین نقش خواص جاری در مکانیزم های سازگاری مکانیسم گیرنده های متنوع عملکرد و سهم از جریان های K + مکانیک حساس به تحریک پذیری LTMRs و HTMRs.
طبیعت مولکولی جریان های مکانیکی در پستانداران نیز موضوع پژوهشی امیدوار کننده آینده است. تحقیقات آینده در دو دیدگاه پیشرفت می کند، ابتدا تعیین نقش مولکول های جانبی که کانال های آن را به سلول های سیتواسکل منتقل می کند و مورد نیاز برای تخصیص یا تنظیم مکانی حساسیت کانال های یونی مانند خانواده های TRP و ASIC / EnaC است. دوم، برای بررسی منطقه بزرگ و امیدوار کننده از کانال های پیزو با پاسخ دادن به سوالات کلیدی نسبت به مکانیزم نفوذ و جابجایی، زیر مجموعه نورون های حساس و حالت های لمسی مربوط به پیزو و نقش پیزو در سلول های غیر عصبی مرتبط با مکانیزاسیون
حس لامسه ، در مقایسه با حس بینایی ، چشایی ، صدا و بویایی ، که از اندام های خاصی برای پردازش این احساسات استفاده می کنند ، می تواند در سراسر بدن از طریق گیرنده های ریز شناخته شده به عنوان گیرنده های مکانیکی ایجاد شود. انواع مختلف گیرنده های مکانیکی را می توان در لایه های مختلف پوست یافت ، جایی که آنها می توانند طیف گسترده ای از تحریکات مکانیکی را تشخیص دهند. مقاله فوق نکات برجسته خاصی را نشان می دهد که پیشرفت مکانیسم های ساختاری و عملکردی گیرنده های مکانیکی مرتبط با حس لامسه را نشان می دهد. اطلاعات ارجاع شده از مرکز ملی اطلاعات بیوتکنولوژی (NCBI). دامنه اطلاعات ما محدود به عمل جراحی و همچنین آسیب های ستون فقرات و شرایط است. برای بحث در مورد موضوع ، لطفاً از دکتر جیمنز سوال کنید یا با ما تماس بگیرید915-850-0900.
دکتر الکس جیمنز سرپرستی می کند
موارد اضافی: درد پشت
درد پشت یکی از شایع ترین علل ناتوانی و از دست رفته روز در کار در سراسر جهان است. به عنوان حقيقت، درد پشتي به عنوان دومين شايعترين دلايل بازديد پزشکي، نسبت به عفونت فوقاني تنفسي کمتر است. تقریبا 80 درصد از جمعیت حداقل یک بار در طول زندگی خود نوعی کمر درد را تجربه خواهند کرد. ستون فقرات یک ساختار پیچیده ای است که از استخوان ها، مفاصل، لیگامان ها و ماهیچه ها در میان دیگر بافت های نرم تشکیل شده است. به همین دلیل، آسیب و / یا شرایط شدید، مانند دیسک های فتق دیسک، در نهایت می تواند منجر به علائم درد پشت شود. آسیب های ورزشی یا آسیب های ناشی از تصادفات خودرو اغلب اغلب علت درد پشت هستند، اما گاهی اوقات ساده ترین حرکات می توانند نتایج دردناکی داشته باشند. خوشبختانه، گزینه های درمان جایگزین، مانند مراقبت از کیهان پراکسی، می تواند به کاهش درد در استفاده از تنظیمات ستون فقرات و دستکاری دست کمک کند و در نهایت بهبود تسکین درد را کاهش دهد.

موضوع فوق العاده مهم: مدیریت کم پشت درد
موضوعات بیشتر: موارد اضافی اضافی: Painدرمان و درمان های مزمن
جای خالی
منابع
بستن آکاردئون
اطلاعات اینجا در "سازوكار ساختاری و كاركردهای گیرنده های مکانیكی"در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من







