التهاب نوروژنیک یا NI، فرآیند فیزیولوژیکی است که میانجی ها به طور مستقیم از اعصاب جلدی تخلیه می شوند تا پاسخ التهابی را آغاز کنند. این امر منجر به ایجاد واکنش های التهابی موضعی شامل اریتم، تورم، افزایش دما، حساسیت و درد می شود. فیبرهای سمی فاقد مینرالیزه، که به شدت کم تحرک مکانیکی و شیمیایی پاسخ می دهند، عمدتا مسئول انتشار این واسطه های التهابی هستند.
هنگام تحریک، این مسیر عصبی در اعصاب جلدی، نوروپپتید های انرژی دهنده یا پپتید مرتبط با ژن P و کلسایتونین (CGRP) را به محیط میکروتیک آزاد می کند و موجب ایجاد یک سری پاسخ های التهابی می شود. تمایز قابل توجهی در التهاب ایمنی زا وجود دارد که اولین پاسخ محافظتی و ترمیم کننده ای است که توسط سیستم ایمنی ایجاد می شود زمانی که یک پاتوژن وارد بدن می شود، در حالی که التهاب نوروژنیک مستلزم برقراری ارتباط مستقیم بین سیستم عصبی و پاسخ التهابی است. اگرچه التهاب نوروژنیک و التهاب ایمنولوژیک هم می تواند وجود داشته باشد، اما این دو از نظر بالینی قابل تشخیص نیستند. هدف مقاله زیر این است که در مورد مکانیزم التهاب نوروژنیک و نقش عصبی محیطی در دفاع میزبان و ایمنوپاتولوژی بحث شود.
فهرست
التهاب نوروژنیک - نقش سیستم عصبی محیطی در دفاع میزبان و آسیب شناسی ایمنی
چکیده
سیستم عصبی و سیستم ایمنی محیطی به طور سنتی به عنوان توابع جداگانه خدمت می شود. با این وجود، این خط، با برداشت جدید از التهاب نوروژنیک، به طور فزاینده ای تار می شود. عصب های ناسسیپتور دارای بسیاری از مسیرهای تشخیص مولکولی برای خطر به عنوان سلول های ایمنی بدن و در برابر خطرات هستند، سیستم عصبی محیطی به طور مستقیم با سیستم ایمنی بدن ارتباط برقرار می کند و یک مکانیزم حفاظتی یکپارچه را تشکیل می دهد. شبکه غلظت متراکم از الیاف حسی و اتانکی در بافت های محیطی و سرعت بالا انتقال از عصبی اجازه می دهد تا مدولاسیون سیستم ایمنی سیستم ایمنی و ایمن سازی را تعدیل می کند. نورون های محیطی نیز نقش مهمی در اختلال ایمنی در بیماری های خودایمنی و آلرژیک بازی می کنند. بنابراین، درک متقابل هماهنگی نورون های محیطی با سلول های ایمنی ممکن است رویکردهای درمانی را برای افزایش دفاع میزبان و سرکوب ایمنی شناختی پیشگیری کند.
معرفی
دو هزار سال پیش، سلسوس التهاب را شامل چهار علامت اصلی یعنی Dolor (درد)، Calor (گرما)، Rubor (قرمزی) و تومور (تورم) تعریف کرد، مشاهداتی که نشان میدهد فعال شدن سیستم عصبی به عنوان یک عنصر جدایی ناپذیر شناخته شده است. التهاب با این حال، از آن زمان به بعد، درد عمدتاً به عنوان یک علامت و نه یک شرکت کننده در تولید التهاب در نظر گرفته شده است. در این دیدگاه، ما نشان میدهیم که سیستم عصبی محیطی نقش مستقیم و فعالی در تعدیل ایمنی ذاتی و انطباقی ایفا میکند، به طوری که سیستم ایمنی و عصبی ممکن است یک عملکرد محافظتی یکپارچه مشترک در دفاع میزبان و پاسخ به آسیب بافتی داشته باشند. تداخلی که می تواند منجر به آسیب شناسی در بیماری های آلرژیک و خودایمنی شود.
بقای موجودات به شدت به ظرفیت دفاع در برابر آسیب احتمالی آسیب بافتی و عفونت بستگی دارد. دفاع میزبان شامل رفتار اجتنابی برای حذف تماس با محیط خطرناک (مضر) (عمل عصبی) و خنثی سازی فعال پاتوژن ها (عملکرد ایمنی) است. به طور سنتی، نقش سیستم ایمنی در مبارزه با عوامل عفونی و ترمیم آسیب بافت کاملاً متمایز از سیستم عصبی در نظر گرفته شده است، که سیگنالهای محیطی و داخلی آسیبرسان را به فعالیت الکتریکی برای تولید احساسات و رفلکسها تبدیل میکند (شکل 1). ما پیشنهاد می کنیم که این دو سیستم در واقع اجزای یک مکانیسم دفاعی یکپارچه هستند. سیستم عصبی حسی جسمی در موقعیت ایده آلی برای تشخیص خطر قرار دارد. اولاً، تمام بافت هایی که به شدت در معرض محیط خارجی قرار دارند، مانند سطوح اپیتلیال پوست، ریه ها، دستگاه ادراری و دستگاه گوارش، به طور متراکمی توسط گیرنده های درد، الیاف حسی تولید کننده درد با آستانه بالا، عصب دهی می شوند. ثانیاً، انتقال محرک های خارجی مضر تقریباً آنی است، مرتبه ای بزرگتر از بسیج سیستم ایمنی ذاتی، و بنابراین ممکن است «اولین پاسخ دهنده» در دفاع میزبان باشد.
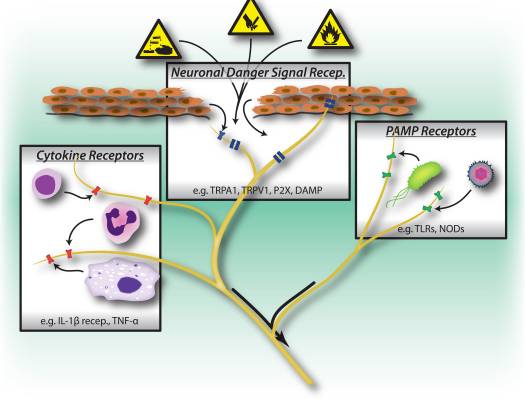
شکل 1: محرکهای بدخیم، مسیرهای تشخیص میکروبی و التهابی موجب فعال شدن سیستم عصبی محیطی می شوند. نورون های حساس دارای چندین وسیله تشخیص حضور محرک های مضر / مضر هستند. گیرنده های سیگنال خطر، از جمله کانال های TRP، کانال های P1X و الگوی مولکولی مرتبط با خطر (DAMP)، سیگنال های خارجی از محیط را تشخیص می دهند (مانند گرما، اسیدیته، مواد شیمیایی) و یا سیگنال های خطرناکی که در اثر آسیب های آسیب دیده / آسیب دیده منتشر می شوند (مانند ATP، اسید اوریک، hydroxynonenals). 2) گیرنده های تشخیص الگو (PRR ها) مانند گیرنده های Toll-like (TLRs) و گیرنده های Nod-like (NLR ها) الگوهای مولکولی مرتبط با پاتوژن (PAMPs) را از طریق حمله باکتری ها یا ویروس ها در طی عفونت ریخته می شوند. 2) گیرنده های سیتوکین فاکتورهای ترشح شده توسط سلول های ایمنی (به عنوان مثال IL-3beta، TNF-alpha، NGF) را شناسایی می کنند که کینازها و دیگر مکانیزم های سیگنالینگ را برای افزایش تحریک پذیری غشا فعال می کند.
علاوه بر ورودیهای ارتودرومیک به طناب نخاعی و مغز از پیرامون، پتانسیلهای عمل در نورونهای گیرنده درد نیز میتواند به صورت آنتیدرومیک در نقاط انشعاب به سمت پایین به محیط، یعنی رفلکس آکسون، منتقل شود. اینها همراه با دپلاریزاسیون موضعی پایدار منجر به آزادسازی سریع و موضعی واسطههای عصبی از هر دو آکسون و پایانههای محیطی میشوند (شکل 2). باعث ایجاد اتساع عروق پوست می شود، که منجر به مفهوم "التهاب عصبی" مستقل از التهاب ایجاد شده توسط سیستم ایمنی می شود (شکل 1).
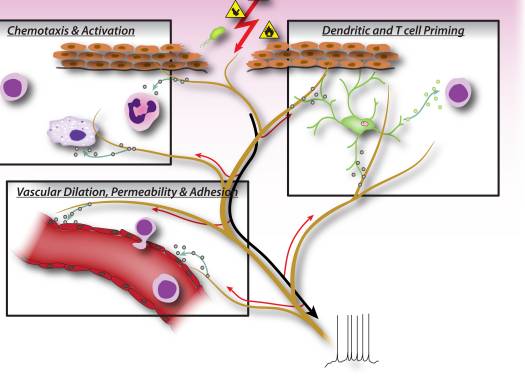
شکل 2: فاکتورهای عصبی که از عصبهای حسی حساس به عصب خارج می شوند، به طور مستقیم سیگوتاکسیس leukocyte، همودینامیک عروقی و پاسخ ایمنی را به وجود می آورند. هنگامی که محرک های خطرناک سیگنال های نفوذی را در اعصار های حسی فعال می کنند، رفلکس های آکسون ضد دیمی تولید می شوند که موجب آزاد سازی نوروپپتید ها در پایانه های محیطی نورون ها می شود. این واسطه های مولکولی دارای چندین اقدام التهابی هستند: 1) Chetotaxis و فعال سازی نوتروفیل ها، ماکروفاژها و لنفوسیت ها به محل آسیب و تخریب سلول های ماست. 2) سیگنالینگ سلولهای اندوتلیال عروقی برای افزایش جریان خون، نشت عروقی و ادم. این همچنین اجازه می دهد تا استخراج آسان تر از لکوسیت های التهابی. 3) پر کردن سلول های دندریتیک برای ردیابی تمایل سلول های T بعد از T به Th2 یا SubType های Th17.

شکل 3: جدول زمانی پیشرفت در درک جنبه های نورولوژیکی التهاب از سلسس تا امروز.
التهاب نوروژنیک با آزادسازی نوروپپتیدهای مرتبط با ژن کلسی تونین پپتید (CGRP) و ماده P (SP) از گیرندههای درد انجام میشود که مستقیماً روی سلولهای اندوتلیال عروقی و عضلات صاف اثر میکنند. CGRP اثرات اتساع عروقی 2، 5 ایجاد می کند، در حالی که SP نفوذپذیری مویرگی را افزایش می دهد که منجر به خارج شدن پلاسما و ادم 2، 3 می شود، که در ایجاد قرمزی، کالری و تومور سلسوس نقش دارد. با این حال، گیرنده های درد بسیاری از نوروپپتیدهای اضافی را آزاد می کنند (پایگاه داده آنلاین: www.neuropeptides.nl/از جمله آدرنومدولین، نوروکینین های A و B، پپتید وازواکتیو روده (VIP)، نوروپپتید (NPY) و پپتید آزاد کننده گاسترین (GRP)، و همچنین سایر واسطه های مولکولی مانند گلوتامات، اکسید نیتریک (NO) و سیتوکین ها مانند ائوتاکسین. 6.
ما اکنون درک میکنیم که واسطههای آزاد شده از نورونهای حسی در محیط نه تنها بر روی عروق اثر میگذارند، بلکه مستقیماً سلولهای ایمنی ذاتی (مست سلها، سلولهای دندریتیک) و سلولهای ایمنی سازگار (لنفوسیتهای T) را جذب و فعال میکنند. در شرایط حاد آسیب بافت، ما حدس می زنیم که التهاب نوروژنیک محافظ است و با فعال کردن و به کارگیری سلول های ایمنی، بهبود فیزیولوژیکی زخم و دفاع ایمنی در برابر عوامل بیماری زا را تسهیل می کند. با این حال، چنین ارتباطات عصبی-ایمنی نیز احتمالاً نقش مهمی در پاتوفیزیولوژی بیماری های آلرژیک و خود ایمنی با تقویت پاسخ های ایمنی پاتولوژیک یا ناسازگار ایفا می کند. به عنوان مثال، در مدل های حیوانی آرتریت روماتوئید، لوین و همکارانش نشان داده اند که عصب کشی مفصل منجر به تضعیف چشمگیر التهاب می شود، که به بیان عصبی ماده P 7، 12 وابسته است. در مطالعات اخیر در مورد التهاب آلرژیک راه هوایی، کولیت و پسوریازیس، نورونهای حسی اولیه نقش اصلی را در شروع و تقویت فعالسازی ایمنی ذاتی و تطبیقی ایفا میکنند.
بنابراین ما پیشنهاد می کنیم که سیستم عصبی محیطی نه تنها نقش منفعل در دفاع میزبان (تشخیص محرک های خطرناک و شروع رفتار اجتنابی)، بلکه همچنین نقش فعال در هماهنگی با سیستم ایمنی در مدولاسیون پاسخ ها و مبارزه با مضر محرک ها، یک نقش است که می تواند به نفع بیماری کمک کند.
سیستم های ایمنی ناحیه عصبی محیطی محیطی را تشخیص می دهد
نورونهای حسی محیطی با توجه به حساسیت آنها به محرک های شیمیایی شدید مکانیکی، حرارتی و تحریک کننده (شکل 1) سازگار هستند. کانال های یون پتانسیل گیرنده گذرا (TRP) کانال های واسطه ای مولکولی هستند که به طور گسترده مورد مطالعه قرار می گیرند و ورود غیرمعمولی از کاتیون ها را از طریق فعالیت های مختلف محرک های خطرناک انجام می دهند. TRPV1 توسط دماهای بالا، pH پایین و کپسایسین، مولکول های تحریک کننده والیوئید چینی فلفل 18 فعال می شود. TRPA1 از شناسایی مواد شیمیایی واکنشی مانند زیست محیطی مانند گاز اشک آور و ایزوتوسیانات صنعتی 19 می باشد، اما مهمتر از همه این که در اثر آسیب بافت توسط سیگنال های مولکولی درون زا شامل 4-hydroxynonenal و prostaglandins 20، 21 نیز فعال می شود.
جالب توجه است که نورونهای حساس بسیاری از مسیرهای گیرنده شناسایی مولکولی پاتوژن و خطر را به عنوان سلول های ایمنی بدن ذاتی به اشتراک می گذارند که آنها را قادر می سازد تا پاتوژن ها را شناسایی کنند (شکل 1). در سیستم ایمنی بدن، پاتوژن های میکروبی توسط گیرنده های شناسایی الگوی کدگذاری شده با germline (PRRs) تشخیص داده می شوند، که الگوهای مولکولی مرتبط با پاتوژن های درونی را حفظ می کنند (PAMPs). اولین PRR هایی که شناسایی می شدند، اعضای خانواده ی گیرنده های تلفنی (TLR) بودند که به مخمر، مولکول های دیواره سلولی باکتریایی و RNA 22 ویروسی متصل می شدند. پس از فعال شدن PRR، مسیرهای سیگنالینگ پایین دست روی آن ایجاد می شود که باعث تولید سیتوکین و فعال سازی ایمنی سازگار می شود. علاوه بر TLR ها، سلول های ایمنی ذاتی نیز در اثر آسیب های بافت توسط سیگنال های خطر مشتق شده از درون بدن، همچنین به عنوان الگوهای مولکولی وابسته به آسیب (DAMPs) و یا alarmins 23، 24 شناخته می شوند. این سیگنال های خطر شامل HMGB1، اسید اوریک و پروتئین های شوک گرمائی که توسط سلول های در حال مرگ در طی نكروز منتشر می شود، فعال سازی سلول های ایمنی در پاسخ های التهابی غیر عفونی است.
PRRها شامل TLRs 3، 4، 7 و 9 توسط نورونهای گیرنده درد بیان میشوند و تحریک توسط لیگاندهای TLR منجر به القای جریانهای داخلی و حساس شدن گیرندههای درد به سایر محرکهای درد میشود. علاوه بر این، فعالسازی نورونهای حسی توسط لیگاند TLR25 به فعالسازی یک مسیر حسی خاص خارش 27 منجر میشود. این نتایج نشان میدهد که درد و خارش مرتبط با عفونت ممکن است تا حدی به دلیل فعالسازی مستقیم نورونها توسط عوامل مشتق از پاتوژن باشد، که به نوبه خود باعث میشود سلول های ایمنی را از طریق انتشار محیطی مولکول های سیگنال دهنده عصبی فعال می کند.
یک DAMP/آلارمین اصلی که در طول آسیب سلولی آزاد می شود ATP است که توسط گیرنده های پورینرژیک هم روی نورون های گیرنده درد و هم سلول های ایمنی 28-30 شناسایی می شود. گیرنده های پورینرژیک از دو خانواده تشکیل شده اند: گیرنده های P2X، کانال های کاتیونی با لیگاند و گیرنده های P2Y، گیرنده های جفت شده با پروتئین G. در نورونهای گیرنده درد، شناسایی ATP از طریق P2X3 انجام میشود، که منجر به جریانهای کاتیونی به سرعت متراکمشونده و درد 28، 30 میشود (شکل 1)، در حالی که گیرندههای P2Y با حساسسازی TRP و کانالهای سدیم دارای ولتاژ در فعالسازی گیرنده درد نقش دارند. در ماکروفاژها، اتصال ATP به گیرندههای P2X7 منجر به هایپرپلاریزاسیون، و فعال شدن پاییندست التهابی میشود، یک مجموعه مولکولی مهم در تولید IL-1beta و IL-18 29. بنابراین، ATP یک سیگنال خطر قوی است که هم نورونهای محیطی و هم نورونهای ذاتی را فعال میکند. ایمنی در هنگام آسیب، و برخی شواهد حتی نشان می دهد که نورون ها بخش هایی از دستگاه مولکولی التهابی را بیان می کنند.
طرف تلنگر سیگنال های خطر در نقص عضو، نقش کانال های TRP در فعال سازی سلول های ایمنی است. TRPV2، یک همولوگ TRPV1 فعال شده توسط گرمای مضر، در سطوح بالای سلول های ایمنی بدن ذاتی 32 بیان می شود. تخریب ژنتیکی TRPV2 منجر به نقص در فاگوسیتوز ماکروفاژ و پاکسازی عفونت های باکتریایی 32 می شود. سلول های مادری نیز کانال های TRPV را بیان می کنند که ممکن است مستقیما به 33 تبدیل شوند. هنوز مشخص نشده است که آیا سیگنال های خطر درونزای سلول های ایمنی را به شیوه ای مشابه با نقص ایمنی فعال می کنند.
یک وسیله کلیدی ارتباط بین سلول های ایمنی و نورون های گیرنده درد از طریق سیتوکین ها است. با فعال شدن گیرنده های سیتوکین، مسیرهای انتقال سیگنال در نورون های حسی فعال می شوند که منجر به فسفوریلاسیون پایین دست پروتئین های غشایی از جمله TRP و کانال های ولتاژدار می شود (شکل 1). حساس شدن گیرنده های درد به این معنی است که محرک های مکانیکی و حرارتی معمولی می توانند گیرنده های درد را فعال کنند. اینترلوکین 1 بتا و TNF-آلفا دو سیتوکین مهم هستند که توسط سلول های ایمنی ذاتی در طی التهاب آزاد می شوند. IL-1بتا و TNF-آلفا مستقیماً توسط گیرندههای درد که گیرندههای همزاد را بیان میکنند، حس میشوند و باعث فعالسازی کینازهای نقشه p38 میشوند که منجر به افزایش تحریکپذیری غشاء 34-36 میشود. فاکتور رشد عصبی (NGF) و پروستاگلاندین E2 نیز واسطههای التهابی اصلی هستند که از سلولهای ایمنی آزاد میشوند و مستقیماً روی نورونهای حسی محیطی عمل میکنند و باعث ایجاد حساسیت میشوند. یک اثر مهم حساس شدن گیرنده درد توسط عوامل ایمنی، افزایش آزاد شدن نوروپپتیدها در پایانه های محیطی است که سلول های ایمنی را بیشتر فعال می کند، در نتیجه یک حلقه بازخورد مثبت ایجاد می کند که التهاب را تحریک و تسهیل می کند.
کنترل سیستم عصبی حسی از ایمنی درونی و سازگار
در مراحل اولیه التهاب، نورونهای حسی به ماست سلهای ساکن بافت و سلولهای دندریتیک، که سلولهای ایمنی ذاتی در شروع پاسخ ایمنی مهم هستند، سیگنال میدهند (شکل 2). مطالعات تشریحی ارتباط مستقیم پایانهها با ماست سلها و همچنین با سلولهای دندریتیک را نشان دادهاند، و نوروپپتیدهای آزاد شده از گیرندههای درد میتوانند باعث ایجاد دگرانولاسیون یا تولید سیتوکین در این سلولها شوند. 7، 9، 37. التهاب و درماتیت 10-12.
در طول مرحله موثر التهاب، سلول های ایمنی باید راه خود را به محل آسیب دیدگی پیدا کنند. بسیاری از واسطههای آزاد شده از نورونهای حسی، نوروپپتیدها، کموکاینها و گلوتامات، برای نوتروفیلها، ائوزینوفیلها، ماکروفاژها و سلولهای T کموتاکتیک هستند و چسبندگی اندوتلیال را افزایش میدهند که خانهسازی سلولهای ایمنی را تسهیل میکند (شکل 6). علاوه بر این، برخی شواهد حاکی از آن است که نورونها ممکن است مستقیماً در فاز مؤثر شرکت کنند، زیرا خود نوروپپتیدها ممکن است عملکردهای ضد میکروبی مستقیم داشته باشند.
مولکولهای سیگنالدهنده مشتقشده از نورون نیز میتوانند با کمک به تمایز یا تعیین انواع مختلف سلولهای T ایمنی سازگار، نوع التهاب را هدایت کنند. یک آنتی ژن توسط سلول های ایمنی ذاتی فاگوسیتوز و پردازش می شود که سپس به نزدیک ترین غدد لنفاوی مهاجرت می کنند و پپتید آنتی ژنی را به سلول های T ساده ارائه می دهند. بسته به نوع آنتی ژن، مولکولهای تحریککننده سلول ایمنی ذاتی و ترکیبی از سیتوکینهای خاص، سلولهای T ساده به زیرگروههای خاصی بالغ میشوند که بهترین عملکرد را در تلاش التهابی برای پاک کردن محرک بیماریزا دارند. سلول های CD4 T یا سلول های کمکی T (Th) را می توان به چهار گروه اصلی Th1، Th2، Th17 و سلول های تنظیم کننده T (Treg) تقسیم کرد. سلولهای Th1 عمدتاً در تنظیم پاسخهای ایمنی به میکروارگانیسمهای داخل سلولی و بیماریهای خودایمنی اختصاصی اندام نقش دارند. Th2 برای ایمنی در برابر پاتوژن های خارج سلولی مانند کرم ها حیاتی است و مسئول بیماری های التهابی آلرژیک است. سلول های Th17 نقش اصلی را در محافظت در برابر چالش های میکروبی مانند باکتری ها و قارچ های خارج سلولی ایفا می کنند. سلول های Treg در حفظ تحمل خود و تنظیم پاسخ های ایمنی نقش دارند. به نظر می رسد که این فرآیند بلوغ سلول T به شدت تحت تأثیر واسطه های عصبی حسی است. نوروپپتیدها، مانند CGRP و VIP، می توانند سلول های دندریتیک را به سمت ایمنی نوع Th2 سوق دهند و ایمنی نوع Th1 را با ترویج تولید سایتوکین های خاص و مهار سایرین، و همچنین با کاهش یا افزایش مهاجرت سلول های دندریتیک به غدد لنفاوی محلی 8 کاهش دهند. 10، 43. نورون های حسی نیز به طور قابل توجهی در التهاب آلرژیک (عمدتاً Th2 محور) نقش دارند. 17، 1، به این معنی که نورون ها نیز ممکن است در تنظیم وضوح التهابی نقش داشته باشند. در آسیب شناسی های ایمنی مانند کولیت و پسوریازیس، محاصره واسطه های عصبی مانند ماده P ممکن است به طور قابل توجهی سلول T و آسیب ناشی از سیستم ایمنی 2-1 را کاهش دهد، اگرچه مخالفت با یک واسطه ممکن است به خودی خود تأثیر محدودی بر التهاب نوروژنیک داشته باشد.
با توجه به اینکه مولکول های سیگنال آزاد شده از فیبرهای عصبی حسی محیطی نه تنها رگ های خونی کوچک را تنظیم می کنند، بلکه همچنین شیمی درمانی، تعقیب، بلوغ و فعال سازی سلول های ایمنی را تنظیم می کنند، واضح است که تعاملات ایمنی عصبی بسیار پیچیده تر از آنچه قبلا تصور می شد (شکل 2). علاوه بر این، کاملا قابل تصور است که آن نه متخصصان عصبی فردی بلکه ترکیبی خاص از مولکول های سیگنالینگ آزاد شده از نوکسیپتورها است که بر مراحل مختلف و انواع واکنش های ایمنی تأثیر می گذارد.
کنترل رفلکس مستقل از ایمنی
نقش یک مدار بازتابی سیستم عصبی خودمختار کولینرژیک در تنظیم پاسخهای ایمنی محیطی نیز برجسته است. کار کوین تریسی و دیگران به پاسخهای ضد التهابی عمومی قوی در شوک سپتیک و اندوتوکسمی اشاره میکند که توسط یک فعالیت عصب واگ وابران منجر به سرکوب ماکروفاژهای محیطی 46-47 میشود. واگ نورون های گانگلیون سلیاک محیطی را فعال می کند که به طحال عصب دهی می کنند و منجر به آزاد شدن پایین دست استیل کولین می شود که به گیرنده های نیکوتین آلفا-49 روی ماکروفاژها در طحال و دستگاه گوارش متصل می شود. این باعث فعال شدن مسیر سیگنالینگ JAK7/STAT2 SOCS3 می شود، که به شدت رونویسی TNF-alpha 3 را سرکوب می کند. گانگلیون سلیاک آدرنرژیک همچنین مستقیماً با زیرمجموعه ای از سلول های T حافظه تولید کننده استیل کولین، که ماکروفاژهای التهابی 47 را سرکوب می کنند، ارتباط برقرار می کند.
سلولهای T-killer طبیعی (iNKT) یک زیرمجموعه تخصصی از سلولهای T هستند که به جای آنتی ژنهای پپتیدی، لیپیدهای میکروبی را در زمینه CD1d تشخیص می دهند. سلول های NKT یک جمعیت کلیدی لنفوسیتی هستند که در مبارزه با بیماری های عفونی و تنظیم ایمنی سیستمیک دخیل هستند. سلول های NKT ساکن و ترافیکی عمدتا از طریق عروق و سینوس ها از طحال و کبد. اعصاب بتا آدرنرژیک سمپاتیک در کبد به طور مستقیم سیگنال را برای تنظیم فعالیت 50 سلول NKT می کند. برای مثال، در طی یک مدل موش سکته مغزی (MCAO)، تحرک سلولی NKT کبد به طور قابل ملاحظه ای سرکوب شد، که با انحصار سمپاتیک یا آنتاگونیست های بتا آدرنرژیک معکوس شد. علاوه بر این، این فعالیت های ایمنی سرکوب کننده نورون های نئودرنرژیک در سلول های NKT منجر به افزایش عفونت سیستمیک و آسیب ریه می شود. بنابراین، سیگنال های عصبی از نورون های اتونومیک می تواند یک مهار قوی ایمنی را مهار کند.

دکتر الکس جیمنز Insight
التهاب نوروژنیک پاسخ التهابی محلی تولید شده توسط سیستم عصبی است. اعتقاد بر این است که نقش اساسی در پاتوژنز انواع مسائل مربوط به سلامت، از جمله، میگرن، پسوریازیس، آسم، فیبرومیالژیا، اگزما، روده ای، دیستونی و حساسیت شیمیایی چندگانه. گرچه التهاب نوروژنیک مرتبط با سیستم عصبی محیطی به طور گسترده مورد بررسی قرار گرفته است، مفهوم التهاب نوروژنیک در سیستم عصبی مرکزی هنوز نیازمند تحقیقات بیشتری است. با توجه به مطالعات انجام شده در چندین مطالعه، کمبود منیزیم، علت اصلی التهاب نوروژنیک است. مقاله زیر نشان دهنده مكانیسم التهاب نوروژنیک در سیستم عصبی است كه ممكن است به متخصصان مراقبت های بهداشتی بهترین روش درمان را برای مراقبت از انواع مختلف مسائل بهداشتی مربوط به سیستم عصبی تعیین كند.
نتیجه گیری
نقشهای خاص مربوط به سیستمهای عصبی حسی و خودمختار در تنظیم التهاب و سیستم ایمنی چیست (شکل 4)؟ فعال شدن گیرندههای درد منجر به رفلکسهای آکسونی موضعی میشود که به صورت موضعی سلولهای ایمنی را جذب و فعال میکنند و بنابراین، عمدتاً پیش التهابی و از نظر فضایی محدود میشوند. در مقابل، تحریک اتونومیک منجر به سرکوب سیستمیک سیستم ایمنی با تأثیر گذاشتن بر سلولهای ایمنی در کبد و طحال میشود. مکانیسمهای سیگنالدهی آوران در محیطی که منجر به تحریک مدار رفلکس کولینرژیک واگ سرکوبکننده سیستم ایمنی میشود، به خوبی درک نشدهاند. با این حال، 80 تا 90 درصد از الیاف واگ، فیبرهای حسی آوران اولیه هستند، و بنابراین سیگنالهای احشایی، که بسیاری از آنها به طور بالقوه توسط سلولهای ایمنی هدایت میشوند، ممکن است منجر به فعال شدن نورونهای داخلی در ساقه مغز و از طریق آنها به خروجی در فیبرهای واگ وابانی شود.
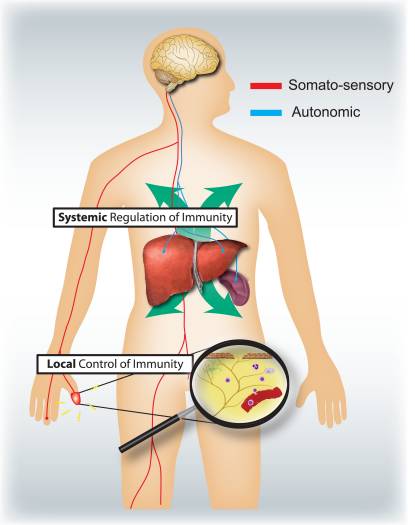
شکل 4: سیستم های عصبی حسی و اتونومیک به ترتیب واکنش های ایمنی محلی و سیستمیک را مدون می کنند. نقص ایمنی سطوح اپیتلیال (مانند پوست و ریه) موجب پاسخ های التهابی موضعی، فعال کردن سلول های مشت و سلول های دندریتیک می شود. در التهاب هوای آلرژیک، درماتیت و آرتریت روماتوئید، نورونهای ناشی از نقص در التهاب رانندگی نقش دارند. در مقابل، مدارهای اتمی که از اندام های احشایی (مثلا طحال و کبد) رنج می برند، با مسدود کردن ماکروفاژ و فعال سازی سلول های NKT، پاسخ سیستم ایمنی را تنظیم می کنند. در سکته مغزی و اندوتوکسمی سپتیک، این نورون ها نقش مهار کننده ایمنی را ایفا می کنند.
به طور معمول، دوره زمانی و ماهیت التهاب، چه در هنگام عفونت، واکنش های آلرژیک، و چه از نظر پاتولوژی خودکار، توسط دسته های سلولی ایمنی تعریف شده است. مهم است بدانیم که انواع مختلف سلول های ایمنی توسط سیگنال های حسی و اتئومی تنظیم می شوند. ارزیابی سیستماتیک از اینکه میانجی ها می توانند از سلول های غیر اختصاصی و نورون های اتونوم آزاد شوند و بیان کننده گیرنده های آن توسط سلول های ایمنی مختلف ذاتی و انعطاف پذیر آزاد شوند می توانند به این سوال پاسخ دهند.
در طول تکامل، مسیرهای مولکولی تشخیص خطر مشابهی برای ایمنی ذاتی و درد ایجاد شده است، حتی اگر سلولها دودمان رشدی کاملاً متفاوتی داشته باشند. در حالی که PRR ها و کانال های یونی مضر با لیگاند دردار به طور جداگانه توسط ایمونولوژیست ها و نوروبیولوژیست ها مورد مطالعه قرار می گیرند، خط بین این دو میدان به طور فزاینده ای مبهم است. در طول آسیب بافتی و عفونت بیماریزا، انتشار سیگنالهای خطر احتمالاً منجر به فعالسازی هماهنگ نورونهای محیطی و سلولهای ایمنی با ارتباطات پیچیده دو طرفه و دفاع یکپارچه میزبان میشود. موقعیت آناتومیکی گیرندههای درد در سطح مشترک با محیط، سرعت انتقال عصبی و توانایی آنها در آزادسازی کوکتلهای قوی واسطههای فعال ایمنی به سیستم عصبی محیطی اجازه میدهد تا به طور فعال پاسخ ایمنی ذاتی را تعدیل کند و ایمنی تطبیقی پاییندستی را هماهنگ کند. برعکس، گیرندههای درد به واسطههای ایمنی بسیار حساس هستند که نورونها را فعال و حساس میکنند. بنابراین، التهاب نوروژنیک و با واسطه ایمنی، نهادهای مستقلی نیستند، اما با هم به عنوان ابزار هشدار دهنده اولیه عمل می کنند. با این حال، سیستم عصبی محیطی همچنین نقش مهمی در پاتوفیزیولوژی و شاید سبب شناسی بسیاری از بیماری های ایمنی مانند آسم، پسوریازیس یا کولیت دارد زیرا ظرفیت آن برای فعال کردن سیستم ایمنی می تواند التهاب پاتولوژیک را تقویت کند. بنابراین، درمان اختلالات ایمنی ممکن است شامل هدف قرار دادن گیرنده های درد و همچنین سلول های ایمنی باشد.
سپاسگزاریها
ما از NIH برای پشتیبانی (2R37NS039518) تشکر می کنیم.
در نتیجه،درک نقش التهاب عصبی در دفاع از میزبان و آسیب شناسی ایمنی برای تعیین رویکرد درمانی مناسب برای انواع مسائل سلامت سیستم عصبی ضروری است. با بررسی تعاملات نورون های محیطی با سلول های ایمنی، متخصصان مراقبت های بهداشتی ممکن است رویکردهای درمانی را برای کمک به افزایش دفاع میزبان و همچنین سرکوب آسیب شناسی ایمنی پیش ببرند. هدف مقاله بالا کمک به بیماران در درک نوروفیزیولوژی بالینی نوروپاتی، در میان سایر مسائل سلامت آسیب عصبی است. اطلاعات ارجاع شده از مرکز ملی اطلاعات بیوتکنولوژی (NCBI). دامنه اطلاعات ما محدود به کایروپراکتیک و همچنین آسیب ها و شرایط ستون فقرات است. برای بحث در مورد موضوع، لطفاً از دکتر خیمنز بپرسید یا با ما تماس بگیرید915-850-0900.
دکتر الکس جیمنز سرپرستی می کند
موارد اضافی: درد پشت
درد پشت یکی از شایع ترین علل ناتوانی و از دست رفته روز در کار در سراسر جهان است. به عنوان حقيقت، درد پشتي به عنوان دومين شايعترين دلايل بازديد پزشکي، نسبت به عفونت فوقاني تنفسي کمتر است. تقریبا 80 درصد از جمعیت حداقل یک بار در طول زندگی خود نوعی کمر درد را تجربه خواهند کرد. ستون فقرات یک ساختار پیچیده ای است که از استخوان ها، مفاصل، لیگامان ها و ماهیچه ها در میان دیگر بافت های نرم تشکیل شده است. به همین دلیل، آسیب و / یا شرایط شدید، مانند دیسک های فتق دیسک، در نهایت می تواند منجر به علائم درد پشت شود. آسیب های ورزشی یا آسیب های ناشی از تصادفات خودرو اغلب اغلب علت درد پشت هستند، اما گاهی اوقات ساده ترین حرکات می توانند نتایج دردناکی داشته باشند. خوشبختانه، گزینه های درمان جایگزین، مانند مراقبت از کیهان پراکسی، می تواند به کاهش درد در استفاده از تنظیمات ستون فقرات و دستکاری دست کمک کند و در نهایت بهبود تسکین درد را کاهش دهد.

موضوع فوق العاده مهم: مدیریت کم پشت درد
موضوعات بیشتر: موارد اضافی اضافی: Painدرمان و درمان های مزمن
جای خالی
منابع
بستن آکاردئون
اطلاعات اینجا در "نقش التهاب نوروژنیک"در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من