بیوشیمی درد:llهمه سندرم های درد دارای نمایه التهاب هستند. مشخصات التهابی می تواند از فردی به فرد دیگر متفاوت باشد و همچنین می تواند در یک فرد در زمان های مختلف متفاوت باشد. درمان سندرم درد درک این مشخصات التهاب است. سندرم های درد از نظر پزشکی ، جراحی یا هر دو درمان می شوند. هدف جلوگیری یا سرکوب تولید واسطه های التهابی است. و نتیجه موفقیت آمیز نتیجه ای است که منجر به التهاب کمتر و البته درد کمتر می شود.
فهرست
بیوشیمی درد
اهداف:
- بازیکنان کلیدی چه کسانی هستند؟
- مکانیسم های بیوشیمیایی چیست؟
- پیامدها چیست؟
نقص التهاب:
بازیکنان اصلی
 چرا شانه ام درد می کند؟ مروری بر اساس عصب شناسی و بیوشیمیایی درد شانه
چرا شانه ام درد می کند؟ مروری بر اساس عصب شناسی و بیوشیمیایی درد شانه
چکیده
اگر بیمار بپرسد "چرا شانه من درد می کند؟" گفتگو به سرعت به تئوری علمی و گاهی حدس غیرمستقیم تبدیل می شود. غالباً ، پزشک بالینی از حدود مبنای علمی توضیح آنها آگاه می شود و این نشان دهنده ناقص بودن درک ما از ماهیت درد شانه است. این بررسی با رویکردی منظم برای کمک به پاسخگویی به س questionsالات اساسی مربوط به درد شانه ، با هدف ارائه بینش در مورد تحقیقات آینده و روشهای جدید برای درمان درد شانه ، ارائه می شود. ما نقش (1) گیرنده های محیطی ، (2) پردازش درد محیطی یا "عدم درد" ، (3) نخاع ، (4) مغز ، (5) محل گیرنده ها در شانه و (6) ) آناتومی عصبی شانه. ما همچنین در نظر داریم که چگونه این عوامل می توانند در تغییر در تظاهرات بالینی ، تشخیص و درمان درد شانه نقش داشته باشند. از این طریق هدف ما ارائه یک بررسی اجمالی از اجزای تشکیل دهنده سیستم تشخیص درد محیطی و مکانیسم های پردازش درد مرکزی در درد شانه است که برای ایجاد درد بالینی تعامل دارند.
مقدمه: تاریخچه مختصری از علم مواد مخدر برای پزشکان
ماهیت درد ، به طور کلی ، در قرن گذشته مورد بحث و مجادله بسیاری قرار گرفته است. در قرن 17 تئوری دكارت 1 پیشنهاد كرد كه شدت درد مستقیماً با میزان آسیب بافتی مرتبط است و درد در یك مسیر مشخص پردازش می شود. بسیاری از نظریه های قبلی با تکیه بر این فلسفه اصطلاحاً ualdualist دکارت ، درد را نتیجه تحریک گیرنده درد محیطی خاص در مغز می دانستند. در قرن 20 نبرد علمی بین دو نظریه مخالف ، یعنی نظریه ویژگی و نظریه الگو ، درگرفت. "تئوری خاصیت" دکارت درد را به عنوان یک روش خاص جداگانه از ورودی حسی با دستگاه خود می داند ، در حالی که "تئوری الگوی" احساس می کند که درد ناشی از تحریک شدید گیرنده های غیر اختصاصی است. 2 در سال 1965 ، وال و ملزاک 3 تئوری دروازه درد شواهدی را برای مدلی فراهم کرده است که در آن درک درد توسط بازخورد حسی و سیستم عصبی مرکزی تعدیل می شود. پیشرفت عظیم دیگری که در تئوری درد وجود داشت ، تقریباً در همان زمان کشف شیوه خاصی از اعمال مخدر بود .4 پس از آن ، پیشرفت های اخیر در تصویربرداری عصبی و پزشکی مولکولی درک کلی ما از درد را بسیار گسترش داده است.
پس این چه ارتباطی با درد شانه دارد؟درد شانه یک مشکل بالینی رایج استو درک صحیح از روش پردازش درد توسط بدن برای تشخیص بهتر و درمان درد بیمار ضروری است. پیشرفت دانش ما در زمینه پردازش درد نوید عدم تطابق آسیب شناسی و درک درد را می دهد ، همچنین ممکن است به ما در توضیح اینکه چرا برخی بیماران به برخی از درمان ها پاسخ نمی دهند کمک کند.
بلوک های ساختمان BASIC از درد
گیرنده های حسی محیطی: گیرنده مکانیکی و "گیرنده قلب"
انواع مختلفی از گیرنده های حسی محیطی در سیستم اسکلتی عضلانی انسان وجود دارد. 5 آنها ممکن است بر اساس عملکردشان (به عنوان گیرنده های مکانیکی ، گیرنده های حرارتی یا گیرنده های قلب) یا مورفولوژی (انتهای عصب آزاد یا انواع مختلف گیرنده های کپسوله شده) طبقه بندی شوند. 5 انواع مختلف گیرنده ها را می توان بر اساس وجود مارکرهای شیمیایی خاص. به عنوان مثال ، همسان سازی قابل توجهی بین کلاسهای مختلف عملکردی گیرنده وجود دارد
پردازش درد محیطی: "درد"
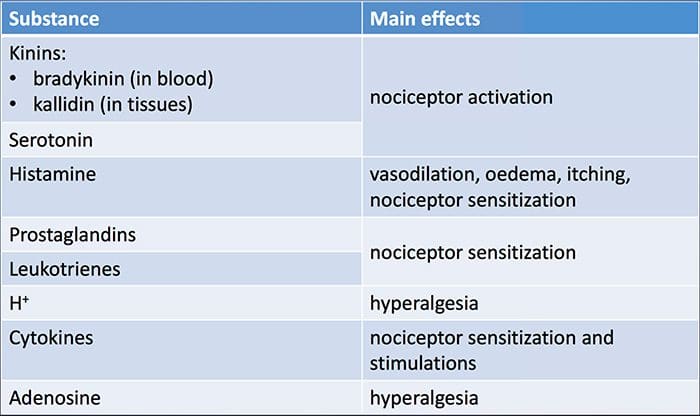
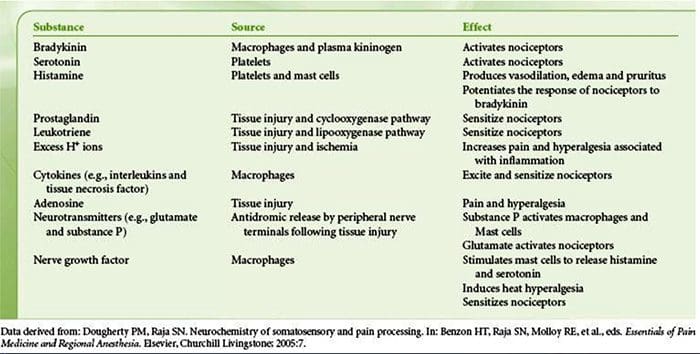
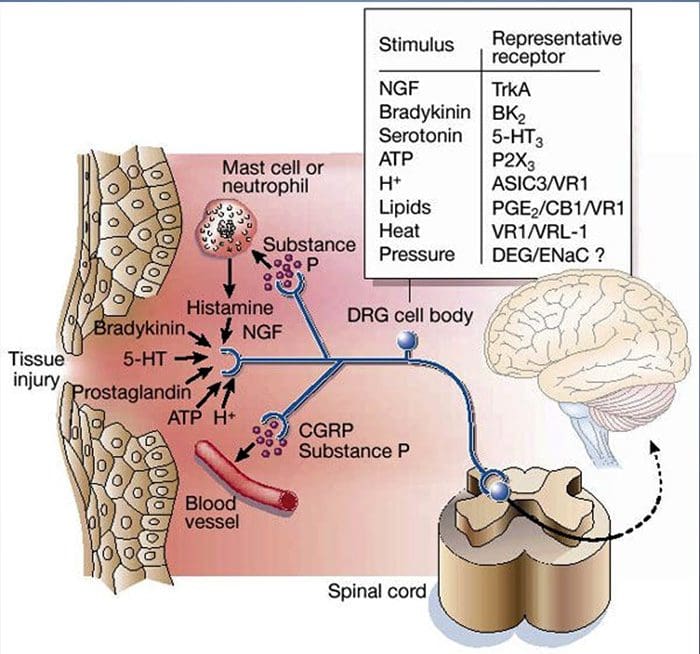
آسیب بافتی شامل انواع واسطه های التهابی است که توسط سلولهای آسیب دیده از جمله برادی کینین ، هیستامین ، 5-هیدروکسی تریپتامین ، ATP ، اکسید نیتریک و یونهای خاص (K + و H +) آزاد می شود. فعال شدن مسیر اسید آراشیدونیک منجر به تولید پروستاگلاندین ها ، ترومبوکسان ها و لکو-تریین ها می شود. سیتوکین ها ، از جمله اینترلوکین ها و فاکتور نکروز تومور؟ و نوروتروفین ها ، مانند فاکتور رشد عصب (NGF) نیز آزاد می شوند و از نزدیک در تسهیل التهاب نقش دارند .15 مواد دیگر مانند آمینو اسیدهای تحریک کننده (گلوتامات) و مواد مخدر ( اندوتلین -1) نیز در پاسخ التهابی حاد نقش داشته است. 16 17 برخی از این عوامل ممکن است مستقیماً دندان های درد را فعال کنند ، در حالی که برخی دیگر باعث جذب سلولهای دیگر می شوند که عوامل تسهیل کننده بیشتری آزاد می کنند. 18 این روند محلی منجر به افزایش پاسخ می شود از سلولهای عصبی درد در ورودی طبیعی آنها و / یا استخدام پاسخ به ورودیهای زیرآستانه معمولاً "حساسیت محیطی" نامیده می شود. شکل 1 خلاصه برخی از مکانیسم های اصلی درگیر است.
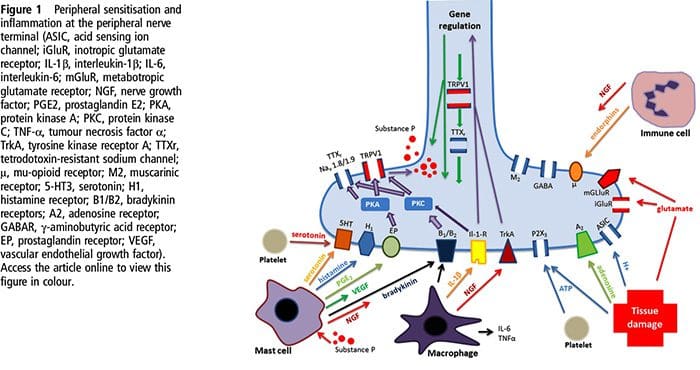 NGF و گیرنده موقت گیرنده کانال کاتیونی پتانسیل زیرخانواده V عضو 1 (TRPV1) هنگامی که نوبت به التهاب و حساسیت به گیرنده می رسد ، رابطه همزیستی دارند. سیتوکینهای تولید شده در بافت ملتهب منجر به افزایش تولید NGF می شود. 19 NGF باعث ترشح هیستامین و سروتونین (5-HT3) توسط سلولهای ماست می شود و همچنین باعث حساس شدن مفصل گیرنده های عصبی می شود و احتمالاً خواص A را تغییر می دهد؟ الیافی به گونه ای است که نسبت بیشتری دچار درد می شوند. گیرنده TRPV1 در زیر جمعیتی از الیاف آوران اولیه وجود دارد و توسط کپسایسین ، گرما و پروتون ها فعال می شود. گیرنده TRPV1 در بدن سلول از الیاف آوران سنتز می شود و به هر دو ترمینال محیطی و مرکزی منتقل می شود و در آنجا به حساسیت آوران درد کمک می کند. التهاب منجر به تولید NGF به صورت محیطی می شود که سپس به گیرنده تیروزین کیناز نوع 1 در ترمینال های گیرنده اتصال می یابد ، NGF سپس به بدن سلول منتقل می شود و منجر به تنظیم رونویسی TRPV1 و در نتیجه افزایش حساسیت گیرنده می شود. 19 20 NGF و سایر واسطه های التهابی نیز TRPV1 را از طریق آرایه متنوعی از مسیرهای پیام رسان ثانویه حساس می کنند. تصور می شود که بسیاری از گیرنده های دیگر از جمله گیرنده های کولینرژیک ، گیرنده های اسید آمینوبوتیریک اسید (GABA) و گیرنده های سوماتواستاتین نیز در حساسیت دندان گیرنده محیطی نقش دارند.
NGF و گیرنده موقت گیرنده کانال کاتیونی پتانسیل زیرخانواده V عضو 1 (TRPV1) هنگامی که نوبت به التهاب و حساسیت به گیرنده می رسد ، رابطه همزیستی دارند. سیتوکینهای تولید شده در بافت ملتهب منجر به افزایش تولید NGF می شود. 19 NGF باعث ترشح هیستامین و سروتونین (5-HT3) توسط سلولهای ماست می شود و همچنین باعث حساس شدن مفصل گیرنده های عصبی می شود و احتمالاً خواص A را تغییر می دهد؟ الیافی به گونه ای است که نسبت بیشتری دچار درد می شوند. گیرنده TRPV1 در زیر جمعیتی از الیاف آوران اولیه وجود دارد و توسط کپسایسین ، گرما و پروتون ها فعال می شود. گیرنده TRPV1 در بدن سلول از الیاف آوران سنتز می شود و به هر دو ترمینال محیطی و مرکزی منتقل می شود و در آنجا به حساسیت آوران درد کمک می کند. التهاب منجر به تولید NGF به صورت محیطی می شود که سپس به گیرنده تیروزین کیناز نوع 1 در ترمینال های گیرنده اتصال می یابد ، NGF سپس به بدن سلول منتقل می شود و منجر به تنظیم رونویسی TRPV1 و در نتیجه افزایش حساسیت گیرنده می شود. 19 20 NGF و سایر واسطه های التهابی نیز TRPV1 را از طریق آرایه متنوعی از مسیرهای پیام رسان ثانویه حساس می کنند. تصور می شود که بسیاری از گیرنده های دیگر از جمله گیرنده های کولینرژیک ، گیرنده های اسید آمینوبوتیریک اسید (GABA) و گیرنده های سوماتواستاتین نیز در حساسیت دندان گیرنده محیطی نقش دارند.
تعداد زیادی از واسطه های التهابی به طور خاص در درد شانه و بیماری روتاتور کاف نقش دارند. 21 25 در حالی که برخی از واسطه های شیمیایی مستقیماً دندان درد را فعال می کنند ، بیشتر منجر به تغییر در نورون حسی می شود تا اینکه مستقیماً آن را فعال کند. این تغییرات ممکن است به نسخه اولیه پس از ترجمه یا تأخیر بستگی داشته باشد. نمونه های قبلی تغییر در گیرنده TRPV1 یا کانال های یونی ولتاژدار ناشی از فسفوریلاسیون پروتئین های متصل به غشا است. نمونه هایی از دومی شامل افزایش تولید کانال TRV1 ناشی از NGF و فعال شدن فاکتورهای رونویسی داخل سلولی ناشی از کلسیم است.
مکانیسم های مولکولی غلبه بر بیماری
احساس درد ما را از آسیب واقعی یا قریب الوقوع آگاه می کند و پاسخ های محافظتی مناسبی را ایجاد می کند. متأسفانه ، درد اغلب از مفید بودن خود به عنوان سیستم هشدار بیشتر است و در عوض مزمن و ناتوان کننده می شود. این انتقال به یک مرحله مزمن شامل تغییراتی در نخاع و مغز است ، اما همچنین در آنجا پیام های درد در سطح نورون حسی اولیه شروع می شوند ، تعدیل قابل توجهی نیز وجود دارد. تلاش ها برای تعیین چگونگی تشخیص این نورون ها محرک های تولید کننده درد از نظر حرارتی ، مکانیکی یا شیمیایی ، مکانیسم های جدید سیگنالینگ را نشان داده و ما را به درک حوادث مولکولی که انتقال از درد حاد به درد را تسهیل می کنند ، نزدیک می کند.
 نوروشیسم عفونت های ادراری
نوروشیسم عفونت های ادراری
گلوتامات انتقال دهنده عصبی هیجان انگیز غالب در تمام موارد غیر اختصاصی است. مطالعات Histochemical از DRG بالغ، با این حال، نشان می دهد دو کلاس گسترده از فیبر ناقلین C.
مبدل های شیمیایی برای بدتر شدن درد
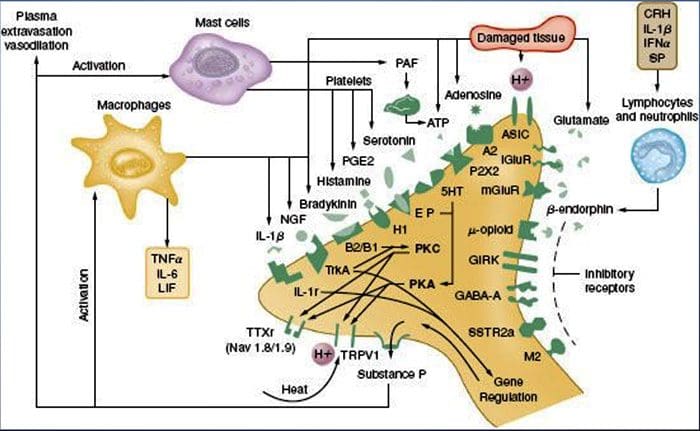
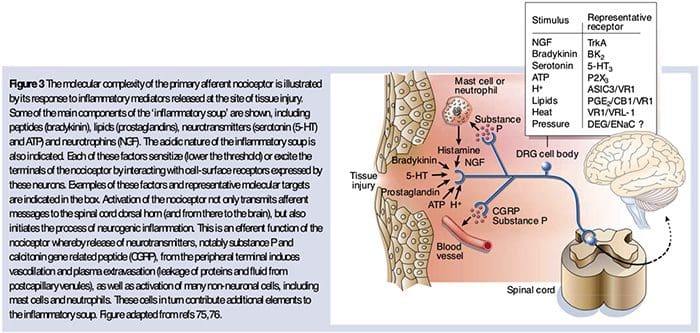
همانطور که در بالا توضیح داده شد، آسیب به افزایش تجربه درد ما با افزایش حساسیت نوکسی پروستات به هر دو محرک حرارتی و مکانیکی. این پدیده به طور جزئی از تولید و انتشار واسطه های شیمیایی از ترمینال حسی اولیه و از سلول های غیر عصبی (به عنوان مثال، فیبروبلاست ها، سلول های مشت، نوتروفیل ها و پلاکت ها) در محیط 36 (شکل 3) نتیجه می گیرد. برخی از اجزای سوپ التهابی (مثلا پروتون، ATP، سروتونین یا لیپیدها) می توانند تحریک پذیری عصبی را به طور مستقیم توسط اینتراثیر با کانال های یونی بر سطح نوتسیپتور تغییر دهند، در حالی که دیگران (مانند برادیکینین و NGF) به گیرنده های متابوتروپیک متصل می شوند و میان آنها اثرات خود را از طریق cascades11 سیگنال دوم. پیشرفت قابل ملاحظه ای در درک مبانی بیوشیمی از این مکانیسم های تعدیل شده انجام شده است.
پروتونهای خارج سلولی و اسیدوز بافتی
اسیدوز بافت موضعی واکنش فیزیولوژیکی مشخصی به آسیب است و میزان درد و ناراحتی مرتبط با میزان اسیدی شدن 37 همبستگی خوبی دارد. استفاده از اسید (pH 5) به پوست موجب تخلیه پایدار در یک سوم یا بیشتر از نوکسیپتورهای چندتایی می شود که 20 را جذب می کنند.
 مکانیسم سلولی و مولکولی درد
مکانیسم سلولی و مولکولی درد
چکیده
سیستم عصبی طیف گسترده ای از محرک های حرارتی و مکانیکی و همچنین مواد زیست محیطی و مواد شیمیایی درون زا را تشخیص و تفسیر می کند. هنگامی که شدت، این محرک ها درد حاد را ایجاد می کنند، و در مواجهه با آسیب های مداوم، اجزای سیستم عصبی محیطی و مرکزی مسیر انتقال درد، انعطاف پذیری فوق العاده ای دارند، افزایش سیگنال های درد و ایجاد حساسیت بالا. هنگامی که پلاستیک رفلکس های محافظتی را تسهیل می کند، می تواند سودمند باشد، اما زمانی که تغییرات ادامه می یابد، ممکن است یک بیماری مزمن درد ایجاد شود. مطالعات ژنتیکی، الکتروفیزیولوژیک و فارماکولوژیک، مکانیسم های مولکولی را تشریح می کنند که تشخیص، کد گذاری و مدولاسیون محرک های خطرناک را ایجاد می کنند.
مقدمه: درد حاد در مقابل مداوم
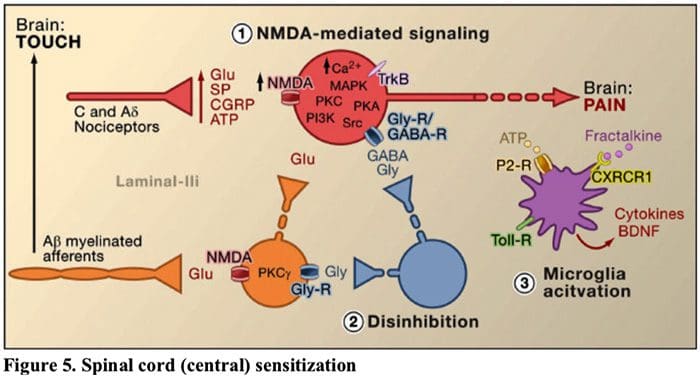 شکل 5 ستون فقرات (مرکزی) حساسیت
شکل 5 ستون فقرات (مرکزی) حساسیت
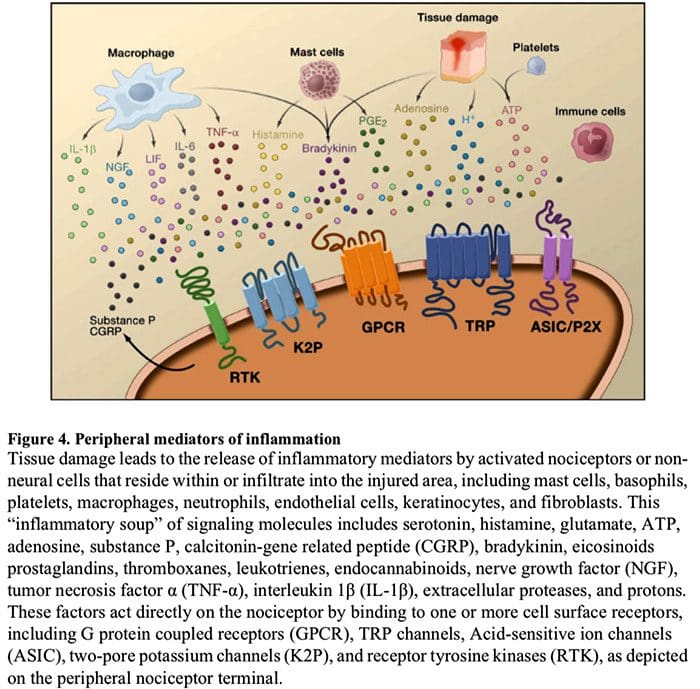
- حساسیت گیرنده گیرنده گلوتامات / NMDA.به دنبال تحریک شدید یا آسیب مداوم، C و A فعال شد؟ گیرندههای درد انواع مختلفی از انتقالدهندههای عصبی از جمله دلوتامات، ماده P، پپتید مرتبط با ژن کلسیتونین (CGRP) و ATP را بر روی نورونهای خروجی در لایه I شاخ پشتی سطحی (قرمز) آزاد میکنند. در نتیجه، گیرندههای گلوتامات NMDA معمولاً خاموش واقع در نورون پس سیناپسی اکنون میتوانند سیگنال دهند، کلسیم داخل سلولی را افزایش دهند و میزبان مسیرهای سیگنالینگ وابسته به کلسیم و پیامرسانهای دوم از جمله پروتئین کیناز فعال شده با میتوژن (MAPK)، پروتئین کیناز C (PKC) را فعال کنند. پروتئین کیناز A (PKA) و Src. این آبشار از رویدادها تحریک پذیری نورون خروجی را افزایش می دهد و انتقال پیام های درد به مغز را تسهیل می کند.
- رد شدندر شرایط عادی، نورونهای بازدارنده (آبی) به طور مداوم GABA و/یا گلیسین (Gly) را آزاد میکنند تا تحریکپذیری نورونهای خروجی لایه I را کاهش دهند و انتقال درد را تعدیل کنند (تن بازدارنده). با این حال، در محل آسیب، این مهار می تواند از بین برود و منجر به پردردی شود. علاوه بر این، مهار میتواند A میلین دار غیردردی را فعال کند؟ آوران های اولیه برای درگیر شدن با مدار انتقال درد به گونه ای که محرک های معمولی بی ضرر اکنون به عنوان دردناک تلقی می شوند. این تا حدی از طریق مهار PKC تحریکی رخ می دهد؟ بیان نورون های داخلی در لایه داخلی II.
- فعال سازی میکروگلالیالآسیب عصب محیطی باعث ترشح ATP و کموکاین فراکتالکین می شود که سلول های میکروگلیال را تحریک می کند. به طور خاص، فعالسازی گیرندههای پورینرژیک، CX3CR1 و Toll مانند روی میکروگلیا (بنفش) منجر به آزاد شدن فاکتور نوروتروفیک مشتق از مغز (BDNF) میشود که از طریق فعالسازی گیرندههای TrkB بیانشده توسط نورونهای خروجی لایه I، تحریکپذیری را افزایش میدهد و افزایش درد در پاسخ به تحریکات مضر و بی ضرر (یعنی پردردی و آلوداینیا). میکروگلیاهای فعال شده همچنین مجموعه ای از سیتوکین ها مانند فاکتور نکروز تومور را آزاد می کنند. (TNF؟)، اینترلوکین-1؟ و 6 (IL-1?، IL-6)، و سایر عواملی که در ایجاد حساسیت مرکزی نقش دارند.
شیمی مواد مخدر از التهاب
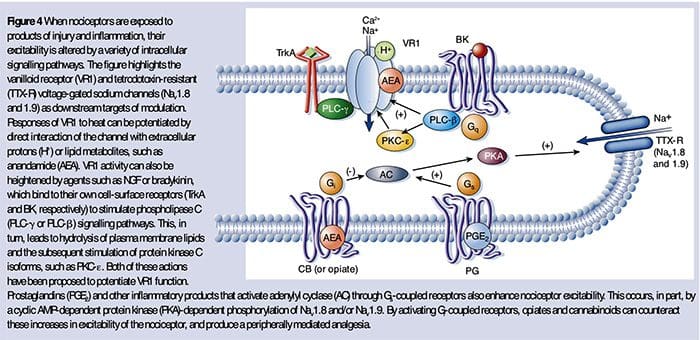
حساسیت محیطی معمولاً از تغییرات مرتبط با التهاب در محیط شیمیایی رشته عصبی ناشی می شود (مک ماهون و همکاران ، 2008). بنابراین ، آسیب بافتی غالباً با تجمع فاکتورهای درون زای آزادشده از مفصل های فعال کننده یا سلول های غیر عصبی که در ناحیه آسیب دیده ساکن هستند یا به آنها نفوذ می کنند (شامل ماست سل ها ، بازوفیل ها ، پلاکت ها ، ماکروفاژها ، نوتروفیل ها ، سلول های اندوتلیال ، کراتینوسیت ها و فیبروبلاست). جمعاً این عوامل که به عنوان "سوپ التهابی" شناخته می شوند ، نمایانگر مجموعه وسیعی از مولکول های سیگنالینگ هستند ، از جمله انتقال دهنده های عصبی ، پپتیدها (ماده P ، CGRP ، برادی کینین) ، ایکوزینوئیدها و لیپیدهای مرتبط (پروستاگلاندین ها ، ترومبوکسان ها ، لکوترین ها ، اندوکانابینوئیدها) ، نوروتروفین ها ، سیتوکین ها ، و کموکین ها ، و همچنین پروتئازها و پروتونهای خارج سلول. به طرز قابل توجهی ، گیرنده های قلب یک یا چند گیرنده سطح سلول را بیان می کنند که قادر به شناسایی و پاسخ دادن به هر یک از این عوامل پیش التهاب یا ضد الجزی است (شکل 4). چنین تعاملات باعث تحریک پذیری فیبر عصبی می شوند ، در نتیجه حساسیت آن را نسبت به دما یا لمس افزایش می دهند.
بی تردید شایع ترین روش برای کاهش درد التهابی شامل مهار سنتز یا انباشت اجزای سوپ التهابی می شود. این بهترین نمونه های ضد التهابی غیر استروئیدی مانند آسپرین یا ایبوپروفن است که باعث کاهش درد التهابی و هیپرالژزی با مهار سیکلوکسی سیناز (Cox-1 و Cox-2) درگیر در سنتز پروستاگلاندین می شود. یک رویکرد دوم این است که فعالیت های عوامل التهابی را در بیمار مبتلا به مسری بگذارد. در اینجا، ما نمونه هایی را نشان می دهیم که بینش جدیدی را در مکانیزم های سلولی حساسیت محیطی ایجاد می کنند یا اینکه اساس راهکارهای درمانی جدید برای درمان درد التهابی را تشکیل می دهند.
ممکن است NGF به دلیل نقش آن به عنوان یک عامل نوروتراپی مورد نیاز برای زنده ماندن و ایجاد نورون های حسینی در طی جنین زایی شناخته شده باشد، اما در بزرگسالان، NGF نیز در تنظیم آسیب بافت تولید می شود و یکی از اجزای مهم سوپ التهابی است (Ritner et al.، 2009). در میان بسیاری از اهداف سلولی، NGF مستقیما بر روی تکثیر سلول های پپتیدرژیک C عمل می کند که نشان دهنده گیرنده تیروتین کیناز گیرنده ی NGF، TrkA و همچنین گیرنده نوروتروپین با کمترین میل، p75 (Chao، 2003، Snider و McMahon، 1998) است. NGF باعث افزایش حساسیت عمیق به محرک های حرارتی و مکانیکی از طریق دو مکانیزم متمایز زمانی می شود. در ابتدا، یک تعامل NGF-TrkA مسیرهای سیگنالینگ downstream را فعال می کند، از جمله فسفولیپاز C (PLC)، پروتئین کیناز فعال شده با میتوگرافی (MAPK) و فسفونیویید 3-kinase (PI3K). این امر موجب افزایش کارایی پروتئین های هدف در ترمینال ناسسیپتور محیطی، به ویژه TRPV1 می شود که منجر به تغییر سریع حساسیت گرمای سلولی و رفتاری می شود (Chuang et al.، 2001).
صرف نظر از مکانیسم های پیش درمانی آنها ، تداخل در سیگنالینگ نوروتروفین یا سیتوکین به یک استراتژی اصلی برای کنترل بیماری التهابی یا درد ناشی از آن تبدیل شده است. روش اصلی شامل مسدود کردن NGF یا TNF- است؟ عمل با آنتی بادی خنثی کننده. در مورد TNF-؟ ، این به طور چشمگیری در درمان بیماریهای خودایمنی متعددی از جمله آرتریت روماتوئید م effectiveثر بوده و منجر به کاهش چشمگیر تخریب بافت و بیش از حد هیپرالژی می شود (آتزنی و همکاران ، 2005). از آنجا که اقدامات اصلی NGF در عضله بزرگسالی بزرگسالان در شرایط التهاب اتفاق می افتد ، مزیت این روش این است که هایپرالژیا بدون تأثیر بر روی آن کاهش می یابد درک عادی درد. در واقع، آنتی بادی ضد NGF در حال حاضر در آزمایشات بالینی برای درمان سندرم درد التهابی (Hefti و همکاران، 2006) است.
گلوتامات / NMDA گیرنده گیرنده حساس سازی
درد حاد با انتشار گلوتامات از پایانه های مرکزی نئوپسیپتورها، ایجاد جریان های پسین سکته پری اکتسابی (EPSCs) در نورون های شاخهای عقب دوم مرتبه نشان داده می شود. این موضوع عمدتا از طریق فعال شدن AMPA postynaptic و زیرت تیپ های گیرنده های گلوتامات یوناتروپیک می شود. جمعآوری EPSC های زیر آستانه در نورون های Postynaptic در نهایت منجر به شلیک بالقوه عمل و انتقال پیام درد به نورون های مرتبه بالاتر می شود.
مطالعات دیگر نشان می دهد که تغییر در نورون پروژکتور، به خودی خود، در فرآیند غیر مهار کننده کمک می کند. به عنوان مثال، آسیب عصبی محیطی به طور کلی KCCCNUMX K + -Cl-transporter را کاهش می دهد، که برای حفظ K + و Cl-طبیعی طبیعی در غشای پلاسما ضروری است (Coull et al.، 2). غلظت KCC2003 پایین، که در نورونهای لنزهای لامین بیان می شود، منجر به تغییر در Cl-gradient می شود، به طوری که فعال شدن گیرنده های GABA-A، نورون های پروجکشن لامینه I را کاهش می دهد. این به نوبه خود باعث افزایش تحریک پذیری و افزایش درد می شود. در واقع، بلوک های دارویی یا downregulation از طریق siRNA به KCC2 در موش باعث الودینای مکانیکی می شود.
منابع:
چرا شانه من صدمه دیده است؟ بررسی پایه عصبی و بیوشیمیایی درد شانه
بنجامین جان فلوید دین، استفان ادوارد گویلیم، اندرو جاناتان کار
مکانیسم های سلولی و مولکولی درد
Allan I. Basbaum1، Diana M. Bautista2، Gre؟ gory Scherrer1، and David Julius3
1 از بخش آناتومی، دانشگاه کالیفرنیا، سان فرانسیسکو 94158
2Department of Molecular and Cell Biology، دانشگاه کالیفرنیا، برکلی CA 94720 3 واحد فیزیولوژی، دانشگاه کالیفرنیا، سان فرانسیسکو 94158
مکانیزم های مولکولی عدم تشخیص
دیوید جولیوس * و آلن I. باسباوم
*بخش فارماکولوژی سلولی و مولکولی، و بخش آناتومی و فیزیولوژی و مرکز بنیاد WM Keck برای علوم اعصاب یکپارچه، دانشگاه کالیفرنیا سان فرانسیسکو، سانفرانسیسکو، کالیفرنیا 94143، ایالات متحده (ایمیل: julius@socrates.ucsf.edu)
اطلاعات اینجا در "بیوشیمی درد"در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من







