به دنبال قطع عصب محیطی اندام فوقانی و ترمیم جراحی، برخی از بیماران عملکرد حسی حرکتی خوبی را به دست می آورند در حالی که برخی دیگر این کار را نمی کنند. درک مکانیسم های محیطی و مرکزی که به بهبودی کمک می کنند ممکن است توسعه مداخلات درمانی جدید را تسهیل کند. انعطاف پذیری پس از قطع عصب محیطی در سراسر نورواکسیس در مدل های حیوانی آسیب عصبی نشان داده شده است. با این حال، تغییرات مغزی که به دنبال قطع عصب محیطی و ترمیم جراحی در انسان رخ می دهد، مورد بررسی قرار نگرفته است. علاوه بر این، میزان تأثیر بازسازی اعصاب محیطی بر تغییرات عملکردی و ساختاری مغز مشخص نشده است. بنابراین، ما پرسیدیم که آیا تغییرات عملکردی با تغییرات ساختاری ماده خاکستری و/یا سفید همراه است و آیا این تغییرات به بازیابی حسی مربوط می شود؟ برای رسیدگی به این مسائل کلیدی ما (من) بازسازی عصب محیطی را ارزیابی کردیم. (ب) فعال سازی مغز تصویربرداری رزونانس مغناطیسی عملکردی (سیگنال وابسته به سطح اکسیژن خون؛ BOLD) در پاسخ به یک محرک ارتعاشی. (iii) شکل پذیری ساختاری مغز ماده خاکستری و سفید را بررسی کرد. و (IV) اقدامات بازیابی حسی مرتبط با تغییرات ماده خاکستری در قطع عصب محیطی و بیماران ترمیم جراحی. در مقایسه با عصب کنترل ضایعه سالم هر بیمار، اعصاب قطع شده 1.5 سال پس از قطع و ترمیم، هدایت عصبی را مختل کرده و با کاهش دامنه و افزایش تاخیر انجام می شود. در مقایسه با افراد سالم، بیماران قطع عصب محیطی و ترمیم جراحی، فعالیت سیگنال وابسته به سطح اکسیژن خون را در قشرهای حسی سوماتوسیونی اولیه و ثانویه مقابل ضایعه، و در مجموعهای از نواحی مغز به نام «شبکه مثبت وظیفه» تغییر دادند. علاوه بر این، کاهش ماده خاکستری در چندین نواحی مغز، از جمله قشر حسی سوماتوسیونی اولیه و ثانویه contralesional، در همان مناطقی که کاهش سیگنال وابسته به سطح اکسیژن خون شناسایی شد، شناسایی شد. علاوه بر این، نازک شدن ماده خاکستری در شکنج پس مرکزی با اقدامات بازیابی حسی (تشخیص مکانیکی و ارتعاش) ارتباط منفی داشت که نشان دهنده ارتباط واضحی بین عملکرد و ساختار است. در نهایت، ما ناهمسانگردی کسری ماده سفید کاهش یافته را در جزیره سمت راست در منطقه ای شناسایی کردیم که همچنین کاهش ماده خاکستری را نشان داد. این نتایج بینشی در مورد انعطاف پذیری مغز و روابط ساختار-عملکرد-رفتار به دنبال آسیب عصبی ارائه می دهد و پیامدهای درمانی مهمی دارد.
کلید واژه ها: ضخامت قشر؛ fMRI؛ تصویربرداری تانسور انتشار پلاستیک آسیب عصبی محیطی
اختصارات: BA = منطقه بردهمن؛ BOLD = وابسته به سطح اکسیژن خون؛ fMRI = تصویربرداری رزونانس مغناطیسی کارآمد؛
PNIr = ترشح عصب محیطی و تعمیر جراحی؛ S1 = قشر اسموتیسوزوری اولیه؛ S2 = قشر ثانويه سوماتسنسور
فهرست
معرفی
به دنبال قطع عصب محیطی اندام فوقانی و ترمیم جراحی (PNIr)، 25% از بیماران 1.5 سال پس از جراحی به سر کار بازنگشته اند (Jaquet et al., 2001). علاوه بر این، 57% از بیماران مبتلا به آسیب های عصبی بین 16 تا 35 سال سن دارند (McAllister et al., 1996). بنابراین، یک عمر طولانی ناتوانی و مشکلات اقتصادی ممکن است با قطع عصب اندام فوقانی همراه باشد. درک پیامدهای مرکزی و محیطی آسیب عصب محیطی ممکن است توسعه استراتژی های درمانی جدید و برنامه های مداخله ای را تسهیل کند.
معلوم نیست چگونه مغز به PNIr در انسان پاسخ می دهد. با این حال، مطالعات حیوانی نشان داده است که پلاستیک در داخل قشر Somatosensory بلافاصله پس از عبور از عصب محیطی شروع می شود و 1 سال پس از تکمیل عصب کامل و تعمیر جراحی، نقشه های قشر حاوی تکه تکه، بازپرداخت های غیر پیوسته اعصاب منتقل و مجاور (Wall et al .، 1986). مکانیسم هایی که باعث ارتقاء قابلیت پذیری عملکرد می شوند شامل تصحیح فوری پیش بینی های قبلی از سطوح مجاور سطح قشر و زیرکوریتی و زوال بلند مدت آکسون در سطوح مختلف نوروآلیس، از جمله قشر Somomatosensory cortex (S1) (فلورانس و کاس ، 1995؛ Hickmott و Steen، 2005).
مطالعات تصویربرداری مغز انسان، یافته های مدل های حیوانی را با شناسایی نقشه های فعال سازی MRI عملکرد ناشی از آسیب نخاعی، قطع عضو، انتقال انگشت به انگشت شست و همچنین در بیماران مبتلا به سندرم تونل آپاندیس تأیید کرده است (Lotze et al.، 2001؛ Manduch و همکاران، 2002؛ Jurkiewicz و همکاران، 2006؛ Napadow و همکاران، 2006). علاوه بر این، مطالعات MRI ساختاری به تازگی تغییرات خاکستری و سفید پس از آسیب های آسیب دیده و در شرایط مختلف پاتولوژیک، از جمله قطع عضو و درد مزمن را تجسم می کند (Apkarian et al.، 2004؛ Draganski et al.، 2006؛ Davis et al.، 2008؛ Geha و همکاران، 2008؛ May، 2008). تصور می شود که تغییرات خاکستری به تغییرات در اندازه سلول، آتروفی و / یا از دست دادن نورون ها و یا گلایا مربوط می شود، در حالی که تغییرات ماده سفید بوسیله زخم آکسون و از دست دادن میلین (Beaulieu، 2002، May، 2008) تاثیر می گذارد.
یک رویکرد قدرتمند برای تعیین مکانیزم های آسیب شناسی و پلاستیک، این است که ترکیبی از تکنیک های تصویربرداری با عملکرد و ساختاری خاکستری و سفید باشد. ما قبلا گزارش دادیم که بیماران مبتلا به کامل اندام فوقانی PNIr، نقص انسوزانسزی عمیق را حفظ می کنند که 41.5 سال پس از جراحی را حفظ می کنند (تیلور و همکاران، 2008a). بر اساس این یافته ها، ما معتقد بودیم که این بیماران تغییرات مغزی و عملکرد مغزی در مغز اصلی مغز سو مغز را نشان می دهند. بنابراين، در اين مطالعه فرض شده است كه بيماران PNIr داراي: (i) واكنش وابسته به سطح اكسيژن خون (BOLD) را به تحريك ارتعاشي عصب انتقالي در منطقه S1 كه نشان دهنده اندام فوقاني زخمي است و در ثانيه قشر سومیوسنسورس (S2)؛ (2) کاهش مربوط به ضخامت قشر در این مناطق S1 و S2 contralesional؛ (iii) همبستگی بین تغییرات در ضخامت قشر و اندازه گیری روانشناختی عملکرد somatosensory (لرزش و لمس تشخیص) و (iv) کاهش انجماد قطعی (اندازه گیری جامعیت ماده سفید) در تغذیه ماده سفید به داخل / خارج از این مناطق قشر Somatosensory.
مواد و روش ها
موضوعات
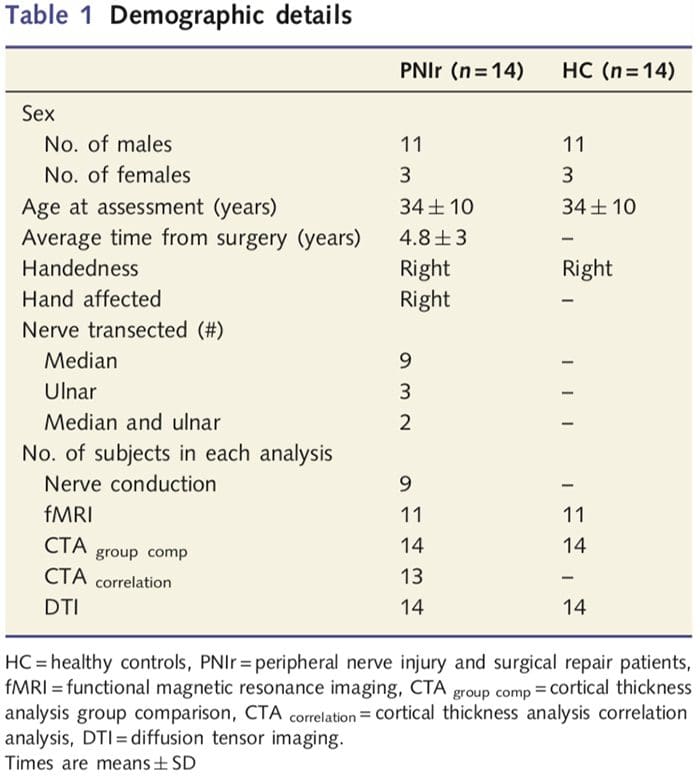
ما 27 بیمار را با قطع کامل عصب مدیان و/یا اولنار و به دنبال آن ترمیم جراحی توسط جراحان پلاستیک وابسته به برنامه دست دانشگاه تورنتو بین ژوئن 2006 تا مه 2008 انتخاب کردیم. از این گروه بزرگتر، 14 بیمار بدون درد (سه زن) ، 11 مرد؛ 34 تا 10 سال) با قطع کامل عصب مدیان راست و/یا اولنار در مطالعه وارد شدند [برای جلوگیری از آشفتگی های مربوط به وجود درد و جانبی بیماران با درد (6=n) و ضایعات سمت چپ. (n=7) از این تحلیل حذف شدند]. همه بیماران حداقل 1.5 سال قبل از ثبت نام در مطالعه تحت ترمیم عصب میکروسکوپی قرار گرفتند (زمان بهبودی بین 1.5 تا 8 سال متغیر بود). علاوه بر این، ما 14 گروه کنترل سالم همسان با سن و جنس را انتخاب کردیم (3 زن، 11 مرد؛ 34 تا 10 سال). همه آزمودنیها رضایت کتبی آگاهانه خود را با روشهای تایید شده توسط هیئت اخلاق پژوهشی شبکه بهداشت دانشگاه اعلام کردند. همه آزمودنی ها راست دست بودند (با استفاده از پرسشنامه دستی ادینبورگ: اولدفیلد، 1971 مشخص شد) و هیچ سابقه آسیب عصبی یا درد مزمن (چه قبل یا بعد از قطع عصب) نداشتند. برای جزئیات دموگرافیک جدول 1 را ببینید.
طراحی مطالعه
همه افراد در یک جلسه تصویربرداری شرکت کردند که عبارت بودند از: (i) تصویربرداری رزونانس مغناطیسی عملکردی (fMRI) در پاسخ به محرکهای vibrotactile اعمال شده به انگشت اشاره راست (در محدوده عصبی مدیا)؛ (2) اسکن مغز استخوان با وضوح بالا کل مغز، برای ثبت نام تصویر و برای تجزیه و تحلیل ماده خاکستری قهوه ای؛ و (iii) دو تصویربرداری از تانسور انتشار برای ارزیابی جامعیت ماده سفید. قبل از تصویربرداری، افراد در طراحی پایه آزمایش تجدیدنظر شدند و یادآور شدیم که در طول مدت اسکن، باقی مانده باشد.
افراد در هر زمان می توانند از مطالعه خارج شوند. علاوه بر این، ارزیابی حسی و حرکتی برای همه افراد انجام شد (تیلور و همکاران، 2008a). همانطور که آستانه تشخیص لمس و ارتعاش با ضخامت قشر ارتباط دارد، توصیف این روش ها در زیر آورده شده است (سایر اقدامات روان شناختی در سایر نقاط گزارش می شود).
آستانه ارتعاش
آستانه تشخیص لرزش با استفاده از یک بیو تیزومتر دست (Bio-Medical Instrument Company، USA) تعیین شد. دستگاه دارای یک پروب 12-mm است که روی فالانگز دایستی انگشت اشاره راست (D2) گذاشته شده است. آستانه ها با استفاده از روش محدودیت ها تعیین شدند: دامنه (ولتاژ) به تدریج افزایش یافت، تا زمانی که موضوع نشان داد که آنها محرک را درک می کنند. آستانه های ارتعاشی سه بار به دست آمد و مقدار متوسط محاسبه شد. در حین آزمون آستانه ارتعاش، افراد به نوبه خود دستور چشمانشان را بستند و پشت دستشان را روی یک بالشتک حامی نگه داشتند.
آستانه تشخیص مکانیکی
آستانههای تشخیص مکانیکی با استفاده از مجموعه استاندارد شده از رشتههای فون فری (OptiHair2 Marstock Nervtest، آلمان) حاوی 12 رشته کالیبره شده با فاصله لگاریتمی که نیروهایی از 0.25-512 mN را وارد میکنند، تعیین شد. قطر سطح تماس همه 12 رشته ~ 0.4 میلی متر بود. کارآزماییها با چشمهای بسته و دستها روی یک بالشتک نرم انجام شد. کاوشگرها در یک سری صعودی اعمال شدند و آزمودنی ها باید هر بار که احساس می کردند کاوشگر نوک انگشت D2 سمت راست را لمس می کند، پاسخ دهند. این روند سه بار تکرار شد. نیروی فیلامنت که در حداقل دو مورد از سه آزمایش تشخیص داده شد، به عنوان آستانه تشخیص مکانیکی آن سوژه گزارش شد.
تست کنترل عصبی
بیماران در مطالعات دو طرفه هدایت عصبی حسی و حرکتی در کلینیک الکترومیوگرافی بیمارستان غربی تورنتو (EMG) شرکت کردند. برای هدایت عصب حرکتی، الکترود محرک در مچ دست و آرنج (به طور جداگانه) و الکترود ضبط روی abductor pollicis brevis، برای ارزیابی عصب میانی، یا abductor digiti minimi برای ارزیابی عصب اولنار قرار داده شد. برای آزمایش عصب حسی، الکترود ضبط در مچ دست و الکترود تحریک کننده در ارقام D2، D3 و D5 قرار داده شد. یک متخصص مغز و اعصاب ارشد و با تجربه از کلینیک EMG بیمارستان غربی تورنتو (دکتر پیتر اشبی) همه ارزیابیهای بالینی را برای تعیین اینکه کدام اعصاب پاسخهای طبیعی/غیر طبیعی نشان میدهند، مرور کرد. از آنجایی که مشخص شده است که اندازههای دامنه و زمان تأخیر به طور قابلتوجهی بین افراد مختلف متفاوت است (به دلیل عواملی مانند تراکم عصب، عمق عصب و ضخامت پوست هر فرد) (کیمورا، 2001) عصب بدون قطع هر بیمار به عنوان کنترل خود را برای مقایسه با مقادیر از سمت قطع شده است. در بیمارانی که پاسخهای هدایت عصبی قابل تشخیص داشتند، آزمونهای t زوجی برای ارزیابی تفاوت در اندازهگیریهای نهفتگی یا دامنه بین اعصاب قطعنشده و ضایعهنشده هر بیمار انجام شد.
پارامترهای تصویربرداری
داده های تصویربرداری مغز با استفاده از یک سیستم MRI 3T GE مجهز به یک سیم پیچ سر آرایه فازی هشت کانالی به دست آمد. آزمودنی ها در حالت خوابیده روی میز MRI قرار گرفتند و سر هر آزمودنی برای کاهش حرکت بالشتک زده شد. دادههای fMRI کل مغز با استفاده از تصویربرداری مسطح اکو (28 برش محوری، میدان دید (FOV) = 20×20 سانتیمتر، ماتریس 64×64، وکسلهای 3.125×3.125×4 میلیمتر، زمان اکو (TE) = 30 میلیثانیه، تکرار به دست آمد. زمان (TR) = 2000 میلی ثانیه). زمان اسکن 5 دقیقه و 8 ثانیه (154 فریم) بود. در طول اسکن، یک محرک ارتعاشی 12 هرتزی غیر دردناک با استفاده از دیافراگم های بالونی که توسط هوای فشرده هدایت می شود، روی فالانکس دیستال سمت راست D2 اعمال شد (دستگاه ساخته شده توسط دکتر کریستو پانتف؛ www.biomag.uni-muenster.de). محرک ها در بلوک های 10 ثانیه ای با 20 ثانیه استراحت، برای مجموع 10 بلوک تحریک و 10 بلوک استراحت تحویل داده شدند. 8 ثانیه اول (4 TRs) از داده های به دست آمده از هر اجرا دور انداخته شد تا تعادل سیگنال fMRI امکان پذیر شود. به آزمودنی ها آموزش داده شد که چشمان خود را در طول اسکن بسته نگه دارند و روی محرک ها تمرکز کنند. یک اسکن آناتومیک با وضوح بالا سه بعدی (3 بعدی) مغز (124 برش ساژیتال، FOV 24×24 سانتی متر، ماتریس 256×256، وکسل 1.5×0.94×0.94 میلی متر) با توالی echo gradient 1D با وزن T3 به دست آمد. (میانگین یک سیگنال، زاویه چرخش = 20؟ TE ?5 میلی ثانیه). علاوه بر این، دو اسکن تصویربرداری تانسور انتشار (38 برش محوری، FOV 24×24 سانتی متر، ماتریس 128×128، وکسل 1.875×1.875×3 میلیمتر) در امتداد 23 جهت با مقدار b برابر با 1000 میلیمتر مربع به دست آمد. هر اجرا همچنین شامل دو جلد بدون وزن انتشار بود.
تجزیه و تحلیل fMRI
داده ها با استفاده از Brainvoyager QX v1.8 (Brain Innovaton، Maastricht، Netherlands) مورد تجزیه و تحلیل قرار گرفتند. پیش پردازش شامل: اصلاح حرکت 3D، تصحیح زمان بارگذاری اسکن، برش خطی خطی، فیلتراسیون با عبور بالا (پنج سیکل در هر اجرا) و هموار سازی فضایی با عرض کامل 6mm در نیمی از حداکثر (FWHM) هسته گاوس. مجموعه داده های fMRI به Voxels mm 3 x 3 x 3 درج شد، که به تصویر تصویری با وضوح بالا ثبت شد، و به فضای Talairach استاندارد (Talairach و Tournoux، 1988) عادی شده است. Voxels به عنوان 1 x 1 x 1 mm گزارش شده است. داده ها با استفاده از مدل خطی کلی تحلیل شدند. این مدل بوسیله چرخاندن عملکرد صندوقچه دوره زمان تحریک لمسی با عملکرد پاسخ همودینامیک استاندارد بدست آمد. برای شناسایی بین تفاوت های گروهی در الگوهای فعال سازی یک تحلیل اثرات ثابت با کنتراست انجام شد: (i) کنترل های سالم: تحریک 4 استراحت؛ (ii) PNIr: تحریک 4 استراحت؛ و (iii) کنترل سالم 4 PNIr. نقشه های فعال سازی در یک مقدار اصلاح شده P50.05 (حاصل از یک Voxels متوالی پیغام P50.0001 و 120mm3 اصلاح شده که قبلا گزارش شده است: تیلور و دیویس، 2009)؛ این نیز با اجرای یک شبیه سازی مونت کارلو با استفاده از نرم افزار AlphaSim که در تجزیه و تحلیل نرم افزار Neuroimage Functional (AFNI) اجرا شده است، تأیید شد. این تجزیه و تحلیل تنها شامل بیماران 11 بود که پیوند عصب مدیا راست (n = 9) یا عصب مدیا و النار راست (n = 2) را حفظ کرد (یعنی سه بیمار با یک جراحی راست خلفی عصب اولنار در این تحلیل گنجانده نشد )
تجزیه ضخامت قشر
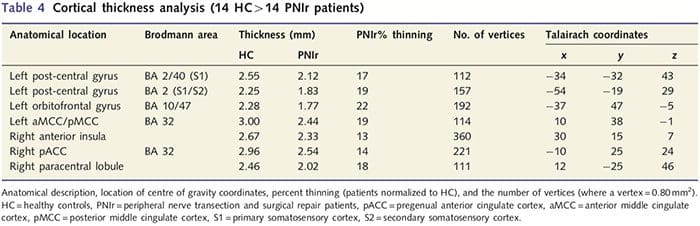
تجزیه و تحلیل ضخامت قشر با استفاده از Freesurfer (http:// surfer.nmr.mgh.harvard.edu) انجام شد. روشها در جاهای دیگر به تفصیل بیان شده است (دیل و همکاران، 1999؛ فیشل و همکاران، 1999a، b؛ فیشل و دیل 2000). به طور خلاصه، مجموعه داده های تشریحی با وضوح بالا T1 در اطلس Talairach ثبت شد (Talairach and Tournoux, 1988). این امر با عادی سازی شدت، جداسازی جمجمه و جداسازی نیمکره ها دنبال شد. متعاقباً، مرزهای ماده سفید/خاکستری (به نام سطح سفید) و خاکستری/CSF (به نام سطح پیال) شناسایی و تقسیم شدند. سپس فاصله بین سطوح سفید و پیال در هر نقطه در هر نیمکره مغز محاسبه شد. برای شناسایی تفاوتهای گروهی بین 14 بیمار و 14 گروه کنترل همسان سن/جنس، یک تحلیل مدل خطی کلی در هر نقطه از مغز انجام شد. از آنجایی که توپوگرافی قشری فرد ذاتاً ناهمگن است، قبل از تجزیه و تحلیل آماری از یک هسته صاف کننده فضایی 5 میلی متری FWHM استفاده شد. داده ها در P50.05 تصحیح شده نمایش داده می شوند (مشتق شده از P50.0075 اصلاح نشده و 102 راس پیوسته). این با اجرای شبیه سازی مونت کارلو با AlphaSim محاسبه شد. یک راس نشان دهنده یک نقطه روی یک صفحه دو بعدی است و در این مطالعه، فاصله بین دو راس 0.80mm2 است.
از آنجایی که بیماران نقص قابل توجهی در عملکرد حسی تنی در قلمرو عصب قطع شده نشان دادند، ما فرض کردیم که اندازهگیریهای عملکرد حسی تنی (تشخیص ارتعاش و لمس) با ضخامت قشر در شکنج بعد مرکزی contralesional (قشر حسی سوماتوسکوپی اولیه و ثانویه) مرتبط است. بنابراین، ما تجزیه و تحلیل همبستگی را در گروه بیمار بین انجام دادیم: (من) ضخامت قشر مغز و آستانه تشخیص ارتعاش. و (ب) ضخامت قشر و آستانه تشخیص لمسی. یک بیمار ارزیابی روانی کامل را انجام نداد. بنابراین، این تجزیه و تحلیل شامل 13 بیمار PNIr بود. علاوه بر این، برای تعیین اینکه آیا رابطه ای بین ضخامت قشر و زمان بهبودی وجود دارد یا خیر، تجزیه و تحلیل همبستگی بین این دو اندازه گیری نیز انجام شد. این تجزیه و تحلیل های همبستگی با گنجاندن یک ماسک (برگرفته از Freesurfer ساخته شده در اطلس) در مدل خطی عمومی، به شکنج پس مرکزی contralesional محدود شد. یک شبیهسازی مونت کارلو انجام شد که به تعداد رئوس در شکنج پس مرکزی contralesional محدود شد. تصاویر با P50.05 تصحیح شده (برگرفته از P50.0075 تصحیح نشده و 68 راس پیوسته) نمایش داده می شوند.
تجزیه و تحلیل تصویر تانسور نفوذ
پردازش تصویر تانسور انتشار با DTiStudio (www.MriStudio.org) و FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/) انجام شد. تصاویر ابتدا با ابزار ثبت خودکار تصویر پیاده سازی شده در DTiStudio، با استفاده از اولین تصویر B0 در سری اول که به عنوان الگو به دست آمده بود، مجدداً تراز شدند. این فرآیند حرکت سوژه و اعوجاج جریان گردابی را تصحیح می کند. سپس تمام تصاویر به صورت بصری برای ارزیابی کیفیت تصویر و تراز تانسورهای انتشار مجزای تصویربرداری بررسی شدند. اگر یک مصنوع شناسایی شد، برش قبل از محاسبه میانگین دو دوره تصویربرداری تانسور انتشار جداگانه برداشته شد. نقشه های FA فردی با استفاده از ابزار DTIFIT پیاده سازی شده در FSL محاسبه شد. تجزیه و تحلیل آماری وکسل عاقلانه برای شناسایی تفاوتهای گروهی در میانگین ناهمسانگردی کسری با استفاده از آمار فضایی مبتنی بر مسیر انجام شد. برای توصیف کامل این روش ها به اسمیت و همکاران مراجعه کنید. (2006). به طور خلاصه، تصاویر به صورت غیر خطی در یک تصویر هدف (MNI152) ثبت شدند، سپس تصویر میانگین از تمام مجموعههای داده ایجاد شد و این تصویر متعاقباً نازک شد تا تمام بخشهایی را که برای همه افراد مشترک بود نشان دهد. سپس بالاترین مقادیر ناهمسانگردی کسری هر آزمودنی با جستجو در ماده سفید عمود بر هر نقطه از اسکلت ماده سفید بر روی اسکلت نمایش داده شد. سپس یک تجزیه و تحلیل آماری وکسل کل مغز بین گروه ها (14PNIr و 14 کنترل سالم) انجام شد و تصاویر کل مغز در P50.05 تصحیح شدند. علاوه بر این، تجزیه و تحلیل منطقه مورد علاقه در ماده سفید انجام شد تراکتها در کنار مجاور S1، تالاموس و انسولین قدامی و خلفی دو طرف قرار دارد. این مناطق به عنوان آنها قبلا در جنبه های سوماتوزسنجی انتخاب شده اند و انتخاب شده اند زیرا آنها با مناطقی که در تجزیه و تحلیل گروه های FMRI و تجزیه ضخامت قشر (CTA) شناخته شده بودند، مطابقت دارد. مناطق مورد علاقه بر روی اسکلت ماده سفید به شرح زیر است: (i) منطقه متقابل S1 متمرکز در اتصال بین اسکلت ماده سفید از corona-radiata و تغذیه بخش اسکلت به gyrus مرکزی مرکزی؛ پایان دادن به انتهای دستگاه در یک برش داده شده.
در جهت z منطقه مورد نظر از z=49 به 57 گسترش یافت. دستگاه های ماده سفید که ناحیه دست را تامین می کند. (ii) ناحیه طرف مقابل مورد علاقه تالاموس به مسیرهای ماده سفید اطراف هستههای تالاموس خلفی و میانی (هستههای درگیر در عملکرد حسی تنی) محدود میشود که از z = 1 تا 4 گسترش مییابد. ماده سفید در مجاورت اینسولای قدامی و خلفی بر اساس معیارهایی که قبلاً توسط آزمایشگاه ما منتشر شده بود (تیلور و همکاران، 2008b). ناحیه مورد نظر از z = 2 تا 8 گسترش یافت. مقادیر ناهمسانگردی کسری از هر یک از این مناطق مورد علاقه استخراج شد و یک تحلیل واریانس چند متغیره (MANOVA) با استفاده از بسته آماری برای علوم اجتماعی نسخه 13.0 (SPSS Inc. شیکاگو)، که شامل مقادیر ناهمسانگردی کسری برای هر شش منطقه مورد نظر بود.
نتایج
جدول 1 جزئیات جمعیت شناختی را برای شرکت کنندگان در مطالعه ارائه می دهد. تمام 14 بیمار، حداقل 1.5 سال قبل از ثبت نام در مطالعه، یک قطع کامل عصب مدیان و/یا اولنار سمت راست و به دنبال آن ترمیم میکروسکوپی را انجام دادند. زمان از جراحی تا آزمایش بین 1.5 تا 8 سال با میانگین (?SD) 4.8? 3 سال. بیماران و گروه شاهد این کار را نکردند (34 سال و 10 سال هر دو گروه؛ t = 0.04؛ P = 0.97).
روانشناسی
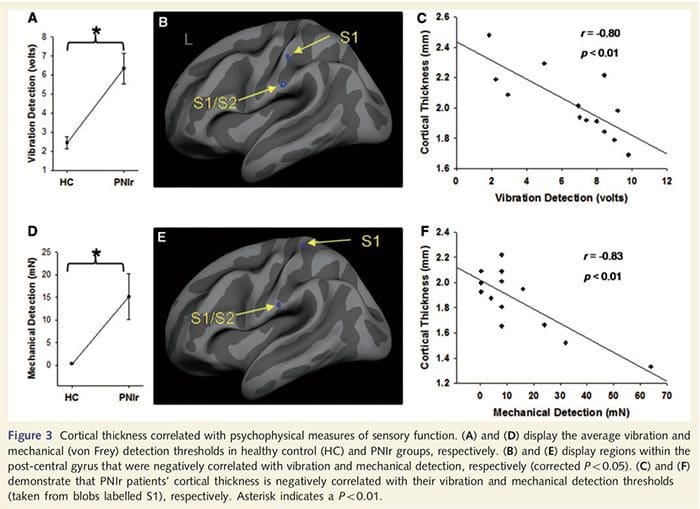
آستانه های ارتعاش از هر سه اندازه گیری محاسبه شده است؛ از آنجایی که تجزیه و تحلیل واریانس یک طرفه (ANOVA) نشان می دهد تفاوت معنی داری بین سه آزمایش [F (25، 1) = 0.227، P = 0.64 وجود ندارد. در مقایسه با کنترل های سالم، بیماران PNIr به طور قابل ملاحظهای از نظر ارتعاش و تشخیص مکانیکی (vibration: t = 4.77، P50.001، شکل 3A، مکانیکی: t = 3.10، P = 0.005، شکل 3D) اختلال ایجاد کردند.
تست کنترل عصبی
اندازهگیریهای دامنه و تأخیر بهدستآمده از اعصاب ضد ضایعه هر بیمار توسط یک متخصص مغز و اعصاب مجرب در کلینیک EMG بیمارستان غربی تورنتو بهعنوان طبیعی طبقهبندی شد. 14 نفر از 2 بیمار آزمایش هدایت عصبی را تکمیل کردند. جدول 2 میانگین افزایش/کاهش تاخیر و داده های دامنه را برای هدایت عصبی حسی از مچ به عضلات ابدکتور پولیسیس برویس (میان) یا ابدکتور انگشتی کوچک (اولنار) و برای هدایت حسی از مچ به D5 (میانگین) و DXNUMX نشان می دهد. اولنار) در مقایسه با هر بیمار عصب ضد ضایعه آسیب ندیده. از XNUMX بیمار، XNUMX بیمار دارای انقطاع هایی بودند که شامل عصب مدیان نیز می شد. از این هفت بیمار، یک بیمار هیچ پاسخ قابل تشخیصی در طول تست حرکتی و بیمار دیگر هیچ پاسخ قابل تشخیصی در طول تست حسی نداشت.
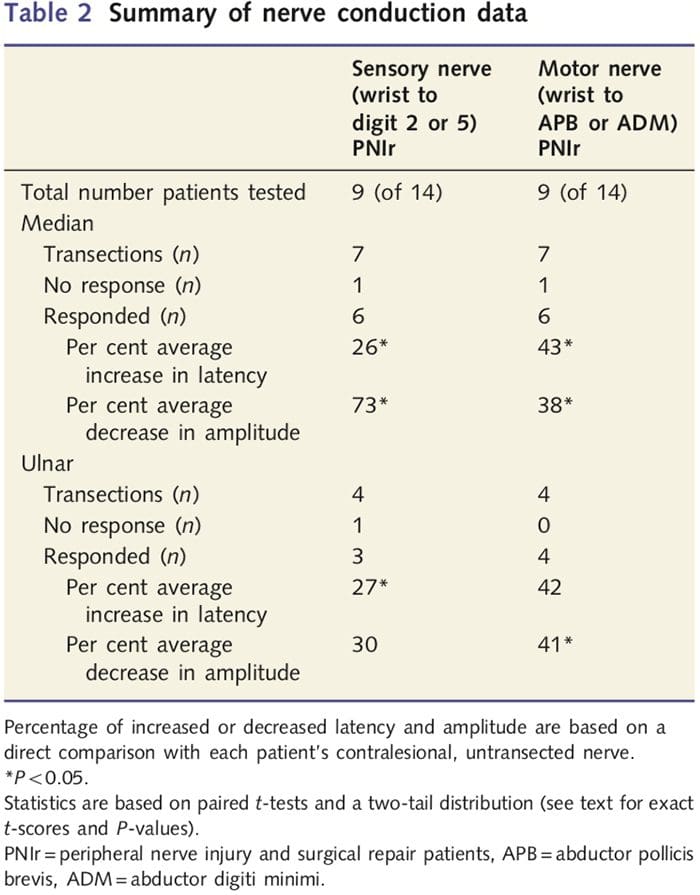 در شش بیمار با پاسخهای قابل تشخیص، تأخیر هدایت حرکتی تا 43 درصد افزایش یافت (t=6.2؛ P=0.002) و دامنهها تا 38 درصد کاهش یافت (t=£2.6؛ 0.045=P) با قطع عصب هر بیمار. در مقایسه با سمت غیر آسیب دیده آنها. رسانایی حسی در اعصاب مدیان همچنین افزایش 26 درصدی در زمان تاخیر (t=3.9؛ P=0.011) و کاهش 73 درصدی دامنه (t=£8.0؛ P=0.000) را در مقایسه با اعصاب ضد ضایعه طبیعی نشان داد. در چهار بیمار با قطع عصب اولنار، یک بیمار هیچ پاسخ قابل تشخیصی در طول آزمایش عصب حسی نداشت. در آن بیماران با پاسخ، نهفتگی حرکتی عصب اولنار به طور قابل توجهی بالا نبود (T = 2.8؛ P = 0.070). با این حال، دامنه به طور قابل توجهی بود
در شش بیمار با پاسخهای قابل تشخیص، تأخیر هدایت حرکتی تا 43 درصد افزایش یافت (t=6.2؛ P=0.002) و دامنهها تا 38 درصد کاهش یافت (t=£2.6؛ 0.045=P) با قطع عصب هر بیمار. در مقایسه با سمت غیر آسیب دیده آنها. رسانایی حسی در اعصاب مدیان همچنین افزایش 26 درصدی در زمان تاخیر (t=3.9؛ P=0.011) و کاهش 73 درصدی دامنه (t=£8.0؛ P=0.000) را در مقایسه با اعصاب ضد ضایعه طبیعی نشان داد. در چهار بیمار با قطع عصب اولنار، یک بیمار هیچ پاسخ قابل تشخیصی در طول آزمایش عصب حسی نداشت. در آن بیماران با پاسخ، نهفتگی حرکتی عصب اولنار به طور قابل توجهی بالا نبود (T = 2.8؛ P = 0.070). با این حال، دامنه به طور قابل توجهی بود
41٪ کاهش یافت (t = £ 5.9؛ P = 0.010). تست حسی عصب اولنار افزایش 27 درصدی در زمان تاخیر را نشان داد (t = 4.3؛ 0.049 = P) اما افزایش قابل توجهی در دامنه (t = 3.5؛ P = 0.072) نداشت.
پلاستیسیته عملکردی در قشر ساکتوسنسوری اولیه
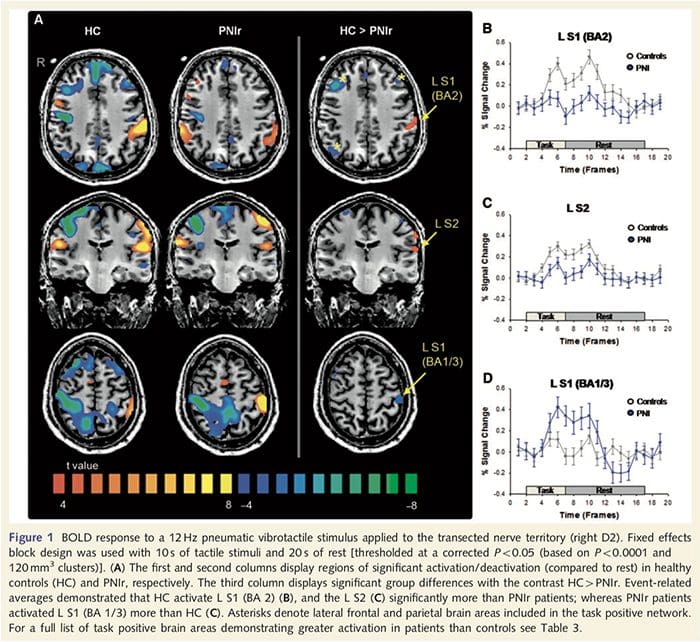
نقشه های MRI عملکردی از 11 بیمار PNIr با قطع عصب مدیان راست (بیماران با برش عصب اولنار از این تجزیه و تحلیل حذف شدند) و 11 فرد سالم همسان با سن و جنس محاسبه شد. از شکل 1A، واضح است که بیماران PNIr در مقایسه با افراد سالم، در ناحیه ای از S1 مربوط به ناحیه برودمن 2 (BA2) (تالایراچ و تورنو، 1988) و S2 (برای جزئیات به جدول 3 مراجعه کنید) به طور قابل توجهی کمتر فعال می شوند. . متوسط پاسخهای مرتبط با رویداد از این مناطق مورد علاقه، پاسخ ضعیف BOLD را در بیماران BA2 چپ و S2 چپ برجسته میکند (به ترتیب شکل 1B و C). عجیب است که تحریک ارتعاشی در بیماران بخش برتر شکنج پس مرکزی را فعال می کند (احتمالاً BA1/3) (Talairach and Tournoux, 1988) (شکل 1A و جدول 3). یک میانگین مربوط به رویداد (شکل 1D) نشان میدهد که کنترلهای سالم حداقل فعالسازی را در این ناحیه داشتند. علاوه بر این، بیماران به طور قابل توجهی فعالیت بیشتری در مناطق مغز داشتند که در مجموع به عنوان شبکه مثبت وظیفه شناخته میشوند (ستارهها در شکل 1). جدول 3 را برای لیست کامل نواحی مثبت مغز فعال شده ببینید. این شبکه شامل قشر گیجگاهی جانبی پره فرونتال، جداری جانبی، پیش حرکتی و تحتانی است (جدول 3): نواحی مغزی که در حین انجام یک کار نیازمند توجه فعال می شوند و در هنگام استراحت یا کارهایی که از نظر شناختی یا توجه چالش برانگیز نیستند سرکوب یا غیرفعال می شوند (Fox et al. همکاران، 2005؛ DeLuca و همکاران، 2006؛ Seminowicz و Davis 2007).
ماده خاکستری کاهش یافته در قشر Somatosensory اولیه مرتبط با بازیابی حسی است
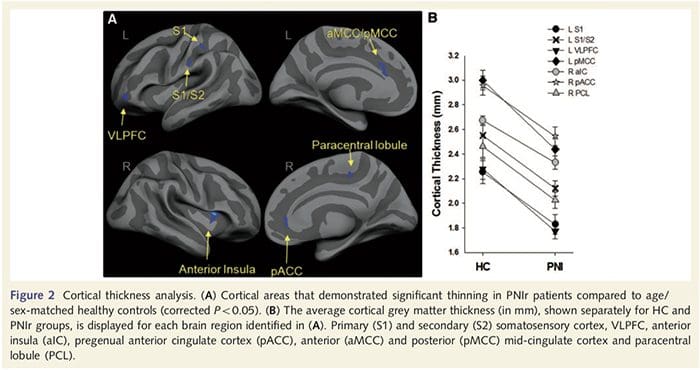
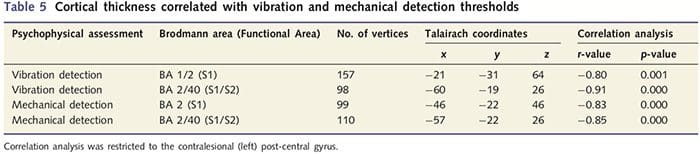
تجزیه و تحلیل ضخامت قشر در تمام 14 بیمار و 14 گروه کنترل سالم همسان با سن/جنس، چندین جایگاه نازک شدن قشر چشم را در گروه PNIr نشان داد (شکل 2 و جدول 4). به طور خاص، بیماران 13% تا 22% کاهش ضخامت قشر مغزی در S1، S2 چپ (contralesional)، شکنج سینگولات قدامی پیش از جنس، قشر جلوی پیشانی بطنی جانبی و اینسولا قدامی راست، شکنج سینگولات میانی قدامی/خلفی و لوبول پارا مرکزی داشتند. جالب توجه است، مکان های نازک شدن ماده خاکستری در شکنج پس مرکزی با مناطق کاهش یافته BOLD به دنبال تحریک ارتعاشی (جدول 4) منطبق است. از آنجایی که ما اطلاعات قبلی در مورد نقص حسی و زمان بهبودی بیماران (یعنی زمان پس از ترمیم میکروسکوپی) داشتیم، سپس پرسیدیم که آیا ضخامت قشر بیماران در شکنج پس مرکزی با آستانههای مکانیکی حسی و تشخیص ارتعاش آنها مرتبط است یا با آنها. زمان بهبودی این تجزیه و تحلیل ها یک همبستگی منفی بین ضخامت قشر و آستانه تشخیص ارتعاش را در منطقه ای شامل BA1/2 و S2 نشان داد (P50.001، r=?0.80 و ?0.91، به ترتیب برای BA1/2 و S2؛ شکل 3 و جدول 5. ). علاوه بر این، آستانه تشخیص مکانیکی نیز با ضخامت قشر در یک ناحیه BA2 کمی برتر و همان ناحیه S2 همبستگی منفی داشت (P50.001، r = 0.83 و ?0.85، به ترتیب برای BA2 و S2؛ شکل 3 و جدول. 5). با این حال، ما رابطه معناداری بین زمان بهبودی و ضخامت قشر مغز شناسایی نکردیم. بنابراین، در شکنج بعد از مرکزی، نازک شدن قشر مغز با نقایص حسی شدیدتری همراه بود. با این حال، ما رابطه معناداری بین زمان بهبودی و ضخامت قشر مغز شناسایی نکردیم. مجدداً، بین نازک شدن قشر مغز در مناطقی که با محرکهای ارتعاشی همبستگی منفی داشت و مناطقی که ناهنجاریهای fMRI و CTA گروهی را نشان میدهند، مطابقت داشت.
اختلالات مواد سفید پس از انتقال عصبی
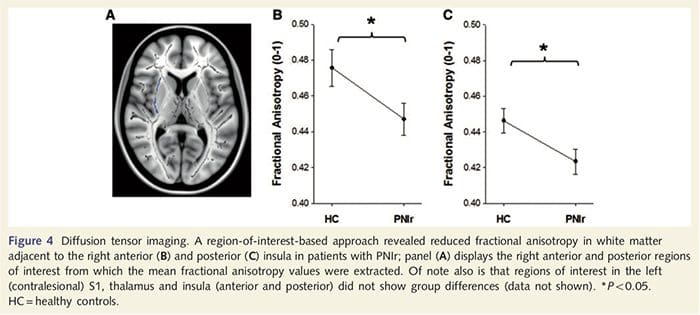
برای بررسی یکپارچگی ماده سفید، ما یک منطقه مورد علاقه را برای بررسی اختلاف گروهی ماده سفید بر اساس فرضیه های پیشینی استفاده کردیم. مناطق مورد علاقه محدود به مواد سفید سفید اطراف و تغذیه به S1 contralesional و تالاموس بود. علاوه بر این، ما همچنین مناطق مورد علاقه در ماده سفید در مجاورت با سمت چپ و راست، انسداد قدام و خلفی را جلب کردیم. این انسولا به عنوان آن در پردازش سموتوسنسوری انتخاب شده است و ما به عنوان ماده خاکستری در ناحیه قدام قدام راست با CTA کاهش یافته است. این روش منطقه مورد توجه نشان داد که بیماران به طور معنی داری مقادیر آنزیمتروپوکی کسر ماده سفید (MANOVA شامل همه شش منطقه مورد علاقه) در سمت راست قدامی [F (1، 26) = 4.39، P = 0.046 را کاهش دادند؛ شکل 4A] و انسولین خلفی [F (1، 26) = 5.55، P = 0.026؛ شکل 4B] اما اختلاف گروهی در ماده سفید در مجاورت insula چپ (insula front of the left: P = 0.51؛ insula posterior posterior: P = 0.26)، تالاموس (P = 0.46) یا S1 (P = 0.46) )
 بحث
بحث
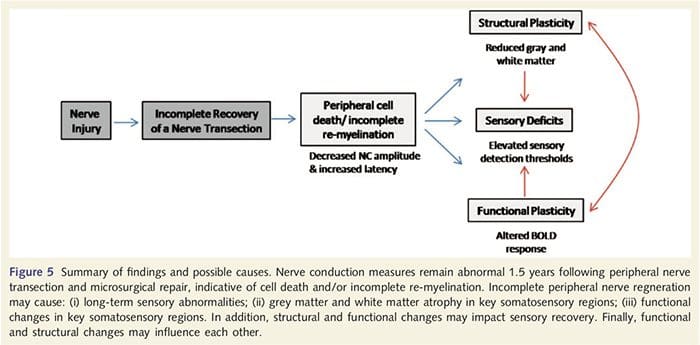
در اینجا ما برای اولین بار برای اولین بار نشان داده ایم که پلاستیکی کارکردی و اختلالات ساختاری هر دو خاکستری و سفید در چندین ناحیه قشر پس از ترشح عصب محیطی فوقانی و تعمیر جراحی وجود دارد. این پلاستیسیته ممکن است ناشی از بازسازی ناقص نواحی محیطی (مرگ سلولی محیطی و / یا ناقص مجدد پروستات) باشد، زیرا اندازه گیری های هدایت عصبی در این بیماران اختلالات شدید را نشان می دهد. علاوه بر این، داده های ما نشان می دهد که کاهش پاسخ های fMRI ناشی از ویبروتاکتیل در gyrus post-center مطابق با نشت خاکستری در گروه بیمار است. این نتایج نشان می دهد که کاهش پاسخ های BOLD ممکن است با کاهش ماده ی خاکستری قهوه ای و / یا کاهش ورودی عصبی به گوریوس پست مرکزی تسهیل شود. علاوه بر این، ضخامت قشر در همان قسمت هایی از gyrus post-central نیز منفی با اقدامات رفتاری عملکرد somatosensory است. بدین معنی که کمبود اسموتیسنسوری با قشر نازک ارتباط دارد؛ هر دوی این موارد ممکن است به ورودی وابسته باشد. در مجموع، داده های ما نشان می دهد که بازسازی ناقص نایاب محیطی باعث اختلالات سموتوسنسوری، آتروفی ماده خاکستری قهوه ای و کاهش فعال شدن fMRI می شود (برای خلاصه ای از این یافته ها، شکل 5 را ببینید).
به خوبی شناخته شده است که پلاستیک غضروفی پس از ترشح عصب محیطی و تعمیر جراحی می تواند در سراسر CNS در افراد غیر انسانی رخ دهد (Kaas، 1991). به نظر می رسد این پلاستیک ناشی از ناپیوسته سازی سیناپس ها یا سکانس های آکونال در ناحیه ای که در آن ناپدید شده است (Wall et al.، 1986، Florence and Kaas، 1995). در مدل پریمات، سال 1 پس از برداشتن عصب و تعمیر جراحی، قشر دونووریت با نمایندگی های ناقص و بی نظمی از اعصاب بازسازی شده و مجاور (دست نخورده) مشخص می شود. این نمایندگی پراکنده به بازسازی ناقص محیطی منجر شده است و منجر به بازسازی جزئی فضای قشر مستمر (Kaas، 1991) می شود. برای ارزیابی میزان تجدید محیطی در جمعیت بیمار ما مطالعات هدایت عصبی حسی و حرکتی را در منطقه انتقال داده شده انجام دادیم. نتایج هدایت عصب ما نشان می دهد که بیماران PNIr به طور معنی داری کاهش دامنه و افزایش تاخیر در اعصاب حسی و حرکتی را نسبت به طرف غیر منتقل شده خود دارند. دامنه کمتری همراه با افزایش تاخیر نشان دهنده از دست دادن فیبر محیطی (یعنی مرگ سلول) و / یا غیر مجاز یا ناقص مجدد میلینین پس از transection (Kimura، 1984) است. علاوه بر این، به خوبی ثابت شده است که بین 20٪ و 50٪ از نورونهای گانگلیونی ریشه پشت رنج می برند (Liss et al.، 1996). بنابراين، مرگ سلول های عصبی و بازتوزیع ناقص می تواند منجر به کاهش ورودی عصبی به قشر مغز شود، که ممکن است به دلیل نقص های حسی مداوم و کاهش پاسخ BOLD در BA2 و S2 باشد. علاوه بر این، این ورودی ضعیف شده نیز می تواند منجر به نازک شدن قشر در همان مناطق قشر مغز شود. محرومیت حسی نشان می دهد که دژنرسانس transnoronal در مناطق مختلف CNS، از جمله شاخ پشتی به دنبال بخش عصب سیاتیک (Knyihar-Csillik و همکاران، 1989)، و ممکن است شامل نورون های ثانویه و سوم (پائول و Erulkar، 1962). دژنرسانس Transnuronal توسط انقباض سلولی مشخص می شود و به نظر می رسد مربوط به کاهش یا غیر ورودی ورودی Afferent (Knyihar-Csillik و همکاران، 1989). بنابراین، از دست دادن ماده خاکستری قهوه ای (یا آتروفی) نیز می تواند به طور مستقیم با کاهش ورودی وابسته باشد.
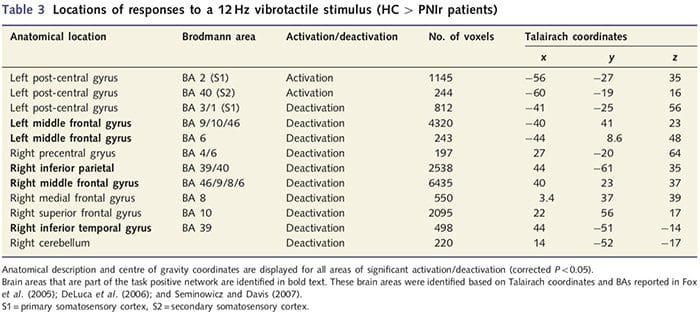
 ما همچنین افزایش فعال سازی در gyrus خلیج فارس را در منطقه منطبق با BA1 / 3 (Talairach و Tournoux، 1988) نشان دادیم. مطالعات الکتروفیزیولوژی، ردیابی آناتومیکی و مطالعات عصبی نشان داده اند که برای اکثر اعصاب مکانیکی پوستی، اولین کانون های قارچی BA1 و BA3b هستند. این مناطق مغزی سیتوارتیستکتونی هر کدام دارای یک نقشه بدن سومیوتوپوت با زمینه های گیرنده کوچک است. علاوه بر این، این مناطق به بسیاری از ویژگی های اطلاعات لمسی مانند بافت و زبری، سرعت و انحنای محرک ها پاسخ می دهد (Bodegard et al.، 2001). مطالعات fMRI نشان داده است که فعالیت درون قشر Somatosensory تحت تأثیر توجه قرار گرفته است، به طوری که پاسخ های fMRI به محرک های لمسی در S1 افزایش می یابد زمانی که افراد به یک محرک لمسی مراجعه می کنند، اما زمانی که افراد در حال رد شدن هستند (Arthurs et al. 2004؛ Porro et al.، 2004). علاوه بر این، بیماران ما شبکه ای از زمینه های مغز را که به عنوان شبکه مثبت وظیفه شناخته می شوند (DeLuca et al.، 2006) شناخته شده تر از کنترل های سالم فعال کرده اند. این مناطق مغز در طول فرآیندهای اطلاعاتی مورد نیاز (فاکس و همکاران، 2005، Seminowicz و Davis، 2007) فعال می شوند. با هم، این یافته ها حاکی از این است که بیماران باید از محرک ها بیشتر از کنترل استفاده کنند زیرا باعث کاهش حساسیت آنها می شود. این افزایش توجه همچنین ممکن است باعث افزایش فعال شدن BA1 / 3b شود. البته، افزایش فعال سازی در BA1 / 3b همچنین ممکن است انعطاف پذیری را که به بار توجه توجه دارد، نشان دهد.
ما همچنین افزایش فعال سازی در gyrus خلیج فارس را در منطقه منطبق با BA1 / 3 (Talairach و Tournoux، 1988) نشان دادیم. مطالعات الکتروفیزیولوژی، ردیابی آناتومیکی و مطالعات عصبی نشان داده اند که برای اکثر اعصاب مکانیکی پوستی، اولین کانون های قارچی BA1 و BA3b هستند. این مناطق مغزی سیتوارتیستکتونی هر کدام دارای یک نقشه بدن سومیوتوپوت با زمینه های گیرنده کوچک است. علاوه بر این، این مناطق به بسیاری از ویژگی های اطلاعات لمسی مانند بافت و زبری، سرعت و انحنای محرک ها پاسخ می دهد (Bodegard et al.، 2001). مطالعات fMRI نشان داده است که فعالیت درون قشر Somatosensory تحت تأثیر توجه قرار گرفته است، به طوری که پاسخ های fMRI به محرک های لمسی در S1 افزایش می یابد زمانی که افراد به یک محرک لمسی مراجعه می کنند، اما زمانی که افراد در حال رد شدن هستند (Arthurs et al. 2004؛ Porro et al.، 2004). علاوه بر این، بیماران ما شبکه ای از زمینه های مغز را که به عنوان شبکه مثبت وظیفه شناخته می شوند (DeLuca et al.، 2006) شناخته شده تر از کنترل های سالم فعال کرده اند. این مناطق مغز در طول فرآیندهای اطلاعاتی مورد نیاز (فاکس و همکاران، 2005، Seminowicz و Davis، 2007) فعال می شوند. با هم، این یافته ها حاکی از این است که بیماران باید از محرک ها بیشتر از کنترل استفاده کنند زیرا باعث کاهش حساسیت آنها می شود. این افزایش توجه همچنین ممکن است باعث افزایش فعال شدن BA1 / 3b شود. البته، افزایش فعال سازی در BA1 / 3b همچنین ممکن است انعطاف پذیری را که به بار توجه توجه دارد، نشان دهد.
 BA2 و S2 هر دو پروسه هایی از BA1 / 3b و همچنین از قسمت های مجزا مجتمع تالامیک ventroposterior (Pons et al.، 1985، Friedman and Murray، 1986) دریافت می کنند. هر دوی اینها مغز نواحی دارای میدان های پذیرنده بزرگ و اغلب چند رقمی (BA2) یا دو طرفه (S2) هستند (Pons et al., 1985; Iwamura et al., 2002). بر اساس پیش بینی های آناتومیکی و ویژگی های پاسخ عصبی، پردازش سلسله مراتبی اطلاعات لمسی از BA1/3b تا BA2 نشان داده شده است (Kaas et al., 2002). علاوه بر این، مطالعات الکتروفیزیولوژیک در ماکاک ها (Pons et al., 1987) و داده های مغناطیسی مغزی به دست آمده در انسان، نشان می دهد که پردازش سریالی ورودی های لمسی از S1 تا S2 در پستانداران بالاتر انجام می شود (Frot and Mauguiere 1999; Disbrow et al. .، 2001). چندین مطالعه نشان دادهاند که BA2 ترجیحاً با شکل و انحنا فعال میشود (بودگارد و همکاران، 2001)، در حالی که S2 ممکن است در یادگیری لمسی نقش داشته باشد (ریدلی و اتلینگر 1976؛ موری و میشکین، 1984)، که از این تصور حمایت میکند که این نواحی مغز در پردازش حسی جسمی درجه بالاتری نقش دارند. ارزیابی روانی ما نشان داد که بیماران در تشخیص محرک های لمسی ساده و در آزمون شناسایی بافت شکل 1.5 سال پس از جراحی به طور قابل توجهی دچار اختلال می شوند (تیلور و همکاران، 2008a). این آزمایش دوم، توانایی بیمار را در تشخیص ویژگیهای یک شی در حالی که فعالانه یک شکل یا بافت را کاوش میکند، ارزیابی میکند، که نیاز به ادغام اطلاعات حسی در سراسر مناطق بدن دارد (رزن و لوندبورگ، 1998). روی هم رفته، یک تفسیر از دادههای ما این است که بیماران PNIr بیشتر به محرکهای ارتعاشی توجه میکنند، که منجر به افزایش فعالسازی شبکه مثبت وظیفه و BA1/3 میشود. با این حال، در این بیماران، دادههای ما نشان میدهد که نواحی پردازش مرتبه بالاتر، مانند BA2 و S2، اطلاعات لمسی را دریافت نمیکنند، که به نوبه خود ممکن است منجر به نازک شدن قشر مغز و کاهش پاسخهای BOLD شود.
BA2 و S2 هر دو پروسه هایی از BA1 / 3b و همچنین از قسمت های مجزا مجتمع تالامیک ventroposterior (Pons et al.، 1985، Friedman and Murray، 1986) دریافت می کنند. هر دوی اینها مغز نواحی دارای میدان های پذیرنده بزرگ و اغلب چند رقمی (BA2) یا دو طرفه (S2) هستند (Pons et al., 1985; Iwamura et al., 2002). بر اساس پیش بینی های آناتومیکی و ویژگی های پاسخ عصبی، پردازش سلسله مراتبی اطلاعات لمسی از BA1/3b تا BA2 نشان داده شده است (Kaas et al., 2002). علاوه بر این، مطالعات الکتروفیزیولوژیک در ماکاک ها (Pons et al., 1987) و داده های مغناطیسی مغزی به دست آمده در انسان، نشان می دهد که پردازش سریالی ورودی های لمسی از S1 تا S2 در پستانداران بالاتر انجام می شود (Frot and Mauguiere 1999; Disbrow et al. .، 2001). چندین مطالعه نشان دادهاند که BA2 ترجیحاً با شکل و انحنا فعال میشود (بودگارد و همکاران، 2001)، در حالی که S2 ممکن است در یادگیری لمسی نقش داشته باشد (ریدلی و اتلینگر 1976؛ موری و میشکین، 1984)، که از این تصور حمایت میکند که این نواحی مغز در پردازش حسی جسمی درجه بالاتری نقش دارند. ارزیابی روانی ما نشان داد که بیماران در تشخیص محرک های لمسی ساده و در آزمون شناسایی بافت شکل 1.5 سال پس از جراحی به طور قابل توجهی دچار اختلال می شوند (تیلور و همکاران، 2008a). این آزمایش دوم، توانایی بیمار را در تشخیص ویژگیهای یک شی در حالی که فعالانه یک شکل یا بافت را کاوش میکند، ارزیابی میکند، که نیاز به ادغام اطلاعات حسی در سراسر مناطق بدن دارد (رزن و لوندبورگ، 1998). روی هم رفته، یک تفسیر از دادههای ما این است که بیماران PNIr بیشتر به محرکهای ارتعاشی توجه میکنند، که منجر به افزایش فعالسازی شبکه مثبت وظیفه و BA1/3 میشود. با این حال، در این بیماران، دادههای ما نشان میدهد که نواحی پردازش مرتبه بالاتر، مانند BA2 و S2، اطلاعات لمسی را دریافت نمیکنند، که به نوبه خود ممکن است منجر به نازک شدن قشر مغز و کاهش پاسخهای BOLD شود.
تصور می شود که این جزء در ادغام اطلاعات چند منظوره مهم برای عملکرد های حساس حرکتی، عاطفی، آلوزاتیک / هوموتاتیستی و شناختی (Devinsky و همکاران، 1995، Critchley، 2004، کریگ، 2008) و یک قشر حسی لمبی (کریگ ، 2008). مطالعات متعددی در واکنش به تحریک لمسی با فعال سازی ناخن گزارش شده است (Gelnar et al.، 1998؛
Downar و همکاران، 2002) و مطالعات تشریحی ردیابی در پریماه نشان داد که اینولا به صورت متقابل به لبه های جلویی، لگن و تمپورال (آگوستین، 1996) متصل است. در بیماران ما، انسولین سمت راست قلب تنها ناحیه قشر بود که ضعف قهوه ای قابل توجهی را در مقایسه با مقادیر کمی آنزایرتروسی قطبی در ماده سفید سفید نشان داد، که نشان می دهد که نازک شدن قشر در این ناحیه با کاهش الیاف در حال رسیدن به یا از این ساختار انسولین راست قدامی در تعامل با آن درگیر است تا بتوان آن را با در نظر گرفتن انگیزشی، عاطفی و شرایط اجتماعی (شامل کریگ، 2008) به دست آوردن ورودی هومئوستاتیک از بدن. علاوه بر این، Critchley و همکاران. (2004) ارتباط بین توانایی های بین بافت و حجم ماده خاکستری حاملگی راست قدام را گزارش کرد. با توجه به یافته های ما این است که بیماران مواد خاکستری را در انسولین راست قدامی کاهش داده اند، مطالعه ای در آینده برای ارزیابی توانایی های بینابینی پس از آسیب عصبی محیطی خواهد بود.
برای اولین بار نشان داده شده است که تغییرات عملکردی و ساختاری در قشر مغزی انسان 1.5 سال پس از انتقال کامل عصب محیطی اندام فوقانی که میکروسکوژیک ترمیم می شود، نشان داده شده است. علاوه بر این، اندازه گیری های هدایت عصبی نشان دهنده بازسازی محیطی ناقص در این بیماران است. علاوه بر این، ما نشان می دهیم که ضخامت قشر مربوط به اندازه گیری های روان شناختی بهبودی است، در آن قشر نازک در BA2 و S2 با عملکرد بدنی کمتری همراه است. این داده ها نشان می دهد که بازسازی نقشه های فعال فعال سازی عملکرد به طور مستقیم با بازسازی موفقیت آمیز محیطی همراه است.
Keri S. Taylor، 1,2 Dimitri J. Anastakis2,3,4 و Karen D. Davis1,2,3
1 بخش مغز، تصویربرداری و رفتار � سیستم های عصب شناسی، موسسه تحقیقات غربی تورنتو، شبکه بهداشت دانشگاه، تورنتو، کانادا M5T258
موسسه علم پزشکی 2، دانشگاه تورنتو، کانادا
گروه جراحی 3، دانشگاه تورنتو، کانادا
مرکز تحقیقات بالینی 4، موسسه تحقیقات غربی تورنتو، شبکه بهداشت دانشگاه، تورنتو، کانادا M5T2S8
نامه به: کارن دی. دیویس، Ph.D.
بخش مغز، تصویربرداری و رفتار - علوم اعصاب سیستم ها، موسسه تحقیقات غربی تورنتو،
بیمارستان غرب تورنتو،
دانشگاه بهداشت دانشگاه
اتاق MP14-306، 399 Bathurst Street،
تورنتو، اونتاریو،
کانادا M5T 2S8
پست الکترونیک: kdavis@uhnres.utoronto.ca
سپاسگزاریها
نویسندگان از آقای جف پاپ، دکتر آدریان کراولی، آقای یوجین هلاس و آقای کیث تا برای کمک متخصص فنی تشکر می کنند. نویسندگان می خواهند از دکتر پیتر اشبی و آقای فردی پیز از کلینیک EMG بیمارستان غربی تورنتو تشکر کنند تا آزمایشات مربوط به هدایت عصب را انجام دهند و برای ارزیابی کارشناسان یافته ها. نویسندگان همچنین از خانم Dvali، Binhammer، Fialkov و Antonyshyn از همکاری با این پروژه تشکر می کنند. دکتر دیویس یک گروه تحقیقاتی کانادا در مغز و رفتار (CIHR MOP 53304) است.
بودجه
خدمات پزشکان گنجانده شده و کمک مالی مشترک از مرکز مطالعه درد دانشگاه تورنتو / AstraZeneca.
مواد تکمیلی
مواد اضافی در Brain آنلاین در دسترس است.
سفید
منابع:
Apkarian AV، Sosa Y، Sonty S، و همکاران. کمردرد مزمن با
کاهش تراکم ماده خاکستری پره پیشانی و تالاموس. J Neurosci
2004; 24: 10410.
آرتورز او جی، یوهانسن-برگ اچ، متیوز PM، Boniface SJ. توجه
به طور متفاوت جفت شدن fMRI BOLD و برانگیخته را تعدیل می کند
دامنه سیگنال بالقوه در قشر حسی تنی انسان 7.
Exp Brain Res 2004; 157: 269 74.
آگوستین جی آر. مدار و جنبه های عملکردی لوب جزیره ای
در پستانداران از جمله انسان Brain Res Brain Res Rev 1996; 22:
229.
Beaulieu C. اساس انتشار آب ناهمسانگرد در اعصاب
سیستم - بررسی فنی NMR Biomed 2002; 15: 435.
Bodegard A، Geyer S، Grefkes C، Zilles K، Roland PE. بر اساس سلسله مراتب
پردازش شکل لمسی در مغز انسان نورون 2001; 31:
317.
کریگ AD. درک درونی و احساسات: دیدگاه عصبی آناتومیک.
در: لوئیس ام، هاویلند جونز جی، بارت ال، ویراستاران. کتابچه راهنمای
احساسات. نیویورک: گیلدفورد پرس; 2008. ص. 272.
کریچلی HD. قشر انسان به یک چالش بینابینی پاسخ می دهد.
Proc Natl Acad Sci USA 2004; 101: 6333.
کریچلی اچدی، وینس اس، روتشتاین پی، اوهمان ای، دولان آر جی. سیستم های عصبی
حمایت از آگاهی بینابینی Nat Neurosci 2004; 7: 189:95.
دیل AM، فیشل بی، سرنو MI. تجزیه و تحلیل مبتنی بر سطح قشر مغز. I. تقسیم بندی
و بازسازی سطح Neuroimage 1999; 9: 179:94.
دیویس کی دی، پاپ جی، چن جی، کوان سیال، کرولی ای پی، دیامانت NE. قشری
نازک شدن در IBS: پیامدهایی برای هموستاتیک، توجه و درد
در حال پردازش. نورولوژی 2008; 70: 153.
DeLuca M، Beckmann CF، De SN، Matthews PM، Smith SM. fMRI در حال استراحت
شبکه های حالت حالت های متمایزی از تعاملات از راه دور را تعریف می کنند
در مغز انسان Neuroimage 2006; 29: 1359 67.
Devinsky O، Morrell MJ، Vogt BA. سهم سینگولیت قدامی
قشر به رفتار مغز 1995; 118 (بند 1): 279 306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Evidence for interhemispheric
پردازش ورودی ها از دست در S2 انسان
و PV. J Neurophysiol 2001; 85: 2236×44.
Downar J، Crawley AP، Mikulis DJ، Davis KD. یک شبکه قشری حساس
برای برجستگی محرک در یک زمینه رفتاری خنثی در چندین
روش های حسی J Neurophysiology 2002; 87: 615 20.
دراگانسکی بی، موزر تی، لومل ان، و همکاران. کاهش تالاموس خاکستری
ماده به دنبال قطع عضو Neuroimage 2006; 31: 951.
فیشل بی، دیل ام. اندازه گیری ضخامت قشر مغز انسان
از تصاویر تشدید مغناطیسی Proc Natl Acad Sci USA 2000; 97:
11050.
Fischl B، Sereno MI، Dale AM. تجزیه و تحلیل مبتنی بر سطح قشر مغز. II:
تورم، مسطح کردن، و یک سیستم مختصات مبتنی بر سطح.
Neuroimage 1999a; 9: 195 207.
Fischl B، Sereno MI، Tootell RB، Dale AM. بین موضوعی با وضوح بالا
میانگین گیری و یک سیستم مختصات برای سطح قشر مغز. هوم مغز
نقشه 1999b; 8: 272×84.
فلورانس اس ال، کاس جی اچ. سازماندهی مجدد در مقیاس بزرگ در سطوح مختلف
مسیر حسی تنی به دنبال قطع درمانی دست است
در میمون ها J Neurosci 1995; 15: 8083 95.
Fox MD، Snyder AZ، Vincent JL، Corbetta M، Van E، Raichle ME. در
مغز انسان ذاتاً به صورت پویا و ضد همبسته سازماندهی شده است
شبکه های عملکردی Proc Natl Acad Sci USA 2005; 102: 9673 9678.
فریدمن DP، موری EA. اتصال تالاموس دوم
ناحیه حسی تنی و میدان های حسی تنی مجاور
شیار جانبی ماکاک. J Comp Neurol 1986; 252: 348 73.
Frot M، Mauguiere F. زمان بندی و توزیع فضایی حسی تنی
پاسخ های ثبت شده در کرانه بالایی شکاف سیلوین (ناحیه SII) در
انسان. Cereb Cortex 1999; 9: 854 63.
Geha PY، Baliki MN، Harden RN، Bauer WR، Parrish TB، Apkarian AV.
مغز در درد مزمن CRPS: ماده خاکستری-سفید غیر طبیعی
تعاملات در مناطق احساسی و خودمختار. نورون 2008; 60:
570.
Gelnar PA، Krauss BR، Szeverenyi NM، Apkarian AV. نمایش نوک انگشت
در قشر حسی تنی انسان: یک مطالعه fMRI
Neuroimage 1998; 7: 261 83.
Hickmott PW، Steen PA. تغییرات در مقیاس بزرگ در ساختار دندریتی
در طول سازماندهی مجدد قشر حسی تنی بزرگسالان. Nat Neurosci
2005; 8: 140.
Iwamura Y، Tanaka M، Iriki A، Taoka M، Toda T. پردازش
سیگنال های لمسی و حرکتی از دو طرف بدن در
شکنج پست مرکزی میمون های بیدار Behav Brain Res 2002; 135:
185.
Jaquet JB، Luijsterburg AJ، Kalmijn S، Kuypers PD، Hofman A، Hovius SE.
آسیب های عصب مدیان، اولنار و ترکیبی عصب مدین-اولنار: عملکردی
نتیجه و بازگشت به بهره وری J تروما 2001; 51: 687 92.
Jurkiewicz MT، Crawley AP، Verrier MC، Fehlings MG، Mikulis DJ.
آتروفی قشر حسی جسمی پس از آسیب نخاعی: مبتنی بر وکسل
مطالعه مورفومتری نورولوژی 2006; 66: 762.
کاس جی اچ. انعطاف پذیری نقشه های حسی و حرکتی در پستانداران بالغ آنو
Rev Neurosci 1991; 14: 137 67.
Kaas JH، Jain N، Qi HX. سازماندهی سیستم حسی تنی در
نخستی ها در: نلسون آر جی، ویراستار. سیستم حسی تنی.
واشنگتن دی سی: CRC Press; 2002. ص. 1.
Kimura J. Electrodiagnosis در بیماری های عصب و عضله: اصول
و تمرین کنید. آکسفورد: انتشارات دانشگاه آکسفورد; 2001.
کیمورا جی. اصول و مشکلات مطالعات هدایت عصبی. آن نورول
1984; 16: 415.
Knyihar-Csillik E، Rakic P، Csillik B. دژنراسیون ترانس عصبی در
ماده رولاندو از نخاع پستانداران برانگیخته شده توسط
آتروفی دژنراتیو ترانس عقده ای مرکزی ناشی از آکسوتومی
پایانه های حسی اولیه سلول Tissue Res 1989; 258: 515.
Liss AG، af Ekenstam FW، Wiberg M. از دست دادن نورون ها در ریشه پشتی
گانگلیون پس از قطع یک عصب حسی محیطی. آناتومیک
مطالعه در میمون ها Scand J Plast Reconstr Surg Hand Surg 1996; 30: 1.
Lotze M، Flor H، Grodd W، Larbig W، Birbaumer N. حرکات فانتوم
و درد مطالعه fMRI در افراد قطع عضو اندام فوقانی. مغز 2001;
124: 2268 77.
Manduch M، Bezuhly M، Anastakis DJ، Crawley AP، Mikulis DJ. سریال
fMRI تغییرات تطبیقی در قشر حسی حرکتی اولیه به دنبال آن
بازسازی انگشت شست نورولوژی 2002; 59: 1278 81.
ممکن است A. درد مزمن ممکن است ساختار مغز را تغییر دهد. درد 2008;
137: 7 15.
McAllister RM، Gilbert SE، Calder JS، Smith PJ. اپیدمیولوژی و
مدیریت آسیب های عصبی محیطی اندام فوقانی در مدرن
تمرین. J Hand Surg (Br) 1996; 21: 4:13.
Murray EA، Mishkin M. سهم نسبی SII و area5 به لمسی
تبعیض در میمون ها 2. Behav Brain Res 1984; 11: 67:83.
Napadow V، Kettner N، Ryan A، Kwong KK، Audette J، Hui KK.
پلاستیسیته قشر حسی تنی در سندرم تونل کارپال - مقطعی
ارزیابی fMRI Neuroimage 2006; 31: 520 × 30.
اولدفیلد RC. ارزیابی و تجزیه و تحلیل دستی: ادینبورگ
فهرست. Neuropsychologia 1971; 9: 97 113.
Pons TP، Garraghty PE، Cusick CG، Kaas JH. سازمان سوماتوتوپیک
منطقه 2 در میمون های ماکاک 6. J Comp Neurol 1985; 241: 445 66.
Pons TP، Garraghty PE، Friedman DP، Mishkin M. شواهد فیزیولوژیکی
برای پردازش سریال در قشر حسی تنی. علم 1987; 237:
417.
Porro CA، Lui F، Facchin P، Maieron M، Baraldi P. فعالیت مرتبط با ادراک
در سیستم حسی تنی انسان: تشدید مغناطیسی عملکردی
مطالعات تصویربرداری Magn Reson Imaging 2004; 22: 1539 48.
پاول TP، Erulkar S. انحطاط سلول ترانس عصبی در شنوایی
هسته های رله گربه ج آنات 1962; 96: 249 68.
Ridley RM، Ettlinger G. اختلال در یادگیری لمسی و حفظ پس از آن
برداشتن دومین قشر برآمدگی حسی جسمی (SII) در
میمون Brain Res 1976; 109: 656×60.
Rosen B, Lundborg G. ابزار جدید تشخیصی لمسی در حساسیت
آزمایش کردن. J Hand Ther 1998; 11: 251.
Seminowicz DA، Davis KD. درد اتصال عملکردی را افزایش می دهد
یک شبکه مغزی که با انجام یک کار شناختی برانگیخته می شود.
J Neurophysiol 2007; 97: 3651 9.
اسمیت اس ام، جنکینسون ام، یوهانسن-برگ اچ، و همکاران. فضایی مبتنی بر تراکت
آمار: تجزیه و تحلیل voxelwise داده های انتشار چند موضوعی.
Neuroimage 2006; 31: 1487 1505.
Talairach J, Tournoux P. اطلس استریوتاکسی همسطح مغز انسان.
نیویورک: Thieme Medical Publishers Inc. 1988.
Taylor KS، Anastakis DJ، Davis KD. درد مزمن بدنبال محیطی
آسیب عصبی با فاجعه سازی درد و روان رنجوری همراه است.
Int Ass Stud Pain 2008a; 267.
تیلور کیاس، دیویس کیدی. پایداری fMRI مربوط به لمس و درد
فعالیت های مغزی: بررسی وابسته به آستانه و
روش های مستقل از آستانه Hum Brain Map 2009; 30:
1947.
تیلور KS، Seminowicz DA، Davis KD. دو سیستم حالت استراحت
اتصال بین اینسولا و قشر سینگولات. هوم مغز
Map 2008b;DOI:10.1002/hbm.20705.
Wall JT، Kaas JH، Sur M، Nelson RJ، Felleman DJ، Merzenich MM.
سازماندهی مجدد عملکردی در نواحی قشر حسی تنی 3b و 1
میمون های بالغ پس از ترمیم عصب مدیان: ارتباط احتمالی با
بازیابی حسی در انسان J Neurosci 1986; 6: 218:33.
بستن آکاردئون
اطلاعات اینجا در "برش عصب مغز شما را تغییر می دهد ال پاسو، TX."در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من