آلسیو ننسی، ایرنه کافا، سالواتوره کورتلینو
چکیده | آسیب پذیری سلول های سرطانی برای محرومیت مواد مغذی و وابستگی آنها به متابولیت های خاص، نشانه های سرطان است. رژیم های غذایی روزانه و یا روزه گیری (FMD) منجر به تغییرات گسترده ای در عوامل رشد و در سطوح متابولیت ها می شود، محیط هایی را ایجاد می کنند که می توانند توانایی سلول های سرطانی را برای انطباق و زنده ماندن کاهش دهند و بنابراین اثرات درمان سرطان را بهبود می بخشد. علاوه بر این، روزه و یا FMD ها مقاومت به شیمی درمانی را در سلول های طبیعی، اما نه سلول های سرطانی افزایش می دهند و باعث بهبودی بازسازی در بافت های طبیعی می شوند، که می تواند به جلوگیری از عوارض ناشی از اثرات مضر و بالقوه خطرناک زندگی درمان کمک کند. در حالیکه روزه گرفتن بیماران به سختی تحمل می شود، مطالعات حیوانی و بالینی نشان می دهد که دوره های متابولیسم کم کالری امکان پذیر و به طور کلی ایمن هستند. چندین کارآزمایی بالینی که به بررسی تأثیر روزهداری یا فریزر در موارد عوارض ناشی از درمان و نتایج اثربخشی می پردازند ادامه دارد. ما پیشنهاد می کنیم که ترکیبی از FMD ها با شیمی درمانی، ایمونوتراپی و یا سایر درمان ها، استراتژی بالقوه ای امیدوار کننده برای افزایش اثربخشی درمان، جلوگیری از ایجاد مقاومت و کاهش عوارض جانبی است.
عوامل مرتبط با رژیم غذایی و سبک زندگی عامل تعیینکننده خطر ابتلا به سرطان هستندبا توجه به اینکه برخی از سرطان ها بیشتر از بقیه به عادات غذایی وابسته هستند
حتی اگر در دهه گذشته شاهد تغییرات بی سابقه و پیشرفت های قابل توجه در درمان سرطان 14,15 بوده ایم، نیاز حیاتی برای موثرتر و احتمالا
روزه گرفتن سلولهای سالم را برای وارد شدن به یک بخش آهسته و حالت بسیار محافظتی که آنها را در مقابل عوارض سمی حاصل از داروهای ضد سرطانی محافظت می کند، در حالی که حساسیت انواع مختلف سلول های سرطانی به این درمان های 11,12,17. این کشف نشان می دهد که یک مداخله تنها در رژیم غذایی به طور بالقوه می تواند به مسائل مختلف و به همان اندازه مهم در درمان سرطان کمک کند.
در مقاله این مقاله، ما در مورد مبانی بیولوژیکی برای استفاده از رژیم های روزانه یا روزه گیری (FMD) به TEAE های خفیف، بلکه برای جلوگیری و درمان سرطان بحث می کنیم. ما همچنین هشدارهای این رویکرد تجربی 18,19 و مطالعات بالینی منتشر شده و در حال انجام است که در آن روزهداری و یا نوعی فریبندگی در بیماران مبتلا به سرطان مورد استفاده قرار گرفته است.
فهرست
پاسخ روزه سیستمیک و سلولی
روزه داری منجر به تغییر در فعالیت بسیاری از مسیرهای متابولیتیک مرتبط با سوئیچ به حالت قادر به تولید انرژی و متابولیت ها با استفاده از منابع کربنی است که عمدتا از بافت چربی و بخشی از عضله منتشر می شود. تغییرات در سطوح هورمون های گردش خون و متابولیت ها باعث کاهش تقسیم سلولی می شود فعالیت متابولیک از سلول های طبیعی و در نهایت آنها را از insults11,12 chemotherapeutic. سلول های سرطانی با نادیده گرفتن دستورات ضد رشدی که به این شرایط گرسنگی دچار شده اند، می توانند پاسخ متقابل سلول های طبیعی را داشته باشند و بنابراین به شیمی درمانی و سایر درمان های سرطانی حساس می شوند.
پاسخ سیستمیک به روزه
پاسخ به روزه ناشی از سطوح سرمی گلوکز، انسولین، گلوکاگون، هورمون رشد (GH)، IGF1، گلوکوکورتیکوئیدها
گلوکاگون و سطح پایین انسولین همچنین تجزیه تری گلیسیریدها (که بیشتر در بافت چربی ذخیره می شوند) به گلیسرول و اسیدهای چرب آزاد را تحریک می کنند. در طی روزه داری ، اکثر بافت ها از اسیدهای چرب برای انرژی استفاده می کنند ، در حالی که مغز به گلوکز و بدن کتونی تولید شده توسط سلولهای کبدی متکی است (اجسام کتون را می توان از استیل-CoA تولید شده از اکسیداسیون اسید چرب یا اسیدهای آمینه کتوژنیک تولید کرد). در مرحله کتوژنیک روزه داری ، اجسام کتون در محدوده میلی مولار به غلظت می رسند ، به طور معمول پس از 2 3 روز از آغاز روزه شروع می شود. بدن کتون همراه با گلیسرول و اسیدهای آمینه مشتق شده از چربی ، گلوکونئوژنز را تأمین می کند ، که سطح گلوکز را در غلظت تقریبا 4 میلی مولار (70 میلی گرم در دسی لیتر) حفظ می کند ، که بیشتر توسط مغز استفاده می شود.
گلوكوكورتيكوئيدها و آدرنالين هم به انطباق متابوليسمي تاكيد مي كنند
در نهایت، روزه داری سطح لپتین را کاهش می دهد، هورمونی که عمدتا از طریق آدیپوسیت ها تولید می شود که از گرسنگی جلوگیری می کند، در حالی که سطح آدیپونکتین را افزایش می دهد که موجب کاهش 23,24 می شود. بنابراین، در نتیجه، نشانه های پاسخ سیستمیک پستانداران به روزه، سطوح پایین گلوکز و انسولین، سطوح بالای گلوکاگون و کتون ها، سطوح پایین IGF1 و لپتین و سطوح بالای آدیپونکتین است.
پاسخ سلولی به روزه
پاسخ سلولهای سالم به روزه داری از نظر تکاملی حفظ می شود و باعث محافظت از سلول می شود و حداقل در موجودات زنده مدل ، افزایش طول عمر و سلامت 12,22,25،31،1 نشان داده شده است. IGFXNUMX
روزه داری و محدودیت گلوکز حاصل ، فعالیت PKA را مهار می کند ، فعالیت AMPK را افزایش می دهد و EGR1 را فعال می کند و بدین ترتیب به اثرات محافظتی سلولی ، از جمله اثرات قلب ، 22,25,26،1،22,37 می رسد. سرانجام ، روزه داری و FMD (که برای ترکیب آنها به زیر مراجعه کنید) همچنین می توانند با ایجاد مکانیسم های مولکولی ، برخی از آنها در سرطان نقش داشته باشند ، از جمله افزایش اتوفاژی یا القای فعالیت سیرتین ، اثرات ترمیمی (جعبه 49) را تقویت کنند. .

رویکردهای رژیم غذایی در سکته های قلبی سرطان
رویکردهای غذایی مبتنی بر روزه داری که به طور گسترده تری در آنکولوژی ، چه از نظر بالینی و چه از نظر بالینی مورد بررسی قرار گرفته اند ، شامل روزه داری آب (پرهیز از مصرف همه مواد غذایی و نوشیدنی به جز آب) و FMDs 11,12,17,25,26,50،60،1،48،XNUMX،XNUMX XNUMX (جدول XNUMX) داده های بالینی اولیه نشان می دهد که برای دستیابی به اثرات معنی دار بالینی در سرطان ، از جمله جلوگیری از آسیب DNA ناشی از شیمی درمانی به بافت های سالم و کمک به حفظ ، ممکن است روزه حداقل XNUMX ساعته باشد.
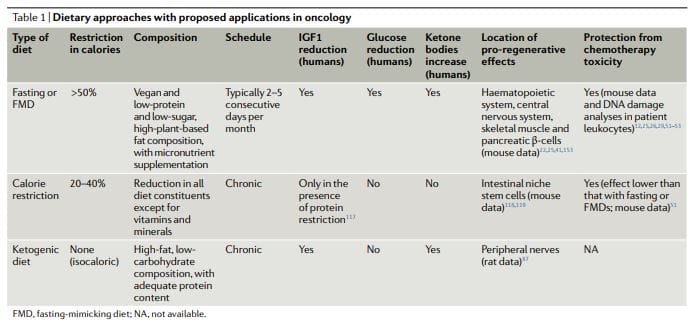
با این حال ، اکثر بیماران در اتمام روزه داری آب امتناع می کنند و یا در آنها مشکل وجود دارد و توجیه خطرات احتمالی افزایش کالری و کمبود عناصر مغذی مرتبط با آن دشوار است. FMD ها رژیم های غذایی هستند که از نظر پزشکی بسیار کم کالری (یعنی به طور معمول بین 300 تا 1,100 کیلوکالری در روز) ، قندها و پروتئین ها هستند که بسیاری از اثرات روزه داری فقط در آب را ایجاد می کنند اما با رعایت بهتر بیمار و کاهش خطر تغذیه 22,61,62،3 ، 5 در طی FMD ، بیماران معمولاً مقادیر نامحدودی از آب ، مقادیر کمی و استاندارد آبگوشت سبزیجات ، سوپ ، آب میوه ، میله آجیل و دمنوش های گیاهی و همچنین مکمل های ریز مغذی دریافت می کنند. در یک مطالعه بالینی بر روی 1 دوره ماهیانه از 62 روز FMD در افراد سالم ، رژیم غذایی به خوبی تحمل شد و باعث کاهش چربی تنه و کل بدن ، فشار خون و سطح IGF3 شد 4. در آزمایشات بالینی قبلی و مداوم سرطان ، ناشتا یا FMD به طور معمول هر 1 5 هفته تجویز می شود ، به عنوان مثال ، همراه با رژیم های شیمی درمانی ، و مدت زمان آنها بین 52,53,58,61,63 تا 68 روز است 3،52,53,58,61،XNUMX،XNUMX،XNUMX-XNUMX . نکته مهم ، هیچ عارضه جانبی جدی (طبق GXNUMX معیارهای اصطلاحات رایج برای عوارض جانبی) سطح GXNUMX یا بالاتر گزارش نشده است XNUMX،XNUMX،XNUMX،XNUMX.
رژیم غذایی Ketogenic
رژیم های کتوژنیک (رژیم های غذایی کتوژنیک) رژیم های غذایی هستند که دارای کالری نرمال ، چربی بالا و کربوهیدرات کم 69,70،4 هستند. در یک KD کلاسیک ، نسبت بین وزن چربی و وزن ترکیبی کربوهیدرات و پروتئین 1: 0.5 است. نکته قابل توجه ، FMD ها همچنین کتوژنیک هستند زیرا دارای محتوای چربی زیادی هستند و توانایی القای افزایش های قابل توجه (؟ 1 میلی مول در لیتر) در سطح اجسام کتون در گردش را دارند. در انسان ، یک KD همچنین می تواند سطح IGF20 و انسولین را (بیش از 71 درصد از مقدار پایه) کاهش دهد ، اگرچه این اثرات تحت تأثیر سطح و انواع کربوهیدرات ها و پروتئین ها در رژیم غذایی 4.4 است. KD می تواند سطح گلوکز خون را کاهش دهد ، اما به طور معمول در حد طبیعی باقی می ماند (یعنی> 71/XNUMX میلی مول در لیتر) XNUMX.
به طور قابل توجهی ، KD ممکن است برای جلوگیری از افزایش گلوکز و انسولین که به طور معمول در پاسخ به مهار کننده های PI3K اتفاق می افتد ، موثر باشد که برای محدود کردن کارایی آنها پیشنهاد شده 72. به طور سنتی ، KD برای درمان صرع مقاوم به درمان ، به طور عمده در کودکان 69 استفاده می شود. در مدل های موش ، KD اثرات ضد سرطانی ، به ویژه در گلیوبلاستوما 70,72،86-3 را القا می کند. مطالعات بالینی نشان می دهد که KD ها در صورت استفاده از داروهای منفرد در بیماران مبتلا به سرطان ، احتمالاً هیچ فعالیت درمانی قابل توجهی ندارند و نشان می دهد که منافع بالقوه این رژیم ها را باید در ترکیب با روش های دیگر مانند شیمی درمانی ، پرتودرمانی ، درمان های ضد آنژیوژنیک ، مهار کننده های PIXNUMXK جستجو کرد.
گزارش شده است که KD ها دارای اثرات محافظتی عصبی در اعصاب محیطی و هیپوکامپ هستند 87,88،1. با این حال ، باید مشخص شود که آیا KD ها اثرات پیش تولیدی مشابه ناشتا یا FMD دارند (جعبه 22) و آیا از KD نیز می توان برای محافظت پستانداران زنده از سمیت شیمی درمانی استفاده کرد. قابل توجه است ، به نظر می رسد اثرات ترمیمی روزه داری یا FMD با تغییر حالت پاسخ گرسنگی ، که شامل تجزیه اجزای سلولی و مرگ بسیاری از سلول ها و دوره تغذیه مجدد است ، که در آن سلول ها و بافت ها تحت تأثیر قرار می گیرند ، حداکثر می شود. XNUMX. از آنجا که KD ها مجبور به ورود به حالت گرسنگی نمی شوند ، تجزیه عمده اجزای داخل سلولی و بافت ها را ترویج نمی کنند و شامل یک دوره تخلیه نمی شوند ، بعید به نظر می رسد که باعث ایجاد نوع بازسازی هماهنگ شده در هنگام تغذیه مجدد FMD شوند.
کالری محدودیت
در حالی که محدودیت مزمن کالری (رژیم غذایی کم مصرف) و رژیم های غذایی کمبود اسیدهای آمینه خاص با روزه داری دوره ای بسیار متفاوت است ، اما آنها با ناشتا و FMD ها یک محدودیت انتخابی کم و بیش در مواد مغذی دارند و آنها اثرات ضد سرطانی دارند 81,89،112 20. CR به طور معمول شامل 30-113,114٪ کاهش مزمن انرژی دریافتی از میزان کالری دریافتی استاندارد است که به فرد امکان می دهد وزن طبیعی خود را حفظ کند 108,109,114،XNUMX. در کاهش عوامل خطر قلبی عروقی و بروز سرطان در ارگانیسم های مدل ، از جمله پستاندارانXNUMX،XNUMX،XNUMX بسیار موثر است.
با این حال ، CR می تواند عوارض جانبی ایجاد کند ، مانند تغییر در شکل ظاهری ، افزایش حساسیت به سرما ، کاهش قدرت ، بی نظمی قاعدگی ، ناباروری ، از دست دادن میل جنسی ، پوکی استخوان ، ترمیم زخم کندتر ، وسواس غذایی ، تحریک پذیری و افسردگی. در بیماران مبتلا به سرطان ، نگرانی های اساسی وجود دارد که ممکن است سو malتغذیه را تشدید کند و به طور اجتناب ناپذیری باعث از دست دادن بیش از حد توده لاغر بدن خواهد شد. CR سطح گلوکز خون ناشتا را کاهش می دهد ، اگرچه در حد طبیعی باقی مانده است 18,113. در انسان ، CR مزمن بر میزان IGF116 تأثیر نمی گذارد مگر اینکه محدودیت پروتئین متوسطی نیز اعمال شود 114.
مطالعات نشان می دهد که با کاهش سیگنال mTORC1 در سلول های پانت، CR افزایش عملکرد سلول های بنیادی و همچنین حفاظت از سلول های بنیادی روده ای را از آسیب DNA 118,119 محافظت می کند، اما مشخص نیست که آیا اثرات تجدید پذیر در ارگان های دیگر نیز توسط CR ایجاد شده است یا خیر. بنابراین، داده های موجود نشان می دهد که ناشتا و ناتوانی های جنسی باعث ایجاد یک پرونده متابولیک، باززایی و محافظتی می شود که متمایز و احتمالا قوی تر از آنچه که توسط KD یا CR ایجاد شده است.
ناشتا و FMD در درمان: تأثیر بر میزان هورمون و متابولیت
بسیاری از تغییرات در سطوح هورمون های گردش خون و متابولیت هایی که معمولا در پاسخ به روزه مشاهده می شوند، توانایی اعمال اثرات ضد تومور (یعنی کاهش سطح گلوکز، IGF1، انسولین و لپتین و افزایش سطح آديپونکتين) 23,120,121 و / یا برای محافظت از بافت سالم از عوارض جانبی (یعنی کاهش سطح IGF1 و گلوکز). از آنجایی که بدن کتون می تواند هیستون دیازتیلاس (HDAC ها) را مهار کند، افزایش ناگهانی بدن کتون ممکن است به کاهش رشد تومور کمک کند و تمایز را از طریق مکانیسم های اپی ژنتیک 122 ترویج دهد.
با این حال ، نشان داده شده است استات بدن کتون به جای کاهش رشد برخی تومورها ، مانند ملانومای دارای BRAF123 جهش یافته ، به جای کاهش سرعت ، تسریع می کند. آن تغییراتی که قوی ترین شواهد در مورد تأثیر آنها در تأثیرات مفید روزه داری و FMD در برابر سرطان وجود دارد ، کاهش سطح IGF1 و گلوکز است. در سطح مولکولی ، روزه گرفتن یا FMD باعث کاهش آبشارهای سیگنالینگ داخل سلولی از جمله IGF1R AKT mTORKS6K و سیگنالینگ cAMP PKA می شود ، اتوفاژی را افزایش می دهد ، به سلول های طبیعی کمک می کند استرس را تحمل کنند و ایمنی ضد سرطان را تقویت می کند 25,29,56,124،XNUMX،XNUMX،XNUMX
مقاومت به استرس دیفرانسیل: افزایش تحمل شیمی درمانی
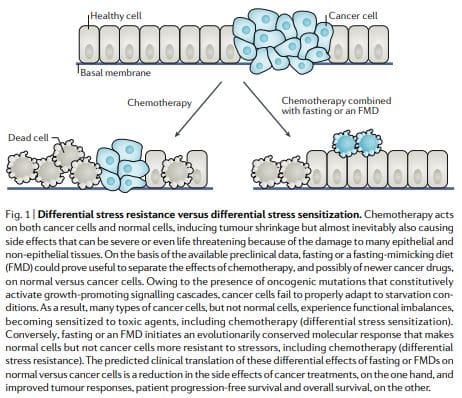
برخی از ارقام انکوژن مخمر مانند Ras و Sch9 (ارقام عملکردی S6K پستانداران) قادر به کاهش مقاومت تنش در ارگانیزم های مدل 27,28 می باشند. علاوه بر این جهش هایی که IGF1R، RAS، PI3KCA یا AKT را فعال می کنند یا PTEN را غیرفعال می کنند، در اکثر موارد سرطان 10 انسان وجود دارد. با هم، این به فرضیه منجر شد که گرسنگی موجب اثرات متقابل در سرطان در برابر سلول های طبیعی بر اساس توانایی آنها برای مقاومت در برابر عوامل استرسزا سلولی، از جمله chemotherapeutics. به عبارت دیگر، گرسنگی می تواند به منجر شود
طبق فرضیه DSR ، سلولهای طبیعی با کاهش تنظیم ژنهای تکثیر مرتبط با ریبوزوم و / یا مونتاژ ، سلولها را وادار به ورود به حالت خود-نگهداری می کنند و از آنها در برابر آسیبهای ناشی از شیمی درمانی ، رادیوتراپی و سایر عوامل سمی محافظت می کنند. در مقابل ، در سلولهای سرطانی ، از طریق تغییرات سرطان زا ، که باعث مهار سازنده مسیرهای پاسخ استرس می شود ، از این حالت خود-نگهداری جلوگیری می شود (شکل 12). مطابق با مدل DSR ، گرسنگی کوتاه مدت یا حذف پروتوآنکوژن است
نتایج مشابهی در سلول های پستاندار یافت شد: قرار گرفتن در معرض کمبود گلوکز، سلولهای گلایسیم اولیه را در مقابل سمیت از پراکسید هیدروژنه یا سیکلوفسفامید (شیمی درمانی پروکسی سدیم) محافظت کرد اما موش ها، موش ها و گلیوما انسانی و سلول های سرطانی نوروبلاستوما را حفظ نکردند. مطابق با این مشاهدات
مطالعات بعدی نشان داد که کاهش سیگنالینگ IGF1 در پاسخ به روزه داری از گلیا و نورونهای اولیه محافظت می کند ، اما از سلولهای گلیوما و نوروبلاستوما محافظت نمی کند ، از سیکلوفسفامید و از ترکیبات پروکسیداتیو محافظت می کند از فیبروبلاست های جنینی موش در برابر doxorubicin29. موش های مبتلا به کمبود IGF1 کبد (LID) ، حیوانات تراریخته با حذف ژن Igf1 کبدی مشروط که 70-80٪ کاهش در سطح IGF1 در گردش خون (سطح مشابه با 72 ساعت روزه داری در موش ها) 29,125،XNUMX را نشان می دهد ، در برابر محافظت می شود سه مورد از چهار داروی شیمی درمانی آزمایش شده از جمله دوکسوروبیسین.
مطالعات بافت شناسی نشانه هایی از میوپاتی قلبی ناشی از دوکسوروبیسین را فقط در موش های شاهد تحت درمان با داکسوروبیسین نشان داد اما در موش های LID نه. در آزمایشات با حیوانات دارای ملانوم تحت درمان با دوکسوروبیسین ، هیچ تفاوتی از نظر پیشرفت بیماری بین موشهای کنترل و LID مشاهده نشد ، که نشان می دهد سلولهای سرطانی با کاهش سطح IGF1 از شیمی درمانی محافظت نمی شوند. با این حال ، موشهای LID تومور دار در مقایسه با حیوانات شاهد به دلیل توانایی مقاومت در برابر سمیت دوکسوروبیسین ، یک مزیت زنده ماندن قابل توجه نشان دادند. بنابراین ، به طور کلی ، این نتایج تأیید کرد که کاهش تنظیم IGF29 مکانیسم کلیدی است که به موجب آن روزه داری تحمل شیمی درمانی را افزایش می دهد.
هر دو مهار کننده دگزامتازون و mTOR به طور گسترده ای در درمان سرطان استفاده می شود، یا به علت کارآیی آنها به عنوان ضد عفونی کننده و
این مداخلات ضمن افزایش فعالیت AMPK ، فعالیت PKA را کاهش داده و در نتیجه EGR1 را فعال می کنند ، نشان می دهد که سیگنالینگ cAMP PKA واسطه DSR ناشی از روزه داری از طریق EGR1 است (مراجعه به شماره 26). EGR1 همچنین بیان کننده پپتیدهای محافظت کننده قلب ، مانند پپتید ناتریورتیک دهلیزی (ANP) و پپتید ناتریورتیک نوع B (BNP) در بافت قلب است که به مقاومت در برابر دوکسوروبیسین کمک می کند. علاوه بر این ، روزه گرفتن و / یا FMD ممکن است با تقویت اتوفاژی ، از موش در برابر کاردیومیوپاتی ناشی از دوکسوروبیسین محافظت کند ، که ممکن است با کاهش تولید اکسیژن فعال (ROS) از طریق از بین بردن میتوکندری های ناکارآمد و از بین بردن مواد سمی ، سلامت سلول را افزایش دهد.
چرخه های ناشتا علاوه بر کاهش سمیت ناشی از شیمی درمانی در سلول ها و افزایش بقای موش های تحت شیمی درمانی ، بازسازی مغز استخوان را القا می کنند و از سرکوب سیستم ایمنی ناشی از سیکلوفسفامید به روش مرتبط با PKA و مربوط به IGF1 جلوگیری می کنند 25. بنابراین ، نتایج پیش بالینی قانع کننده نشان دهنده پتانسیل روزه داری و FMD در افزایش تحمل شیمی درمانی و جلوگیری از عوارض جانبی عمده است. از آنجا که داده های بالینی اولیه از این پتانسیل پشتیبانی بیشتری می کنند ، این مطالعات بالینی دلیل منطقی برای ارزیابی FMD در آزمایشات بالینی تصادفی با TEAEs به عنوان نقطه پایان اولیه ایجاد می کنند.
حساسیت استرس دیفرانسیل: افزایش مرگ سلول های سرطانی
اگر به تنهایی مورد استفاده قرار گیرد، بیشتر مداخلات غذایی، از جمله ناشتا و افسردگی، اثرات محدودی بر پیشرفت سرطان دارد. با توجه به فرضیه DSS، تنوع روزه داری و یا افسردگی با درمان دوم خیلی بیشتر از 11,12 امیدوار کننده است. این فرضیه پیش بینی می کند که در حالی که سلول های سرطانی قادر به انطباق با اکسیژن محدود و غلظت مواد مغذی محدود هستند، بسیاری از انواع سلول های سرطانی قادر به انجام تغییراتی هستند که اجازه می دهد بقای در محیط مواد مغذی و سمی تولید شده توسط ترکیبی از روزه و شیمی درمانی ، مثلا. آزمایش های اولیه در سرطان سینه، ملانوم
ما چنین پاسخ نامناسب سلول های سرطانی را به شرایط تغییر یافته از قبیل کاهش میزان IGF1 و سطح گلوکز ناشی از ناشتا یا افسردگی به عنوان یک مکانیزم کلیدی در زیر

با کاهش در دسترس بودن گلوکز و افزایش اکسیداسیون اسید چرب ، ناشتا یا FMD همچنین می تواند از گلیکولیز هوازی (اثر واربورگ) به فسفوریلاسیون اکسیداتیو میتوکندری در سلول های سرطانی ، که برای تداوم رشد سلول های سرطانی در کمبود مواد مغذی ضروری است ، تغییر کند 50 (شکل 2) این کلید منجر به افزایش تولید ROS11 در نتیجه افزایش فعالیت تنفسی میتوکندری می شود و همچنین ممکن است منجر به کاهش پتانسیل اکسایش سلولی به دلیل کاهش سنتز گلوتاتیون از گلیکولیز و مسیر پنتوز فسفات شود. اثر ترکیبی افزایش ROS و کاهش محافظت آنتی اکسیدانی باعث افزایش استرس اکسیداتیو در سلولهای سرطانی و تقویت فعالیت شیمی درمانی می شود. قابل توجه است ، از آنجا که یک فعالیت گلیکولیتیک بالا که با تولید لاکتات بالا نشان داده می شود ، پیش بینی کننده تهاجم و تمایل متاستاتیک در چندین نوع سرطان است 50 ، اثرات ضد واربورگ روزه داری یا FMD می تواند به ویژه در برابر سرطان های تهاجمی و متاستاتیک موثر باشد.
به استثنای تغییر در متابولیسم، روزه و یا فیناستراید باعث تغییرات دیگری می شود که می تواند DSS را در سلول های سرطانی پانکراس ارتقا دهد. روزه سطح بیان را افزایش می دهد
سرانجام، روزه می تواند گیرنده لپتین و پایین تر آن را تنظیم کند
به طور قابل توجهی ، این احتمال وجود دارد که بسیاری از انواع سلول های سرطانی ، از جمله AML29 ، با دور زدن تغییرات متابولیکی ناشی از ناشتا یا FMD ، مقاومت پیدا کنند ، این احتمال با ناهمگنی متابولیکی که بسیاری از سرطان ها را مشخص می کند ، بیشتر می شود 129. بنابراین ، یک هدف اصلی برای آینده نزدیک شناسایی انواع سرطانی است که بیشتر به این رژیم های غذایی حساس هستند با استفاده از نشانگرهای زیستی. از طرف دیگر ، هنگامی که با درمان های استاندارد همراه باشد ، روزه داری یا FMD به ندرت منجر به کسب مقاومت در مدل های موش سرطانی شده است و مقاومت در برابر روزه داری همراه با شیمی درمانی نیز در مطالعات in vitro غیر معمول است ، و بر اهمیت شناسایی روش های درمانی تأکید می کند ، هنگامی که با FMD ها ترکیب شود ، منجر به اثرات سمی قوی علیه سلولهای سرطانی با حداقل سمیت برای سلولها و بافتهای طبیعی می شود 11,17,50,55،57,59,124،XNUMX،XNUMX XNUMX،XNUMX،XNUMX.
تقویت ایمنی ضد قارچی توسط روزه گرفتن و یا FMD
داده های اخیر نشان می دهد که روزه داری و یا اشباع زودرس توسط خودشان و به طور عمده در ترکیب با شیمی درمانی، باعث گسترش لنفوئید پیش آگهی ها و ترویج
رژیم های ضد سرطان در مدل های ماوس
به طور کلی ، نتایج مطالعات بالینی در مورد روزه داری یا FMD در مدل های سرطان حیوانات ، از جمله مدل های سرطان متاستاتیک (جدول 2) ، نشان می دهد که روزه داری دوره ای یا FMD به اثرات ضد سرطانی پلیوتروپیک رسیده و فعالیت شیمی درمانی و TKI را تقویت می کند در حالی که اثرات محافظتی و احیا کننده دارد. در اندام های متعدد 22,25،11,59. دستیابی به همان اثرات بدون روزه داری و / یا FMD نیاز به شناسایی و سپس استفاده از چندین داروی موثر ، گران قیمت و غالباً سمی دارد و احتمالاً بدون مزیت ایجاد محافظت از سلول سالم خواهد بود. قابل ذکر است که حداقل در دو مطالعه روزه داری همراه با شیمی درمانی تنها مداخله ای است که قادر به دستیابی به رگرسیون تومور کامل یا زنده ماندن طولانی مدت در بخش ثابت حیوانات تحت درمان است XNUMX،XNUMX
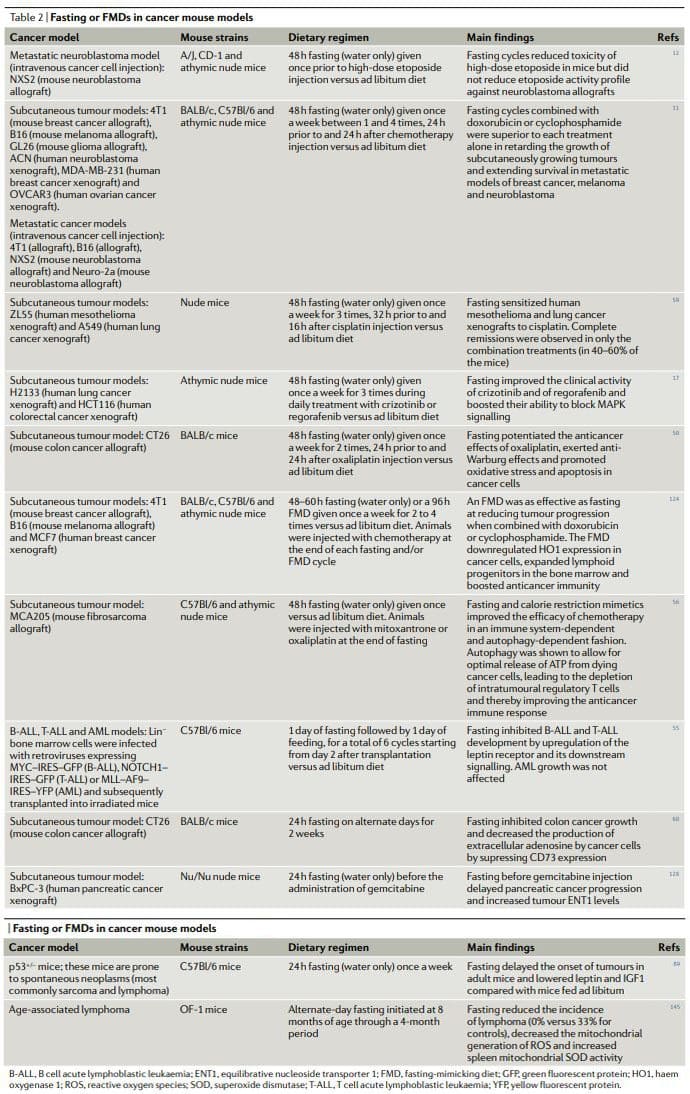
KD های مزمن نیز نشان می دهد
CR تومورزایی را در مدلهای سرطانی ژنتیکی موش ، مدلهای موش با تومورزایی خود به خود و مدلهای سرطانی ناشی از سرطان ، و همچنین در میمونها کاهش داد 91,92,97,98,101,102,104،106,108,109,136،138،57،6،139،15 XNUMX،XNUMX،XNUMX،XNUMX. در مقابل ، یک مطالعه نشان داد که CR از میانسالی در واقع باعث افزایش نئوپلاسم سلولهای پلاسما در موشهای CXNUMXBl / XNUMX می شود. با این حال ، در همان مطالعه ، CR همچنین حداکثر طول عمر را تقریباً XNUMX درصد افزایش داد و افزایش مشاهده شده در سرطان به افزایش طول عمر موش های تحت CR ، نسبتاً در سنی مربوط می شود.
مهمتر از همه، CR بهبود فعالیت ضد سرطان در چند مدل سرطان، از جمله فعالیت آنتی بادی antiIGF1R (ganitumab) در برابر سرطان پروستات 141، cyclophosphamide در برابر سلول های نوروبلاستوما 135 و مهار autophagy در xenografts از HRAS-G12Vtransformed سلول های اپیتلیال کلیوی MMNOMX تبدیل شده است. با این حال، CR یا KD در ترکیب با داروهای ضد سرطان به نظر می رسد کمتر از روزهداری موثر باشد. تحقیقات ماوس نشان داد که در مقایسه با روزه فقط CR تنها قادر به کاهش رشد موش های GL100 که به صورت زیر جلدی رشد نمی کند و همچنین در مقایسه با کوتاه مدت ناشتا، CR باعث افزایش فعالیت سیس پلاتین در برابر سینه 26T4 زیر جلدی نمی شود tumours1 در همان مطالعه، روزه نیز به طور قابل ملاحظه ای موثر تر از CR و KD در افزایش تحمل doxorubicin51. اگر چه روزه و یا یک FMD، CR و KD احتمالا در هم تداخل دارند و تعدیل می شوند
پس از آن مرحله مرحله نابودی می تواند باشد
روزه و ناباروری در پیشگیری از سرطان
مطالعات اپیدمیولوژیک و مطالعات در حیوانات، از جمله monkeys108,109,144، و انسان ها به این باور است که CR و دوره ای ناخواسته مزمن و / یا FMD می توانند اثرات پیشگیرانه سرطان را در انسان داشته باشند. با این وجود، CR به سختی می تواند در جامعه به دلیل مسائل مربوط به انطباق و عوارض جانبی ممکن 115 اجرا شود. بنابراین، در حالی که توصیه های مبتنی بر شواهد غذایی برای ترجیح (یا اجتناب) و توصیه های شیوه زندگی برای کاهش خطر ابتلا به سرطان در حال تبدیل شدن به 6,8,9,15 است، هدف در حال حاضر شناسایی و، احتمالا، استاندارد کردن رژیم های غذایی معتبر، دوره های دوره ای با کم و یا بدون عوارض جانبی و بررسی اثربخشی پیشگیری از سرطان در مطالعات بالینی.
همانطور که قبلا مورد بحث بود، سیکل های FMD منجر به کاهش تنظیم IGF1 و گلوکز و تنظیم مقادیر بدن IGFBP1 و کتون می شوند که تغییراتی مشابه با آن ها ناشی از ناشتا است و نشانگرهای زیستی پاسخ واکنش روزانه 22 است. هنگامی که موش های C57Bl / 6 (که خود به خودی توسعه می یابند
مطالعه قبلی روزه روزانه متناوب که در موش های سالم انجام شد در مجموع ماه های 4 نیز نشان داد که روزه موجب بروز لنفوم می شود و آن را از٪ 33٪ (برای موش های کنترل) تا٪ 0 کاهش می دهد. حیوانات) 145، گرچه به دلیل مدت کوتاهی مطالعه، معلوم نیست که آیا این رژیم روزهداری مانع یا به سادگی به تأخیر انداختن
بنابراین، نتایج امیدوار کننده مطالعات پیش از مواجهه با داده های بالینی در مورد اثر روانپزشکی بر عوامل خطر برای
کاربرد بالینی در انکولوژی
چهار مطالعه امکان سنجی روزه داری و تشنج های ناشی از آن در بیماران مبتلا به شیمی درمانی به روز از 52,53,58,61 منتشر شده است. در یک سری موارد از بیماران 10 تشخیص داده شده با انواع مختلف سرطان، از جمله سرطان سینه، پروستات، تخمدان، رحم، ریه و مغز استخوانی، که داوطلبانه تا 140hour قبل و / یا قبل از 56hour بعد از شیمی درمانی تاخیر بود، هیچ عوارض جانبی عمده ای ایجاد نشد از طریق روزه داری خود به غیر از گرسنگی و سرگیجه، 58 گزارش شد. آن دسته از بیماران (6) که تحت شیمی درمانی با و بدون روزه قرار گرفتند، کاهش شدید خستگی، ضعف و عوارض جانبی گوارش را در هنگام روزه ای گزارش کردند. علاوه بر این، در آن دسته از بیماران که در آن پیشرفت سرطان می تواند مورد بررسی قرار گیرد، روزه داری از کاهش شیمی درمانی در حجم تومور و یا نشانگرهای تومور جلوگیری نمی کند. در مطالعه دیگری، زنان 13 با HER2 (همچنین به نام ERBB2) منفی، سرطان پستان مرحله II / III دریافت شده از taxotere نئو adjuvant، شیمی درمانی adriamycin و cyclophosphamide (TAC) به سرعت (فقط آب) 24hour قبل و بعد از شروع شیمی درمانی یا به تغذیه با توجه به دستورالعمل های استاندارد 52.
روزه داری کوتاه مدت به خوبی تحمل شد و افت میانگین گلبول های قرمز و تعداد ترومبوسیت ها را 7 روز پس از شیمی درمانی کاهش داد. جالب توجه است ، در این مطالعه ، سطح؟ -H2AX (نشانگر آسیب DNA) 30 دقیقه پس از شیمی درمانی در لکوسیت ها از بیماران غیر روزه دار افزایش یافته است اما در بیمارانی که روزه گرفته اند نه. در یک افزایش دوز ناشتا در بیمارانی که تحت شیمی درمانی مبتنی بر پلاتین قرار گرفتند ، 20 بیمار (که در درجه اول تحت درمان با سرطان ادرار ، تخمدان یا پستان قرار گرفتند) به طور تصادفی 24 ، 48 یا 72 ساعت روزه گرفتند (تقسیم بر 48 ساعت قبل از شیمی درمانی و 24 ساعت بعد از شیمی درمانی) ) 53 معیارهای امکان سنجی (به عنوان سه یا بیشتر از شش نفر در هر گروه مصرف کننده؟ 200 کیلوکالری در روز در طول دوره سریع بدون سمیت زیاد) تعریف شده است. سموم مربوط به روزه داری
به تازگی، یک کارآزمایی بالینی تصادفی متقاطع، با هدف بررسی اثرات متابولیسم بر کیفیت زندگی و عوارض جانبی شیمی در مجموع 34 مبتلا به سرطان سینه و تخمدان 61 انجام شد. سکته قلبی شامل:
چالش ها در کلینیک
مطالعه روزه داری و یا نوعی از تشنج های جنسی در انکولوژی، از جمله نگرانی ها، به ویژه در رابطه با احتمال این که رژیم غذایی رژیم غذایی ممکن است سوء تغذیه، سارکوفنیا،
نتیجه گیری
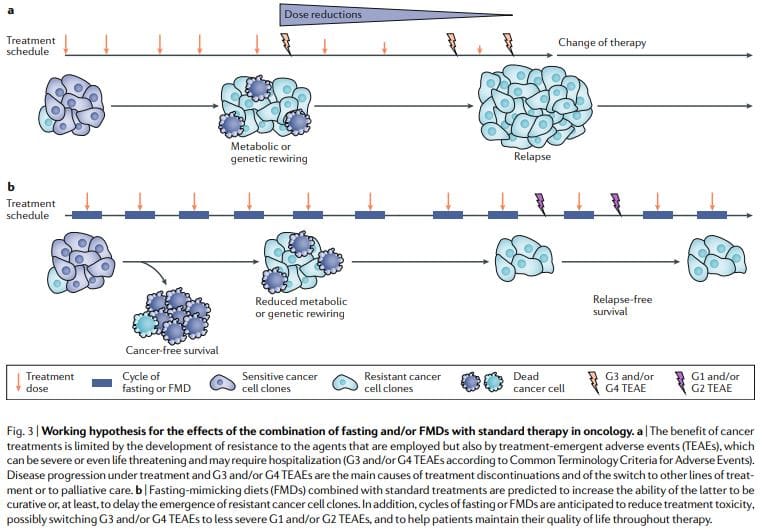
روزه داری دوره ای یا FMD به طور مداوم اثرات ضد سرطانی قدرتمندی را در مدل های سرطان موش نشان می دهد از جمله توانایی تقویت شیمی درمانی و TKI و تحریک ایمنی ضد سرطان. چرخه های FMD نسبت به رژیم های غذایی مزمن امکان پذیرتر است زیرا به بیماران امکان می دهد در طول FMD به طور منظم غذا مصرف کنند ، رژیم غذایی معمولی را بین چرخه ها حفظ کنند و منجر به کاهش شدید وزن و احتمالاً اثرات مخرب بر سیستم ایمنی و غدد درون ریز نشوند. قابل ذکر است ، به عنوان درمان های مستقل ، دوره های ناشتا یا روزه داری احتمالاً اثر محدودی در برابر تومورهای ایجاد شده دارند. در حقیقت ، در موش ها ، روزه داری یا FMD پیشرفت بسیاری از سرطان ها را مشابه شیمی درمانی تحت تأثیر قرار می دهد ، اما به تنهایی ، آنها به ندرت با اثر به دست آمده در ترکیب با داروهای سرطانی مطابقت دارند که می تواند منجر به زنده ماندن بدون سرطان شود 11,59،11,59. بنابراین ، ما پیشنهاد می کنیم که ترکیبی از دوره های دوره ای FMD با درمان های استاندارد است که بالاترین پتانسیل را برای ارتقا surv بقا بدون سرطان در بیماران دارد ، همانطور که توسط مدل های موش 3،XNUMX پیشنهاد شده است (شکل XNUMX).
این ترکیب ممکن است به دلایل مختلف به شدت قوی باشد: اول، داروهای سرطانی و سایر درمان ها می تواند موثر باشد، اما بخشی از بیماران پاسخ نمی دهند زیرا سلول های سرطانی استراتژی های جایگزین متابولیک را به سوی بقا ادامه می دهند. این روشهای جایگزین متابولیک به دلیل کمبود یا تغییرات در گلوکز، برخی اسید آمینه ها، هورمون ها و عوامل رشد، و همچنین در سایر مسیرهای ناشناخته که منجر به مرگ سلولی می شود، بسیار مؤثر است. دوم، روزهداری یا زوال عقل میتواند مانع یا کاهش مقاومت شود. سوم، ناشتا یا FMD ها از سلول های طبیعی و اندام ها از عوارض جانبی ناشی از انواع مختلف داروهای سرطانی محافظت می کنند. بر اساس شواهد پیشین و بالینی از امکان سنجی، ایمنی و کارآیی (در کاهش IGF1، چربی احشایی
علاوه بر این، ضروری است که با استفاده از درک مکانیسم های عمل، از قدرت خود استفاده شود
مطالعات بالینی مداوم در مورد FMD ها در بیماران مبتلا به سرطان 63,65،68-XNUMX پاسخ جامع تری را در مورد اینکه آیا تجویز FMD های دوره ای در ترکیب با عوامل ضدسرطان معمولی به بهبود تحمل و فعالیت بیماری دوم کمک می کند ، ارائه می دهد. در نظر گرفتن این نکته مهم است که FMD در کاهش عوارض جانبی درمان سرطان در همه بیماران م effectiveثر نخواهد بود و همچنین برای بهبود کارایی همه روشهای درمانی نیز م workثر نخواهد بود ، اما آنها توانایی انجام این کار را حداقل برای بخشی و احتمالاً دارند. برای بخش عمده ای از بیماران و داروها. بیماران ضعیف یا دارای سوour تغذیه یا بیمارانی که در معرض سو mal تغذیه هستند نباید در مطالعات بالینی ناشتا یا FMD ثبت شوند و وضعیت تغذیه و بی اشتهایی بیمار باید به دقت در کل آزمایشات بالینی کنترل شود.
منابع:
اطلاعات اینجا در "روزه و سرطان: مکانیسم های مولکولی و کاربرد بالینی"در نظر گرفته شده است که جایگزین رابطه یک به یک با یک متخصص مراقبت های بهداشتی واجد شرایط یا پزشک دارای مجوز نیست و توصیه پزشکی نیست. ما شما را تشویق می کنیم که تصمیمات مراقبت های بهداشتی را بر اساس تحقیقات و مشارکت خود با یک متخصص مراقبت های بهداشتی واجد شرایط اتخاذ کنید.
محدوده اطلاعاتی ما محدود به کایروپراکتیک، اسکلتی عضلانی، داروهای فیزیکی، سلامتی، کمک کننده به علت اختلالات احشایی در ارائه های بالینی، پویایی بالینی رفلکس سوماتوویسرال مرتبط، کمپلکس های سابلوکساسیون، مسائل حساس سلامتی، و/یا مقالات، موضوعات و بحث های پزشکی کاربردی.
ارائه و ارائه می کنیم همکاری بالینی با متخصصین رشته های مختلف هر متخصص بر اساس حوزه فعالیت حرفه ای و صلاحیت مجوز آنها اداره می شود. ما از پروتکل های عملکردی سلامت و تندرستی برای درمان و حمایت از مراقبت از آسیب ها یا اختلالات سیستم اسکلتی عضلانی استفاده می کنیم.
ویدیوها، پستها، موضوعات، موضوعات و بینشهای ما، موضوعات، مسائل و موضوعات بالینی را پوشش میدهد که به طور مستقیم یا غیرمستقیم به حوزه عمل بالینی ما مربوط میشود و به طور مستقیم یا غیرمستقیم از آن پشتیبانی میکند.*
دفتر ما به طور منطقی تلاش کرده است تا استنادات حمایتی ارائه دهد و مطالعه تحقیقاتی یا مطالعات مرتبط با پست های ما را شناسایی کرده است. ما کپی از مطالعات تحقیقاتی پشتیبانی را که در صورت درخواست در دسترس هیئت های نظارت و عموم است ، ارائه می دهیم.
ما می فهمیم که مواردی را پوشش می دهیم که نیاز به توضیح اضافی در مورد چگونگی کمک به آن در یک برنامه مراقبت خاص یا پروتکل درمانی دارند. بنابراین ، برای بحث بیشتر در مورد موضوع فوق ، لطفاً آزادانه س .ال کنید دکتر الکس جیمنز، دی سی, و یا با ما تماس بگیرید در 915-850-0900.
ما برای کمک به شما و خانواده شما اینجا هستیم.
نعمت
دکتر الکس جیمنز DC ، MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
ایمیل شما: coach@elpasofunctionalmedicine.com
دارای مجوز به عنوان دکتر کایروپراکتیک (DC) در وابسته به تکزاس & نیومکزیکو*
مجوز تگزاس دی سی شماره TX5807, نیومکزیکو دی سی مجوز # NM-DC2182
دارای مجوز به عنوان پرستار ثبت شده (RN*) in فلوریدا
مجوز RN مجوز فلوریدا # RN9617241 (شماره کنترل 3558029)
وضعیت فشرده: مجوز چند ایالتی: مجاز به تمرین در کشورهای 40*
دکتر الکس جیمنز DC، MSACP، RN* CIFM*، IFMCP*، ATN*، CCST
کارت ویزیت دیجیتال من